Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) SỞ GIÁO D C Ụ VÀ ĐÀO KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ T O Ạ TRUNG H C Ọ PH Ổ THÔNG C P Ấ T N Ỉ H (B N Ả G B) GIA LAI NĂM H C Ọ : 2022 - 2023 Môn: HÓA H C Ọ Đ C Ề THỨC
Thời gian: 180 phút (không kể th i ờ gian giao đ ) ề (Gồm 8 bài 3 trang) Ngày thi: 17/12/2022 H và ọ
tên thí sinh: ........................................................................S bá ố
o danh:......................................... Cho bi t:
ế Thể tích các khí đo ở đi u ki ề n t ệ iêu chuẩn. Nguyên t kh ử i
ố : H=1; O=16; C=12; N=14; S=32; Cl=35,5; Na= 23; K=39; Fe=56; Cu=64; Ca= 40; Mg=24; Ba=137; Br=80. Bài 1 (2,5 đi m) ể 1. Ph n ầ trăm kh i ố lư ng ợ c a ủ nguyên tố R trong h p ợ ch t ấ khí v i
ớ hiđro (trong đó R có s ố oxi
hóa thấp nhất) là a%, còn trong oxit cao nhất là b%. a) Xác đ nh ị R bi t ế a : b = 3,176 b) H p c ợ hất khí v i ớ hidro c a
ủ nguyên tố R trên có tan tốt trong nư c ớ không? Gi i ả thích.
2. Hoàn thành và cân bằng các phản ng ứ hóa h c ọ sau theo phư ng phá ơ p thăng b ng e ằ lectron: a) NO2 + NaOH NaNO → 2 + ......... + H2O
b) FeCO3 + FeS2 + HNO3 Fe2(SO4)3 + …… + NO + H2O. Bài 2 (2,5 đi m) ể
1. Hấp thụ SO3 vào axit H2SO4 đặc tạo ra oleum theo phư ng t ơ rình: H2SO4 + nSO3 H2SO4.nSO3
Hòa tan 10,14 gam oleum vào nư c ớ thu đư c ợ dung d c ị h A. Đ ể trung hòa A thì c n ầ v a ừ đ ủ 240 ml dung d c ị h KOH 1M. a) Tính giá tr c ị a ủ n.
b) Cần lấy bao nhiêu gam oleum trên hòa tan vào 200 gam nư c ớ để thu đư c ợ dung d c ị h H2SO4 10% ? 2. Nêu thu c ố th , ử hi n ệ tư ng, ợ vi t ế phư ng ơ trình phân t , ử phư ng ơ trình ion thu g n ọ khi dùng phư ng ơ pháp hóa h c ọ để phân bi t ệ các dung d c ị h đ ng ự trong các l ọ riêng bi t ệ m t ấ nhãn sau: NH4NO3, Ba(NO3)2, Mg(NO3)2, NH4Cl. Bài 3 (2,0 đi m) ể 1. D n ẫ 0,02 mol h n ỗ h p ợ X (g m ồ CO2 và h i ơ nư c
ớ ) qua than nóng đỏ thu đư c ợ 0,035 mol h n ỗ h p ợ khí Y g m
ồ H2, CO và CO2. Viết phản ng ứ x y ả ra và tính ph n ầ trăm th ể tích khí CO2 trong h n ỗ h p ợ Y. 2. Hòa tan h t ế m gam h n ỗ h p ợ X g m
ồ Mg, Fe, Mg(NO3)2, Cu(NO3)2 và Fe(NO3)2 (trong đó N
chiếm 8,353% về khối lư ng) ợ trong dung d c ị h ch a
ứ 0,32 mol H2SO4 loãng, sau khi k t ế thúc ph n ả ng, ứ thu đư c ợ dung d c ị h Y chỉ ch a ứ 41,64 gam các mu i
ố sunfat trung hòa và 1,12 lít h n ỗ h p ợ khí Z g m ồ
N2O, N2 và a (mol) H2. Cho dung d c ị h NaOH d và ư o Y (không có m t ặ oxi) thu đư c ợ 21,1 gam k t ế t a ủ T. Nung toàn b
ộ T ngoài không khí thì cần b (mol) O2 đến kh i ố lư ng không đ ợ i
ổ thu được 16,0 gam rắn. Tìm giá tr c ị a ủ a và b. Bài 4 (2,0 đi m) ể M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) 1. Nêu 3 phư ng ơ pháp hóa h c ọ đi u ề chế Cu t ừ đ ng ồ cacbonat baz
ơ (CuCO3.Cu(OH)2). Viết các phư ng t ơ rình hóa h c ọ . 2. Đi n ệ phân 400 ml dung d c ị h g m
ồ NaCl, HCl và CuSO4 0,02M với đi n ệ c c ự trơ và màn ngăn x p. ố Cư ng ờ độ đòng đi n
ệ là 1,93 A. Coi thể tích dung d c ị h không thay đ i ổ trong quá trình đi n ệ phân. Ch s ỉ pH ố theo th i ờ gian đư c ợ bi u di ể n b ễ ng đ ằ t ồ hị sau đây (xét nhi ở t ệ đ 25 ộ 0C, hi u s ệ uất đi n phâ ệ n 100%) pH 13 7 2 x t(s) Tìm giá tr ịx. Bài 5 (2,5 đi m) ể Chất h u ữ cơ m c ạ h hở X có công th c ứ phân tử trùng v i ớ công th c ứ đ n ơ gi n ả nh t ấ . Đ t ố cháy hoàn toàn m gam X c n ầ v a
ừ đủ 6,72 lít khí O2, thu đư c ợ 0,55 mol h n ỗ h p ợ g m ồ CO2 và H2O. Hấp thụ
hết sản phẩm cháy vào dung d c ị h Ca(OH)2, sau ph n ả ng ứ thu đư c ợ 10,0 gam k t ế t a ủ và kh i ố lư ng ợ phần dung d c ị h tăng lên 7,7 gam. 1. Xác đ nh ị công th c ứ phân tử c a ủ chất X.
2. Cho m gam X tác d ng ụ v a ừ đ ủ v i ớ dung d c ị h ch a ứ 0,1 mol NaOH, thu đư c ợ 0,9 gam H2O và m t ộ chất h u c ữ ơ Y. Xác đ nh ị công th c ứ cấu tạo c a ủ X. 3. Từ Y có thể t o
ạ axit axetic qua hai giai đo n. ạ Vi t ế các phư ng ơ trình hóa h c ọ th c ự hi n ệ sự chuyển hóa này. Bài 6 (3,5 đi m) ể 1. H p ợ chất h u ữ cơ A có ph n ầ trăm kh i ố lư ng ợ cacbon và hiđro l n ầ lư t ợ b ng ằ 82,76% và 17,24%. a) Xác đ nh ị công th c ứ phân tử c a ủ ch t ấ A. Vi t ế công th c ứ c u ấ t o ạ và g i ọ tên t t ấ c ả các đ ng ồ phân ng v ứ i ớ công th c ứ phân tử đó. b) Cho clo tác d ng ụ v i ớ đ ng
ồ phân không phân nhánh c a ủ A, chỉ thu đư c ợ các s n ả ph m ẩ monoclo. Tính ph n ầ trăm kh i ố lư ng ợ c a ủ m i ỗ s n ả ph m ẩ đó, bi t ế r ng
ằ nguyên tử hiđro liên k t ế v i ớ
cacbon bậc hai có khả năng b t ị hế cao h n 3 l ơ ần so v i ớ nguyên t hi ử đro liên k t ế v i ớ cacbon b c ậ m t ộ . 2. Nung nóng h n ỗ h p ợ X g m
ồ 0,1 mol axetilen; 0,2 mol propen; 0,1 mol etilen và 0,6 mol hiđro v i ớ xúc tác Ni, sau m t ộ th i ờ gian thu đư c ợ h n ỗ h p ợ Y có t ỉkh i ố h i ơ so v i ớ X bằng a. Cho h n ỗ h p ợ Y tác d ng v ụ i ớ brom d t ư rong CCl4 thấy có t i
ố đa 16 gam brom phản ng. ứ Hãy tính giá tr c ị a ủ a. 3. Đi u ề chế etilen (khí T) b ng ằ cách đun nóng dung d c ị h E g m ồ hai ch t ấ tan, thu khí T b ng ằ phư ng phá ơ p đẩy nư c ớ theo s đ ơ ồ hình v d ẽ ư i ớ đây. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả )
a) Tìm các hóa chất có trong dung d c ị h E. b) Cho bi t ế vai trò c a ủ đá b t ọ . c) Viết phư ng ơ trình hóa h c
ọ điều chế etilen trong quá trình đi u c ề hế trên. d) Viết m t ộ s ph ố ản ng ph ứ c
ụ ó thể xảy ra trong quá trình đi u c ề h t ế rên. Bài 7 (2,5 đi m) ể C H O 1. H p ợ chất X có công th c
ứ phân tử 9 16 4 . Từ X thực hi n ệ các ph n ả ng ứ (theo đúng tỉ lệ mol)
(a) X 2NaOH X X H O 1 2 2 X H SO X Na SO (b) 1 2 4 3 2 4
nX nX nilon 6,6 2nH O (c) 3 4 2 (d) X O
2 +CuO → X 5 +Cu + H 2 Biết X5 là h p
ợ chất cacbonyl và không cho ph n ả ng ứ tráng b c ạ . Hãy xác đ nh ị công th c ứ c u t ấ o ạ c a
ủ X và viết các phư ng t ơ rình hóa h c ọ x y ra ả . Vi t ế ph n ả ng đi ứ u c ề h X ế 5 t c ừ umen. 2. Cho 13,8 gam ch t ấ h u ữ cơ X (g m ồ C, H, O; tỉ khối h i ơ c a ủ X so v i ớ oxi < 5) vào dung d c ị h KOH v a ừ đ , ủ đun nóng, sau đó ch ng ư khô. Ph n ầ h i ơ bay ra ch ỉcó nư c ớ , ph n ầ ch t ấ r n ắ khan Y còn l i ạ có kh i ố lư ng ợ 27,0 gam. Đ t
ố cháy toàn bộ Y trong oxi dư t i ớ khi ph n ả ng ứ hoàn toàn, thu đư c ợ 20,7 gam K2CO3 và h n ỗ h p ợ khí và h i ơ Z. Cho Z h p ấ th ụ hoàn toàn vào dung d c ị h ch a ứ 0,4 mol Ca(OH)2 thu đư c ợ 25 gam k t ế t a ủ và dung d c ị h T có kh i ố lư ng ợ tăng lên so v i ớ dung d c
ị h Ca(OH)2 ban đầu là 3,7
gam. Đun nóng T lại có kết t a ủ xuất hiện n a ữ . a) Xác đ nh c ị ông th c ứ phân t c ử ủa X. b) Cho X vào nư c ớ brom v a ừ đủ thu đư c ợ m t ộ sản phẩm h u
ữ cơ (W) có 51,282% Br về kh i ố lư ng ợ (không có s n ả ph m ẩ khí thoát ra). Bi t ế các ph n ả ng ứ x y
ả ra hoàn toàn. Viết phư ng ơ trình hóa h c ọ xảy ra và xác đ nh c ị ông th c ứ cấu tạo c a ủ X và W. Bài 8 (2,5 đi m) ể 1. H n h ỗ p
ợ E gồm chất X (C5H14N2O4, là mu i ố của axit h u c ữ ơ đa ch c
ứ ) và chất Y (C2H7NO3, là mu i ố c a ủ m t ộ axit vô c ). ơ Cho m t ộ lư ng ợ E tác d ng h ụ ết v i ớ dung d c
ị h chứa 0,7 mol NaOH, đun nóng. Sau khi các ph n ả ng ứ x y ả ra hoàn toàn, thu đư c ợ 0,4 mol h n ỗ h p ợ hai khí có s ố mol b ng ằ nhau và 120 gam dung d c ị h Z. Tính n ng ồ đ % c ộ
ác chất tan có trong dung d c ị h Z.
2. X, Y, Z là các peptit m c ạ h h ở có s ố nguyên t ử cacbon trong phân t ử m i ỗ ch t ấ l n ầ lư t ợ là 4, 7, 11. Đun nóng 28,42 gam h n ỗ h p ợ E (ch a ứ X, Y, Z) v i ớ dung d c ị h NaOH v a ừ đ , ủ thu đư c ợ h n ỗ h p ợ T g m ồ ba mu i ố c a
ủ glyxin, alanin và valin. T tác d ng ụ t i ố đa v i ớ dung d c ị h ch a ứ 0,88 mol HCl, thu đư c ợ dung d c ị h chứa 76,34 gam mu i ố . a) Xác đ nh c ị ông thức cấu tạo c a ủ X, Y, Z (ch vi ỉ ết 1 công th c ứ cấu tạo thu g n c ọ ho mỗi chất).
b) Tính thành phần % về khối lư ng ợ c a ủ các chất trong h n ỗ h p ợ E. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả )
----------------------- H T
Ế ---------------------
* Thí sinh không được s d ử ng ụ
bảng tuần hoàn các nguyên tố hóa học.
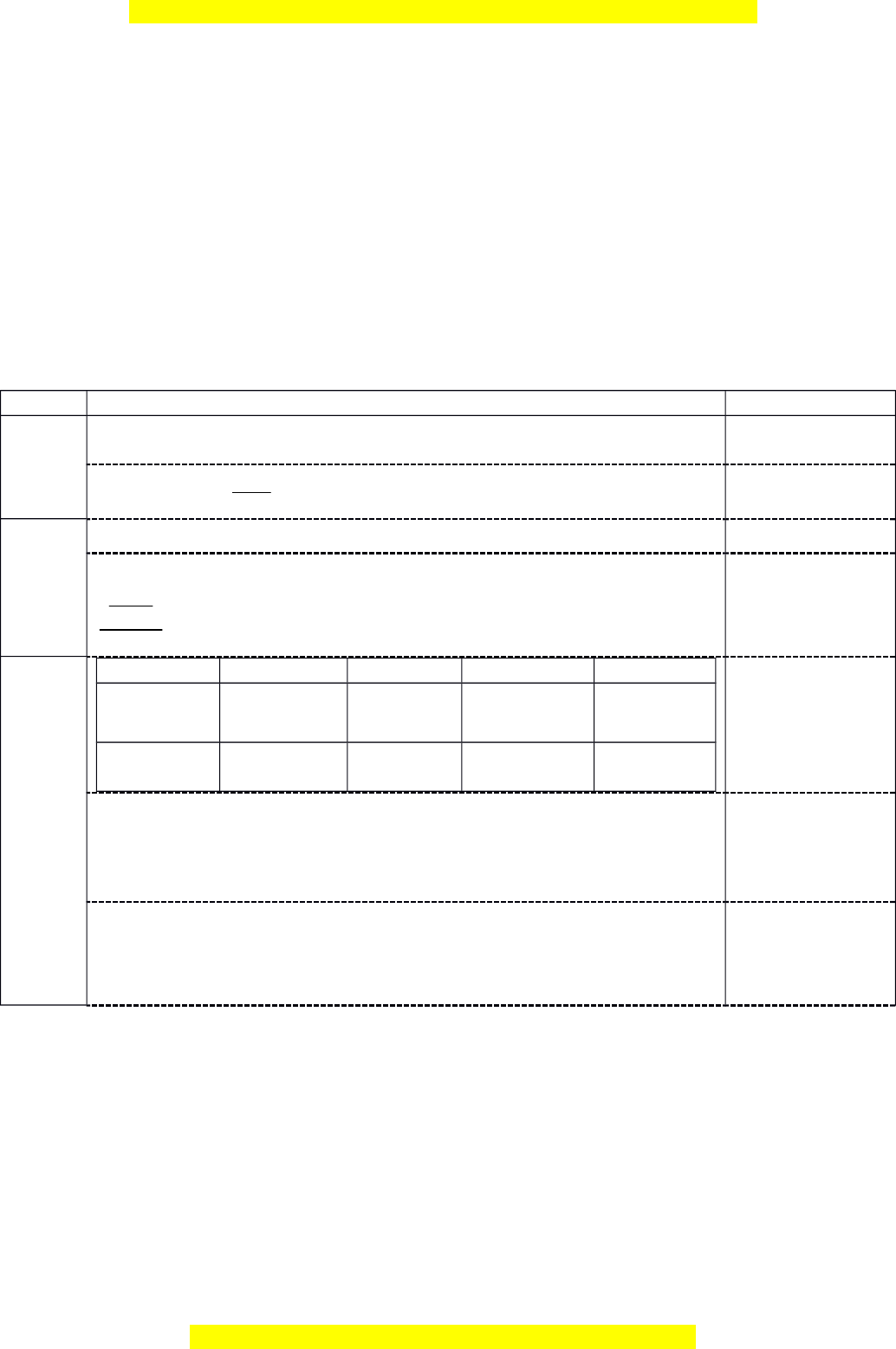
* Giám thi không giải thích gì thêm. SỞ GIÁO D C Ụ VÀ ĐÀO KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ T O Ạ TRUNG H C Ọ PH Ổ THÔNG C P Ấ T N Ỉ H (B N Ả G B) GIA LAI NĂM H C Ọ : 2022 - 2023 HƯ N Ớ G D N Ẫ CH M Ấ MÔN HÓA H C Ọ (G m ồ có 09 trang) Bài 1 (2,5 đi m) ể 1. Ph n ầ trăm kh i ố lư ng ợ c a ủ nguyên tố R trong h p ợ ch t ấ khí v i
ớ hiđro (trong đó R có s ố oxi
hóa thấp nhất) là a%, còn trong oxit cao nhất là b%. a) Xác đ nh ị R bi t ế a:b = 3,176 b) H p c ợ hất khí v i ớ hidro c a ủ nguyên tố R t ở rên có tan t t ố trong nư c ớ không? Gi i ả thích.
2. Hoàn thành và cân bằng các phản ng ứ hóa h c ọ sau theo phư ng phá ơ p thăng b ng e ằ lectron: a) NO2 + NaOH NaNO → 2 + ......... + H2O
b) FeCO3 + FeS2 + HNO3 Fe2(SO4)3 + …… + NO + H2O. STT HƯỚNG D N Ẫ CH M Ấ ĐI M Ể R 2R %m .100 ; a %m .100 b R(RH ) R( 0,25 điểm x 2 R 8 O x R x
2R 16(8 x) 1a
a : b = 3,176 128 22,352x 4 , 352R 0,25 điểm x = 3, R = 14 (N) 0,25 điểm NH3 tan t t ố trong nước. Vì 1b - Phân t N ử H3 phân c c ự 0,25 điểm - Tạo đư c ợ liên k t ế hidro v i ớ nước NO2 + NaOH NaNO ể → 2 + NaNO3 + H2O 0,25 đi m 1x N+4 N+5 + 1e 2a → 0,25 điểm 1x N+4 + 1e N+3 → 2NO2 + 2NaOH NaNO ể → 2 + NaNO3 + H2O 0,25 đi m
FeCO3 + FeS2 + HNO3 Fe2(SO4)3 + CO2 + NO + H2O 0,25 điểm 2 3 6 3x Fe 3 FeS 4Fe 6 S 46e 2b 2 0,25 điểm 5 2 46x N 3e N
3FeCO3 + 9FeS2 + 46HNO3 6Fe2(SO4)3 + 3CO2 + 46NO + 23H2O 0,25 điểm Bài 2 (2,5 đi m) ể M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Gia Lai năm 2023 có đáp án
1.1 K
536 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1053587071- NGUYEN VAN DOAN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Gia Lai năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1072 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀOỞ Ụ
T OẠ
GIA LAI
Đ C TH CỀ Ứ
(G m 8 bài 3 trang)ồ
KỲ THI CH N H C SINH GI IỌ Ọ Ỏ
TRUNG H C PH THÔNG C P T NH (B NG B)Ọ Ổ Ấ Ỉ Ả
NĂM H C: 2022 - 2023Ọ
Môn: HÓA H CỌ
Th i gian:ờ 180 phút (không k th i gian giao đ )ể ờ ề
Ngày thi: 17/12/2022
H và tên thí sinh: ọ ........................................................................S báo danh:ố .........................................
Cho bi t: ế Th tích các khí đo đi u ki n tiêu chu n.ể ở ề ệ ẩ
Nguyên t kh i:ử ố H=1; O=16; C=12; N=14; S=32; Cl=35,5; Na= 23; K=39; Fe=56; Cu=64;
Ca= 40; Mg=24; Ba=137; Br=80.
Bài 1 (2,5 đi m)ể
1. Ph n trăm kh i l ng c a nguyên t R trong h p ch t khí v i hiđro (trong đó R có s oxiầ ố ượ ủ ố ợ ấ ớ ố
hóa th p nh t) là a%, còn trong oxit cao nh t là b%. ấ ấ ấ
a) Xác đ nh R bi t a : b = 3,176ị ế
b) H p ch t khí v i hidro c a nguyên t R trên có tan t t trong n c không? Gi i thích.ợ ấ ớ ủ ố ố ướ ả
2. Hoàn thành và cân b ng các ph n ng hóa h c sau theo ph ng pháp thăng b ng electron:ằ ả ứ ọ ươ ằ
a) NO
2
+ NaOH
→
NaNO
2
+ ......... + H
2
O
b) FeCO
3
+ FeS
2
+ HNO
3
Fe
2
(SO
4
)
3
+ …… + NO + H
2
O.
Bài 2 (2,5 đi m)ể
1. H p th SOấ ụ
3
vào axit H
2
SO
4
đ c t o ra oleum theo ph ng trình: ặ ạ ươ
H
2
SO
4
+ nSO
3
H
2
SO
4
.nSO
3
Hòa tan 10,14 gam oleum vào n c thu đ c dung d ch A. Đ trung hòa A thì c n v a đ 240 mlướ ượ ị ể ầ ừ ủ
dung d ch KOH 1M.ị
a) Tính giá tr c a n.ị ủ
b) C n l y bao nhiêu gam oleum trên hòa tan vào 200 gam n c đ thu đ c dung d ch Hầ ấ ướ ể ượ ị
2
SO
4
10% ?
2. Nêu thu c th , hi n t ng, vi t ph ng trình phân t , ph ng trình ion thu g n khi dùngố ử ệ ượ ế ươ ử ươ ọ
ph ng pháp hóa h c đ phân bi t các dung d ch đ ng trong các l riêng bi t m t nhãn sau: NHươ ọ ể ệ ị ự ọ ệ ấ
4
NO
3
,
Ba(NO
3
)
2
, Mg(NO
3
)
2
, NH
4
Cl.
Bài 3 (2,0 đi m)ể
1. D n 0,02 mol h n h p X (g m COẫ ỗ ợ ồ
2
và h i n c) qua than nóng đ thu đ c 0,035 mol h nơ ướ ỏ ượ ỗ
h p khí Y g m Hợ ồ
2
, CO và CO
2
. Vi t ph n ng x y ra và tính ph n trăm th tích khí COế ả ứ ả ầ ể
2
trong h n h pỗ ợ
Y.
2. Hòa tan h t m gam h n h p X g m Mg, Fe, Mg(NOế ỗ ợ ồ
3
)
2
, Cu(NO
3
)
2
và Fe(NO
3
)
2
(trong đó N
chi m 8,353% v kh i l ng) trong dung d ch ch a 0,32 mol Hế ề ố ượ ị ứ
2
SO
4
loãng, sau khi k t thúc ph n ng,ế ả ứ
thu đ c dung d ch Y ch ch a 41,64 gam các mu i sunfat trung hòa và 1,12 lít h n h p khí Z g mượ ị ỉ ứ ố ỗ ợ ồ
N
2
O, N
2
và a (mol) H
2
. Cho dung d ch NaOH d vào Y (không có m t oxi) thu đ c 21,1 gam k t t a T.ị ư ặ ượ ế ủ
Nung toàn b T ngoài không khí thì c n b (mol) Oộ ầ
2
đ n kh i l ng không đ i thu đ c 16,0 gam r n. ế ố ượ ổ ượ ắ
Tìm giá tr c a a và b.ị ủ
Bài 4 (2,0 đi m)ể
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
1. Nêu 3 ph ng pháp hóa h c đi u ch Cu t đ ng cacbonat baz (CuCOươ ọ ề ế ừ ồ ơ
3
.Cu(OH)
2
). Vi t cácế
ph ng trình hóa h c.ươ ọ
2. Đi n phân 400 ml dung d ch g m NaCl, HCl và CuSOệ ị ồ
4
0,02M v i đi n c c tr và màn ngănớ ệ ự ơ
x p. C ng đ đòng đi n là 1,93 A. Coi th tích dung d ch không thay đ i trong quá trình đi n phân.ố ườ ộ ệ ể ị ổ ệ
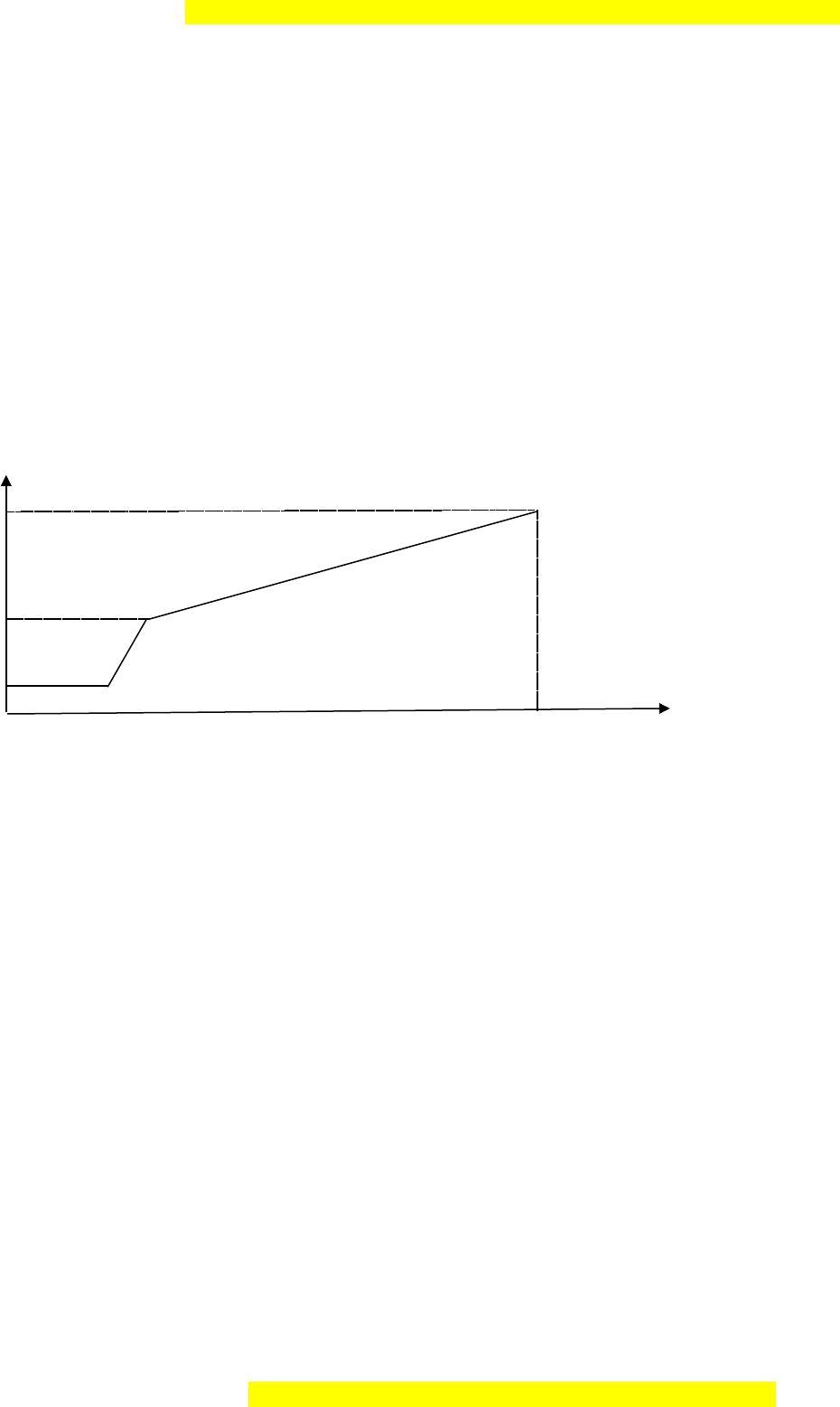
Ch s pH theo th i gian đ c bi u di n b ng đ th sau đây (xét nhi t đ 25ỉ ố ờ ượ ể ễ ằ ồ ị ở ệ ộ
0
C, hi u su t đi n phânệ ấ ệ
100%)
pH
13
7
2
x t(s)
Tìm giá tr x.ị
Bài 5 (2,5 đi m)ể
Ch t h u c m ch h X có công th c phân t trùng v i công th c đ n gi n nh t. Đ t cháyấ ữ ơ ạ ở ứ ử ớ ứ ơ ả ấ ố
hoàn toàn m gam X c n v a đ 6,72 lít khí Oầ ừ ủ
2
, thu đ c 0,55 mol h n h p g m COượ ỗ ợ ồ
2
và H
2
O. H p thấ ụ
h t s n ph m cháy vào dung d ch ế ả ẩ ị Ca(OH)
2
, sau ph n ng thu đ c ả ứ ượ 10,0 gam k t t a và kh i l ngế ủ ố ượ
ph n dung d ch ầ ị tăng lên 7,7 gam.
1. Xác đ nh công th c phân t c a ch t X.ị ứ ử ủ ấ
2. Cho m gam X tác d ng v a đ v i dung d ch ch a 0,1 mol NaOH, thu đ c 0,9 gam Hụ ừ ủ ớ ị ứ ượ
2
O và
m t ch t h u c Y.ộ ấ ữ ơ Xác đ nh công th c c u t o c a X.ị ứ ấ ạ ủ
3. T Y có th t o axit axetic qua hai giai đo n. Vi t các ph ng trình hóa h c th c hi n sừ ể ạ ạ ế ươ ọ ự ệ ự
chuy n hóa này. ể
Bài 6 (3,5 đi m)ể
1. H p ch t h u c A có ph n trăm kh i l ng cacbon và hiđro l n l t b ng 82,76%ợ ấ ữ ơ ầ ố ượ ầ ượ ằ và
17,24%.
a) Xác đ nh công th c phân t c a ch t A. Vi t công th c c u t o và g i tên t t c các đ ngị ứ ử ủ ấ ế ứ ấ ạ ọ ấ ả ồ
phân ng v i công th c phân t đó.ứ ớ ứ ử
b) Cho clo tác d ng v i đ ng phân ụ ớ ồ không phân nhánh c a A, ch thu đ c các s n ph mủ ỉ ượ ả ẩ
monoclo. Tính ph n trăm kh i l ng c a m i s n ph m đó, bi t r ng nguyên t hiđro liên k t v iầ ố ượ ủ ỗ ả ẩ ế ằ ử ế ớ
cacbon b c hai có kh năng b th cao h n 3 l n so v i nguyên t hiđro liên k t v i cacbon b c m t. ậ ả ị ế ơ ầ ớ ử ế ớ ậ ộ
2. Nung nóng h n h p X g m 0,1 mol axetilen; 0,2 mol propen; 0,1 mol etilen và 0,6 mol hiđroỗ ợ ồ
v i xúc tác Ni, sau m t th i gian thu đ c h n h p Y có t kh i ớ ộ ờ ượ ỗ ợ ỉ ố h i ơ so v i ớ X b ng ằ a. Cho h n h p Yỗ ợ
tác d ng v i brom d trong CClụ ớ ư
4
th y có t i đa ấ ố 16 gam brom ph n ng. ả ứ Hãy tính giá tr c a ị ủ a.
3. Đi u ch etilen (khí T) b ng cách đunề ế ằ nóng dung d ch E g m hai ch t tan, thu khí T b ngị ồ ấ ằ
ph ng pháp đ y n c theo s đ hình v d i đây.ươ ẩ ướ ơ ồ ẽ ướ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
a) Tìm các hóa ch t có trong dung d ch E.ấ ị
b) Cho bi t vai trò c a đá b t. ế ủ ọ
c) Vi t ph ng trình hóa h c ế ươ ọ đi u ch etilen trong quá trình đi u ch trênề ế ề ế .
d) Vi t m t s ph n ng ph có th x y ra trong quá trình đi u ch trên. ế ộ ố ả ứ ụ ể ả ề ế
Bài 7 (2,5 đi m)ể
1. H p ch t X có công th c phân t ợ ấ ứ ử
9 16 4
C H O
. T X th c hi n các ph n ng (theo đúng t lừ ự ệ ả ứ ỉ ệ
mol)
(a)
1 2 2
X 2NaOH X X H O
(b)
1 2 4 3 2 4
X H SO X Na SO
(c)
3 4 2
nX nX nilon 6,6 2nH O
(d)
X
2
+CuO→ X
5
+Cu+H
2
O
Bi t Xế
5
là h p ch t cacbonyl và không cho ph n ng tráng b c. Hãy xác đ nh công th c c u t oợ ấ ả ứ ạ ị ứ ấ ạ
c a X và vi t các ph ng trình hóa h c x y ra. Vi t ph n ng đi u ch Xủ ế ươ ọ ả ế ả ứ ề ế
5
t cumen.ừ
2. Cho 13,8 gam ch t h u c X (g m ấ ữ ơ ồ C, H, O; t kh i h i c a X so v i ỉ ố ơ ủ ớ oxi < 5) vào dung d chị
KOH v a đ , đun nóng, sau đó ch ng khô. Ph n h i bay ra ch có n c, ph n ch t r n khan Y còn l iừ ủ ư ầ ơ ỉ ướ ầ ấ ắ ạ
có kh i l ng ố ượ 27,0 gam. Đ t cháy toàn b Y trong oxi d t i khi ph n ng hoàn toàn, thu đ c ố ộ ư ớ ả ứ ượ 20,7
gam K
2
CO
3
và h n h p khí và h i Z. Cho Z h p th hoàn toàn vào ỗ ợ ơ ấ ụ dung d ch ch a 0,4 mol Ca(OH)ị ứ
2
thu
đ c 25 gam k t t a và dung d ch T có kh i l ng tăng lên so v i ượ ế ủ ị ố ượ ớ dung d ch Ca(OH)ị
2
ban đ u là 3,7ầ
gam. Đun nóng T l i có k t t aạ ế ủ xu t hi nấ ệ n a. ữ
a) Xác đ nh công th c phân t c a X.ị ứ ử ủ
b) Cho X vào n c brom v a đ thu đ c ướ ừ ủ ượ m t ộ s n ph m h u cả ẩ ữ ơ (W) có 51,282% Br v kh iề ố
l ngượ (không có s n ph m khí thoát ra)ả ẩ . Bi t các ph n ng x y ra hoàn ế ả ứ ả toàn. Vi t ph ng trình hóaế ươ
h c x y ra và xác đ nh công th c c u t o c a X và W.ọ ả ị ứ ấ ạ ủ
Bài 8 (2,5 đi m)ể
1. H n h p ỗ ợ E g m ch t ồ ấ X (C
5
H
14
N
2
O
4
, là mu i c a axit h u c đa ch c) và ch t ố ủ ữ ơ ứ ấ Y (C
2
H
7
NO
3
, là
mu i c a m t axit vô c ). Cho m t l ng ố ủ ộ ơ ộ ượ E tác d ng h t v i dung d ch ch a 0,7 mol NaOH, đun nóng.ụ ế ớ ị ứ
Sau khi các ph n ng x y ra hoàn toàn, thu đ c 0,4 mol h n h p hai khí có s mol b ng nhau và ả ứ ả ượ ỗ ợ ố ằ 120
gam dung d ch ị Z. Tính n ng đ % các ch t tan có trong dung d ch Z.ồ ộ ấ ị
2. X, Y, Z là các peptit m ch h có s nguyên t cacbon trong phân t m i ch t l n l t là 4, 7,ạ ở ố ử ử ỗ ấ ầ ượ
11. Đun nóng 28,42 gam h n h p ỗ ợ E (ch a X, Y, Z) ứ v i dung d ch NaOH v a đ , thu đ c h n h p Tớ ị ừ ủ ượ ỗ ợ
g m ba mu i c a glyxin, alanin và valin. T ồ ố ủ tác d ng t i đa v i dung d ch ch a 0,88 mol HCl, thu đ cụ ố ớ ị ứ ượ
dung d ch ch a 76,34 gam mu i. ị ứ ố
a) Xác đ nh công th c c u t o c a X, Y, Z (ch vi t 1 công th c c u t o thu g n cho m i ch t).ị ứ ấ ạ ủ ỉ ế ứ ấ ạ ọ ỗ ấ
b) Tính thành ph n ầ % v ề kh i l ng c a ố ượ ủ các ch tấ trong h n h p ỗ ợ E.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
----------------------- H TẾ ---------------------
* Thí sinh không đ c s d ng ượ ử ụ b ng tu n hoàn các nguyên t hóa hả ầ ố ọc.
* Giám thi không gi i thích gì thêm.ả
S GIÁO D C VÀ ĐÀOỞ Ụ
T OẠ
GIA LAI
KỲ THI CH N H C SINH GI I Ọ Ọ Ỏ
TRUNG H C PH THÔNG C P T NH (B NG B)Ọ Ổ Ấ Ỉ Ả
NĂM H C: 2022 - 2023Ọ
H NG D N CH M MÔN HÓA H CƯỚ Ẫ Ấ Ọ
(G m có 09 trang)ồ
Bài 1 (2,5 đi m)ể
1. Ph n trăm kh i l ng c a nguyên t R trong h p ch t khí v i hiđro (trong đó R có s oxiầ ố ượ ủ ố ợ ấ ớ ố
hóa th p nh t) là a%, còn trong oxit cao nh t là b%. ấ ấ ấ
a) Xác đ nh R bi t a:b = 3,176ị ế
b) H p ch t khí v i hidro c a nguyên t R trên có tan t t trong n c không? Gi i thích.ợ ấ ớ ủ ố ở ố ướ ả
2. Hoàn thành và cân b ng các ph n ng hóa h c sau theo ph ng pháp thăng b ng electron:ằ ả ứ ọ ươ ằ
a) NO
2
+ NaOH
→
NaNO
2
+ ......... + H
2
O
b) FeCO
3
+ FeS
2
+ HNO
3
Fe
2
(SO
4
)
3
+ …… + NO + H
2
O.
STT H NG D N CH MƯỚ Ẫ Ấ ĐI MỂ
1a
2 8
( ) (
2
% .100 ;% .100
2 16(8 )
x x
R RH R R O
R R
m a m b
R x R x
0,25 đi mể
a : b = 3,176
128 22,352 4,352x R
0,25 đi mể
x = 3, R = 14 (N) 0,25 đi mể
1b
NH
3
tan t t trong n c. Vìố ướ
- Phân t NHử
3
phân c cự
- T o đ c liên k t hidro v i n c ạ ượ ế ớ ướ
0,25 đi mể
2a
NO
2
+ NaOH
→
NaNO
2
+ NaNO
3
+ H
2
O 0,25 đi mể
1x N
+4
→
N
+5
+ 1e
1x N
+4
+ 1e
→
N
+3
0,25 đi mể
2NO
2
+ 2NaOH
→
NaNO
2
+ NaNO
3
+ H
2
O 0,25 đi mể
2b
FeCO
3
+ FeS
2
+ HNO
3
Fe
2
(SO
4
)
3
+ CO
2
+ NO + H
2
O 0,25 đi mể
2 3 6
2
5 2
Fe 3FeS 43x
46x
N 3e N
Fe 6 S 46e
0,25 đi mể
3FeCO
3
+ 9FeS
2
+ 46HNO
3
6Fe
2
(SO
4
)
3
+ 3CO
2
+ 46NO + 23H
2
O 0,25 đi mể
Bài 2 (2,5 đi m)ể
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
1. H p th SOấ ụ
3
vào axit H
2
SO
4
đ c t o ra oleum theo ph ng trình: ặ ạ ươ
H
2
SO
4
+ nSO
3
H
2
SO
4
.nSO
3
Hòa tan 10,14 gam oleum vào n c thu đ c dung d ch A. Đ trung hòa A thì c n v a đ 240 mlướ ượ ị ể ầ ừ ủ
dung d ch KOH 1M.ị
a) Tính giá tr c a n.ị ủ
b) C n l y bao nhiêu gam oleum trên hòa tan vào 200 gam n c đ thu đ c dung d ch Hầ ấ ướ ể ượ ị
2
SO
4
10% ?
2. Nêu thu c th , hi n t ng, vi t ph ng trình phân t , ph ng trình ion thu g n khi dùngố ử ệ ượ ế ươ ử ươ ọ
ph ng pháp hóa h c đ phân bi t các dung d ch đ ng trong các l riêng bi t b m t nhãn sau:ươ ọ ể ệ ị ự ọ ệ ị ấ
NH
4
NO
3
, Ba(NO
3
)
2
, Mg(NO
3
)
2
, NH
4
Cl.
STT H NG D N CH MƯỚ Ẫ Ấ ĐI MỂ
1a
H
2
SO
4
.nSO
3
+ n H
2
O (n + 1) H
2
SO
4
H
2
SO
4
+ 2NaOH Na
2
SO
4
+ 2H
2
O
0,25 đi mể
0
0,12
10,14 .(98 80. ) 3
1
leum
m n n
n
0,5 đi mể
1b
2 4 3 2 2 4
.3 3 4H SO SO H O H SO
0,25 đi mể
G i kh i l ng oleum c n l y là x gamọ ố ượ ầ ấ
392
338
.100 10 18,87
200
x
x g
x
0,5 đi mể
2
NH
4
NO
3
Ba(NO
3
)
2
Mg(NO
3
)
2
NH
4
Cl
Dung d ch ị
NaOH
Có khí mùi
khai
- K t t a màuế ủ
tr ng ắ
Có khí
mùi khai
Dung d ch ị
AgNO
3
- - K t t a ế ủ
màu tr ngắ
0,4 đi mể
NH
4
NO
3
+ NaOH
NaNO
3
+ NH
3
+ H
2
O
NH
4
Cl + NaOH
NaCl + NH
3
+ H
2
O
Mg(NO
3
)
2
+ 2NaOH
Mg(OH)
2
+ 2NaNO
3
AgNO
3
+ NH
4
Cl
AgCl
+ NH
4
NO
3
0,2 đi mể
4 3 2
2
2
2 ( )
NH OH NH H O
Mg OH Mg OH
Ag Cl AgCl
0,4 đi mể
Bài 3 (2,0 đi m)ể
1. D n 0,02 mol h n h p X (g m COẫ ỗ ợ ồ
2
và h i n c) qua than nóng đ thu đ c 0,035 mol h nơ ướ ỏ ượ ỗ
h p khí Y g m Hợ ồ
2
, CO và CO
2
. Vi t ph n ng x y ra và tính ph n trăm th tích khí COế ả ứ ả ầ ể
2
trong h n h pỗ ợ
Y.
2. Hòa tan h t m gam h n h p X g m Mg, Fe, Mg(NOế ỗ ợ ồ
3
)
2
, Cu(NO
3
)
2
và Fe(NO
3
)
2
(trong đó N
chi m 8,353% v kh i l ng) trong dung d ch ch a 0,32 mol Hế ề ố ượ ị ứ
2
SO
4
loãng, sau khi k t thúc ph n ng,ế ả ứ
thu đ c dung d ch Y ch ch a 41,64 gam các mu i sunfat trung hòa và 1,12 lít h n h p khí Z g mượ ị ỉ ứ ố ỗ ợ ồ
N
2
O, N
2
và a (mol) H
2
. Cho dung d ch NaOH d vào Y (không có m t oxi) thu đ c 21,1 gam k t t a T.ị ư ặ ượ ế ủ
Nung toàn b T ngoài không khí thì c n b (mol) Oộ ầ
2
đ n kh i l ng không đ i thu đ c 16,0 gam r n. ế ố ượ ổ ượ ắ
Tìm giá tr c a a và b.ị ủ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ