Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ H I Ả DƯƠNG LỚP 12 THPT C P Ấ T N Ỉ H NĂM H C Ọ 2022 – 2023 Môn thi: HOÁ H C Ọ Ngày thi: 19/10/2022 Đ Ề CHÍNH TH C Ứ Th i
ờ gian làm bài: 180 phút, không tính th i ờ gian phát đề Đề thi g m ồ 05 câu, 02 trang
Câu I (2,0 đi m ể )
1. Từ H2O, đá vôi, NH3, O2, ch t ấ xúc tác và phư ng ơ ti n ệ kĩ thu t ậ c n ầ thi t, ế hãy vi t ế phư ng ơ trình phản ng ứ đi u ề ch : ế a. NH4HCO3 b. NH4NO3 2. Cho 3 ch t ấ h u ữ cơ m c ạ h hở g m:
ồ anđehit (X1), ancol (X2), ete (X3) có cùng công thức phân tử C3H6O. Vi t ế công th c ứ c u ấ t o ạ 3 ch t ấ và trình bày phư ng ơ pháp hóa h c ọ để nhận bi t ế 3 ch t ấ h u ữ c ơ trên.
3. Đốt khí A trong oxi thi u ế ta đư c ợ ch t ấ r n
ắ C màu vàng. Khí X có màu vàng l c ụ tác dụng v i ớ khí A t o ạ ra C và F. N u ế X tác d ng ụ v i ớ A trong nư c ớ t o ạ ra dung d c ị h T ch a ứ Y và F, thêm dung d c ị h BaCl2 vào dung d c ị h T thì có k t ế t a ủ tr ng ắ . Cho A tác d ng ụ v i ớ dung dịch c a ủ ch t ấ G t o ạ ra ch t ấ k t ế t a
ủ H màu đen. Cho MA + MG = 365. a. Xác đ nh ị các ch t ấ có kí hi u ệ A, C, F, G, H, X, Y? b. Vi t ế các phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra.
Câu II (2,0 điểm)
1. Đốt cháy hoàn toàn 27,6 gam ch t ấ h u ữ c ơ A (ch a ứ C,H,O) thu đư c ợ 31,36 lit CO2 (đktc) và 10,8 gam nư c ớ . a. Lập công th c ứ phân t ử c a ủ A. Bi t ế MA < 150 u b. Vi t ế các công th c ứ c u ấ t o ạ có th ể có c a ủ A và vi t ế phư ng ơ trình ph n ả ng ứ minh h a ọ Bi t: ế 1,0 mol ch t ấ A tác d ng ụ v i ớ Na d ư thu đư c ợ 0,5 mol H2. 1,0 mol ch t ấ A tác d ng ụ đư c ợ v i ớ t i ố đa 3,0 mol NaOH. 2. Chất h u ữ cơ X có công th c ứ t ng
ổ quát CxHyOz, có phân tử kh i ố M = 60 u và tham gia phản ng ứ theo s ơ đ ồ chuy n
ể hóa sau: CxHyOz CxHy-2 D Bi t: ế MD= 76u; D là h p ợ ch t ấ đa ch c
ứ , D hòa tan Cu(OH)2 ở nhi t ệ độ thư ng ờ thành dung dịch xanh đ m. ậ Tìm công th c ứ c u ấ t o ạ c a ủ X, D và vi t ế phư ng ơ trình ph n ả ng ứ hóa h c ọ c a ủ các chất theo s ơ đ ồ trên.
Câu III (2,0 đi m ể ) 1. M t ộ dung d c
ị h G có các ion (Fe3+, NH + 2- - 4 , SO4 , Al3+, NO3 ). Ti n ế hành các thí nghiệm sau v i ớ cùng V lít dung d c ị h G. - Cho dung d c ị h G tác d ng ụ v i ớ dung d c ị h KOH d , ư đun nóng. Sau ph n ả ng ứ hoàn toàn, thu đư c ợ 1,07 gam k t ế t a
ủ và 0,224 lít khí Q (đktc). - Cho dung d c ị h G tác d ng ụ v i ớ dung d c ị h NH3 d . ư Sau ph n ả ng ứ hoàn toàn, thu đư c ợ 1,85 gam k t ế t a ủ . - Cho dung d c ị h HCl dư vào dung d c ị h G thu đư c ợ dung d c ị h H, dung d c ị h H hòa tan đư c
ợ tối đa 2,24 gam Cu (thu đư c ợ khí NO là s n ả ph m ẩ kh ử duy nh t ấ c a ủ N+5). Tính tổng khối lư ng ợ muối khan thu đư c ợ khi cô c n ạ V lít dung d c ị h G.
2. Hấp thụ hoàn toàn V1 lít CO2 (ở đktc) vào 350 ml KOH 2M thu đư c ợ dung d c ị h X gồm 2 ch t
ấ tan. Nhỏ từ từ 175ml dung d c ị h Y g m
ồ (H2SO4 0,4M và HCl 1,2M) vào dung M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) dịch X thu đư c ợ 3,36 lít khí ( ở đktc). N u ế nhỏ từ từ đ n ế h t ế dung d c ị h X ở trên vào 210ml dung d c ị h Y thu đư c ợ V2 lít khí (ở đktc). Xác đ nh ị V1, V2 (Giả thi t ế r ng ằ lư ng ợ CO2 tan trong nư c ớ và ph n ả ng ứ v i ớ nư c ớ không đáng k ) ể .
3. Hỗn hợp X gồm Mg, Fe, Fe3O4 và CuO trong đó nguyên tố oxi chi m ế 16,0%
khối lượng của X. Hòa tan hoàn toàn m gam X trong V lit dung d c ị h Y ch a ứ (H2SO4
0,83M và NaNO3 0,3M), thu đư c ợ dung d c ị h Z chỉ ch a
ứ 3,275m gam muối trung hòa và
1,008 lít khí NO (đktc). Bi t ế dung d c ị h Z ph n ả n ứ g v a ừ đ ủ v i ớ 400 ml dung d c ị h KOH 1,9M. Tính giá trị c a ủ m và V ?
Câu IV (2,0 đi m ể ) 1. Đ ể trung hòa m t ộ axit cacboxylic A đ n ơ ch c ứ c n
ầ 100ml dung NaOH 1M, sau ph n ả ứng thu đư c ợ dung dịch ch a ứ 9,6 gam mu i. ố a. Xác đ nh ị công th c ứ c u ấ t o ạ c a ủ A. b. Oxi hóa h n ỗ h p ợ X g m ồ (m t ộ anđehit đ n ơ ch c ứ và m t ộ ancol đ n ơ ch c ứ b c ậ 1), thu đư c ợ m t ộ axit h u ữ c ơ A duy nh t ấ ở trên. N u
ế đem đốt cháy hoàn toàn 37,0 gam h n ỗ h p ợ X b ng ằ oxi v a ừ đ ủ r i ồ cho khí và h i ơ thoát ra h p
ấ thụ hoàn toàn vào dung d c ị h Ca(OH)2 thì thu đư c ợ 87,5 gam k t ế t a ủ và dung dịch Y. N u ế cho t i ố thi u ể 0,5 lit dung d c ị h NaOH 1M vào dung d c ị h Y thì thu đư c ợ lư ng ợ k t ế tủa là l n ớ nh t ấ . M t ặ khác, n u ế cho 37 gam h n ỗ h p ợ X vào lư ng ợ dư dung d c ị h AgNO3/NH3 đun nóng nh ẹ thì thu đư c ợ m gam k t ế t a ủ . Tính m. 2. H p ợ ch t ấ h u ữ cơ A1 (ch a
ứ 3 nguyên tố C, H, O) ch ỉch a ứ m t ộ lo i ạ nhóm ch c ứ . Cho 0,05 mol ch t ấ A1 tác d n ụ g v a ừ đủ v i ớ 500 ml dung d c ị h NaOH (kh i ố lư n ợ g riêng 1,2 g/ml) thu đư c ợ dung d c ị h B. Làm bay h i ơ dung d c ị h B thu đư c ợ 594,9 gam h i ơ nư c ớ và còn l i ạ 14,8 gam h n ỗ h p ợ các ch t ấ r n ắ khan D. N u ế đ t ố cháy hoàn toàn ch t ấ r n ắ D thu đư c ợ 7,95 gam
Na2CO3; 9,52 lít CO2 (đktc) và 4,95 gam H2O. N u ế cho h n ỗ h p ợ ch t ấ r n ắ D tác d n ụ g v i ớ dung d c ị h H2SO4 loãng d , ư r i ồ ch n ư g c t ấ thì đư c ợ 3 ch t ấ h u ữ c ơ X, Y, Z ch ỉch a ứ các nguyên tố C, H, O. Bi t ế X, Y là 2 axit h u ữ c ơ đ n ơ ch c ứ . Z tác d n ụ g v i ớ dung d c ị h Br2 t o ạ ra s n ả ph m ẩ T có kh i ố lư n ợ g phân tử l n ớ h n
ơ Z là 237u và MZ < 125u. Xác đ n ị h công th c ứ c u ấ t o ạ c a ủ A1, X, Y, Z, T. Câu V (2,0 đi m ể ) 1. Cho hỗn h p ợ g m ồ tristearin và m t ộ este đ n ơ ch c ứ , no, m c ạ h h ở X tác d ng ụ v i ớ 2,0 lít dung d c ị h NaOH 0,3M. Sau khi ph n ả ng ứ x y ả ra hoàn toàn thu đư c ợ dung d c ị h A, trung hòa dung d c ị h A b ng ằ dung d c ị h HCl v a ừ đủ thu đư c ợ dung d c ị h B ch a ứ a gam h n ỗ h p ợ ancol và b gam h n ỗ h p ợ mu i. ố Đ t
ố cháy hoàn toàn a gam h n ỗ h p ợ ancol trên trong khí oxi dư thu đư c
ợ 35,2 gam CO2 và 18 gam nư c ớ . M t ặ khác, đ t
ố cháy hoàn toàn b gam mu i ố trong oxi d ư thu đư c ợ 32,9 gam ch t ấ r n ắ khan; 334,8 gam h n ỗ h p ợ CO2 và H2O. Xác đ nh ị công th c ứ c a ủ este X. 2. Cho 40 gam h n ỗ h p ợ A g m
ồ FeCO3, Fe, Cu, Al tác d ng ụ v i ớ 120 ml dung d c ị h NaOH 2M thu đư c
ợ 5,376 lít khí hiđro (đktc). Sau khi k t ế thúc ph n ả ng ứ cho ti p ế 1,48 lít dung dịch HCl 1M thu đư c ợ h n ỗ h p ợ khí B, c n ặ r n ắ C (C không tác d ng ụ v i ớ dung d c ị h ki m) ề và dung d c ị h D. S c ụ CO2 dư vào dung d c ị h D không th y ấ xu t ấ hi n ệ k t ế t a ủ . Cho B hấp th ụ h t ế vào dung d c
ị h Ca(OH)2 dư thì thu đư c ợ 20 gam k t ế t a ủ . Cho C tác d ng ụ v i ớ dung dịch ch a
ứ 0,3 mol HNO3 đặc, nóng dư thu đư c ợ dung d c ị h E và m t ộ ch t ấ khí duy nh t ấ màu nâu đỏ (s n ả ph m ẩ khử duy nh t ấ c a ủ N+5). Bi t ế r ng ằ dung d c ị h E có th ể hòa tan t i ố đa 3,08 gam s t ắ trong đi u ề ki n ệ đun nóng, thu đư c ợ m t ộ ch t ấ khí duy nh t ấ màu nâu đ ỏ (s n ả phẩm khử duy nhất c a ủ N+5). Các ph n ả ng ứ x y
ả ra hoàn toàn. Tính kh i ố lư ng ợ c a ủ các ch t ấ trong hỗn h p ợ A ? M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) Cho nguyên t ử kh i: ố
H = 1; C = 12; N = 14; O = 16; Na = 23; Mg=24; Al = 27; S = 32; Cl = 35,5;
K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137; Pb=207. ---HẾT---
Họ và tên thí sinh....................................................Số báo danh: .................................. Chữ kí cán b coi ộ
thi số 1: ..................... Ch kí ữ cán b coi ộ thi s 2: ố .......................... SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ ĐÁP ÁN VÀ HƯ NG Ớ D N Ẫ CH M Ấ MÔN HÓA H C Ọ HẢI DƯ NG Ơ Đ Ề THI HSG12 THPT NĂM H C Ọ 2022 - 2023 (Hướng d n ẫ ch m ấ g m ồ :08 trang)
Nếu học sinh làm cách khác đúng v n ẫ cho đi m ể t i ố đa. Câu Ý Nội dung Điể m I 1 + Đi u ề ch ế NH4HCO3 CaCO 0,25 3 CaO + CO2 NH3 + CO2 + H2O NH4HCO3 + Đi u ề ch ế NH4NO3 4NH 0,25 3 + 5O2 4NO + 6H2O 2NO + O2 2NO2 4NO2 + O2 + 2H2O 4HNO3 NH3 + HNO3 NH4NO3 0,25 2 CTCT c a ủ 3 ch t ấ l n ầ lư t ợ là : 0,25
X1: CH3CH2CHO ; X2: CH2 = CH-CH2OH ; X3: CH2=CH-O-CH3. - Cho 3 m u ẫ th ử tác d ng ụ v i ớ dung d c ị h AgNO3/NH3, t0 + N u ế ch t ấ nào t o ạ k t ế t a ủ tr ng ắ là CH3CH2CHO
CH3CH2CHO + 2 AgNO3 + 3 NH3 + H2O CH3CH2COONH4 + 2NH4NO3 + 2 Ag - 2 ch t ấ còn l i ạ không hi n ệ tư ng ợ . 0,25 Cho 2 m u ẫ th ử tác d ng ụ v i ớ Na + N u ế ch t
ấ nào có H2 bay ra là CH2=CH-CH2OH
CH2 = CH-CH2OH + Na CH2=CH-CH2ONa + 1/2H2 Còn lại không có hi n ệ tư ng ợ là CH2=CH-O-CH3
3 A: H2S ; C: S ; X: Cl2 ; F : HCl 2H2S + O2 2S + 2H2O 0,25 Cl2 + H2S → S + 2HCl 0,25
Y: H2SO4 ; G: Pb(NO3)2 ;H: PbS M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả )
4Cl2 + 4H2O + H2S → H2SO4 + 8HCl
BaCl2 + H2SO4 → BaSO4 + 2HCl Pb(NO3)2 + H2S → PbS + 2HNO3 0,25 II
1 a) nC = nCO2= 1,4 mol; nH = 2nH2O = 1,2 mol; nO = (mA-12nC-1.nH)/16= 0,6 mol
nC:nH:nO = 7:6:3 => CTĐGN là C7H6O3=> CTPT A: (C7H6O3)n 0,25 Do MA< 150 => n=1 Vậy CTPT A: C7H6O3
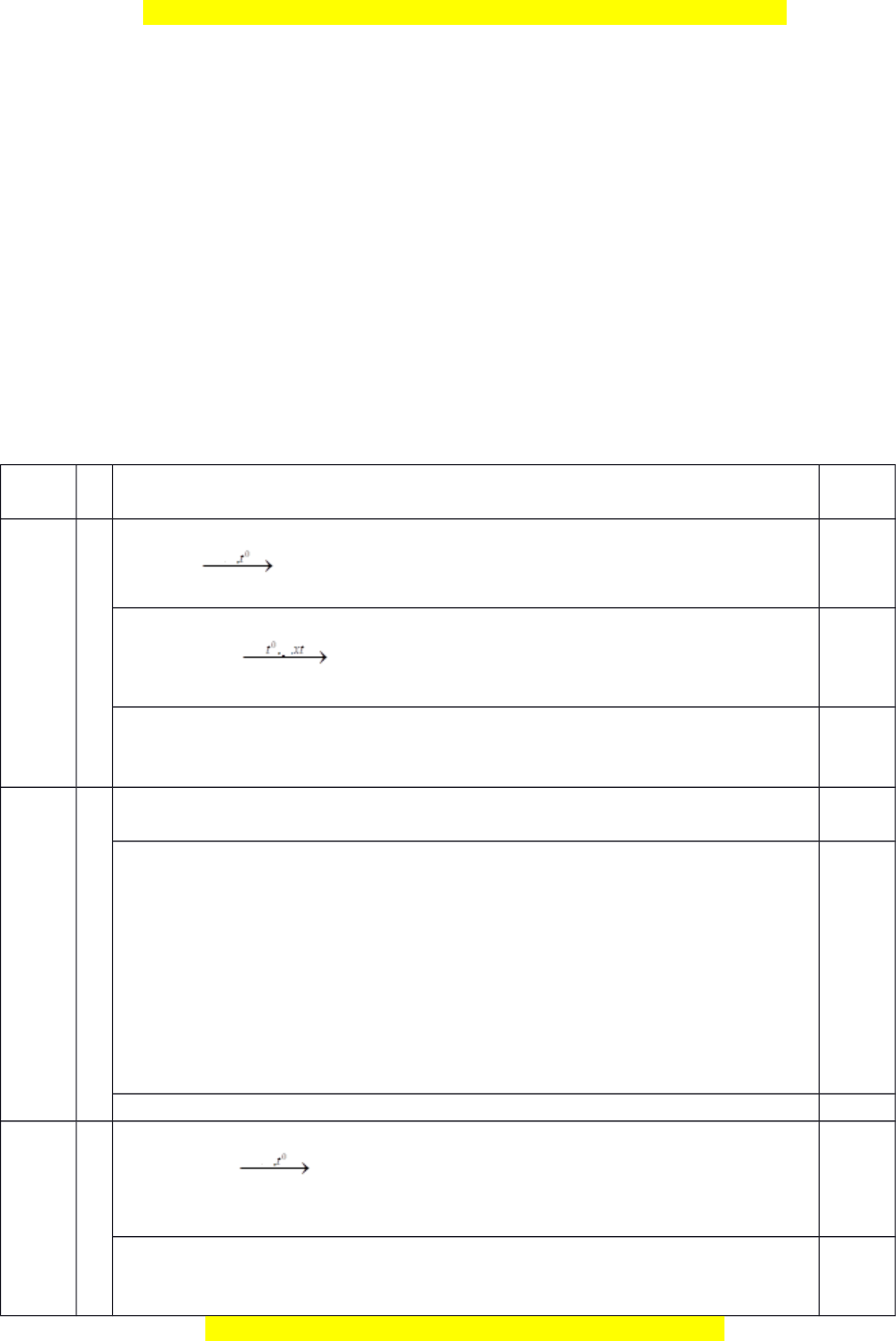
Vì nH2 = 1/2.nA và nNaOH = 3nA nên CTCT th a ỏ mãn c a ủ A là 0,5 N u ế h c s ọ inh chỉ vi t ế đư c ợ 1-2 công th c s ứ đ ẽ ư c ợ 0,25 đi m ể PTHH
HCOOC6H4-OH + Na HCOOC6H4-ONa + 1/2H2
HCOOC6H4-OH + 3NaOH HCOONa + NaOC6H4ONa + H2O 0,25 Chú thích: h c ọ sinh có th ể vi t ế ở d ng ạ thu g n ọ nh ư trên ho c ặ ch ỉc n ầ lấy 1 đồng phân minh h a ọ đ u ề đư c ợ đi m ể t i ố đa 2 MX=12x+y+16z=60
* z=1 => 12x+y = 44=> x=3, y=8 => CTPT X: C3H8O
* z=2 => 12x+y = 28=> x=2, y=4=> CTPT X: C2H4O2 0,25 * z=3=> loại Đ ể th a ỏ mãn s ơ đ
ồ thì X là C3H8O, có 2 đ ng ồ phân CH3CHOHCH3 ho c ặ CH3CH2CH2OH D là: CH2OH-CHOH-CH3 0,25 o CH H2S 4 O (đ),170 C 3-CHOH-CH3 CH3CH=CH2 + H2O o CH H2S 4 O (đ),170 C 3-CH2-CH2-OH CH3CH=CH2 + H2O 0,25
3 CH3CH=CH2 + 2KMnO4 + 4H2O 3C3H6(OH)2 + 2KOH + 2MnO2 0,25
2C3H6(OH)2 + Cu(OH)2 [C3H7O2]2Cu + 2H2O III 1 -Dung d c ị h G + KOH d ư 0,25 Fe3+ + 3OH- Fe(OH)3 (1) Al3+ + 3OH- Al(OH)3 (2) NH + 4 + OH- NH3 + H2O (3) Al(OH) - 3 + OH- AlO2 + 2H2O (4) M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Hải Dương năm 2023 có đáp án
1.8 K
0.9 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1053587071- NGUYEN VAN DOAN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Hải Dương năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1823 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
H I D NGẢ ƯƠ
KỲ THI CH N H C SINH GI I Ọ Ọ Ỏ
L P 12 THPT C P T NH NĂM H C 2022 – 2023Ớ Ấ Ỉ Ọ
Môn thi: HOÁ H CỌ
Ngày thi: 19/10/2022
Th i gian làm bài: 180 phút, không tính th i gian phát đờ ờ ề
Đ thi g m 05 câu, 02 trangề ồ
Câu I (2,0 đi m)ể
1. T Hừ
2
O, đá vôi, NH
3
, O
2
, ch t xúc tác và ph ng ti n kĩ thu t c n thi t, hãy vi tấ ươ ệ ậ ầ ế ế
ph ng trình ph n ng đi u ch :ươ ả ứ ề ế
a. NH
4
HCO
3
b. NH
4
NO
3
2. Cho 3 ch t h u c m ch h g m: anđehit (Xấ ữ ơ ạ ở ồ
1
), ancol (X
2
), ete (X
3
) có cùng công
th c phân t Cứ ử
3
H
6
O. Vi t công th c c u t o 3 ch t và trình bày ph ng pháp hóa h c đế ứ ấ ạ ấ ươ ọ ể
nh n bi t 3 ch t h u c trên.ậ ế ấ ữ ơ
3. Đ tố khí A trong oxi thi u ta đ c ch t r n C màu vàng. Khí X có màu vàng l c tácế ượ ấ ắ ụ
d ng v i khí A t o ra C và F. N u X tác d ng v i A trong n c t o ra dung d ch T ch a Yụ ớ ạ ế ụ ớ ướ ạ ị ứ
và F, thêm dung d ch BaClị
2
vào dung d ch T thì có k t t a tr ng. Cho A tác d ng v i dungị ế ủ ắ ụ ớ
d ch c a ch t G t o ra ch t k t t a H màu đen. Cho Mị ủ ấ ạ ấ ế ủ
A
+ M
G
= 365.
a. Xác đ nh các ch t có kí hi u A, C, F, G, H, X, Y? ị ấ ệ
b. Vi t các ph ng trình hóa h c c a các ph n ng x y ra.ế ươ ọ ủ ả ứ ả
Câu II (2,0 đi m)ể
1. Đ t cháy hoàn toàn 27,6 gam ch t h u c A (ch a C,H,O) thu đ c 31,36 lit COố ấ ữ ơ ứ ượ
2
(đktc) và 10,8 gam n c.ướ
a. L p công th c phân t c a A. Bi t Mậ ứ ử ủ ế
A
< 150 u
b. Vi t các công th c c u t o có th có c a A và vi t ph ng trình ph n ng minhế ứ ấ ạ ể ủ ế ươ ả ứ
h aọ
Bi t: 1,0 mol ch t A tác d ng v i Na d thu đ c 0,5 mol Hế ấ ụ ớ ư ượ
2
.
1,0 mol ch t A tác d ng đ c v i t i đa 3,0 mol NaOH. ấ ụ ượ ớ ố
2. Ch t h u c X có công th c t ng quát Cấ ữ ơ ứ ổ
x
H
y
O
z
, có phân t kh i M = 60 u và thamử ố
gia ph n ng theo s đ chuy n hóa sau: Cả ứ ơ ồ ể
x
H
y
O
z
C
x
H
y-2
D
Bi t: Mế
D
= 76u; D là h p ch t đa ch c, D hòa tan Cu(OH)ợ ấ ứ
2
nhi t đ th ng thànhở ệ ộ ườ
dung d ch xanh đ m. ị ậ
Tìm công th c c u t o c a X, D và vi t ph ng trình ph n ng hóa h c c a cácứ ấ ạ ủ ế ươ ả ứ ọ ủ
ch t theo s đ trên.ấ ơ ồ
Câu III (2,0 đi m)ể
1. M t dung d ch G có các ion (Feộ ị
3+
, NH
4
+
, SO
4
2-
, Al
3+
, NO
3
-
). Ti n hành các thíế
nghi m sau v i cùng V lít dung d ch G. ệ ớ ị
- Cho dung d ch G tác d ng v i dung d ch KOH d , đun nóng. Sau ph n ng hoànị ụ ớ ị ư ả ứ
toàn, thu đ c 1,07 gam k t t a và 0,224 lít khí Q (đktc).ượ ế ủ
- Cho dung d ch G tác d ng v i dung d ch NHị ụ ớ ị
3
d . Sau ph n ng hoàn toàn, thuư ả ứ
đ c 1,85 gam k t t a.ượ ế ủ
- Cho dung d ch HCl d vào dung d ch G thu đ c dung d ch H, dung d ch H hòa tanị ư ị ượ ị ị
đ c t i đa 2,24 gam Cu (thu đ c khí NO là s n ph m kh duy nh t c a Nượ ố ượ ả ẩ ử ấ ủ
+5
).
Tính t ng kh i l ng mu i khan thu đ c khi cô c n V lít dung d ch G.ổ ố ượ ố ượ ạ ị
2. H p th hoàn toàn Vấ ụ
1
lít CO
2
( đktc) vào 350 ml KOH 2M thu đ c dung d ch Xở ượ ị
g m 2 ch t tan. Nh t t 175ml dung d ch Y g m (Hồ ấ ỏ ừ ừ ị ồ
2
SO
4
0,4M và HCl 1,2M) vào dung
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đ CHÍNH TH CỀ Ứ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
d ch X thu đ c 3,36 lít khí ( đktc).ị ượ ở
N u nh t t đ n h t dung d ch X trên vào 210ml dung d ch Y thu đ c Vế ỏ ừ ừ ế ế ị ở ị ượ
2
lít khí
( đktc). Xác đ nh Vở ị
1
,
V
2
(Gi thi t r ng l ng COả ế ằ ượ
2
tan trong n c và ph n ng v i n cướ ả ứ ớ ướ
không đáng k ).ể
3. H n h p X g m Mg, Fe, Feỗ ợ ồ
3
O
4
và CuO trong đó nguyên t oxi chi m 16,0%ố ế
kh i l ng c a X. Hòa tan hoàn toàn ố ượ ủ m gam X trong V lit dung d ch Y ch a (Hị ứ
2
SO
4
0,83M và NaNO
3
0,3M), thu đ c dung d ch Z ch ch a 3,275ượ ị ỉ ứ m gam mu i trung hòa vàố
1,008 lít khí NO (đktc). Bi t dung d ch Z ph n ng v a đ v i 400 ml dung d ch KOHế ị ả ứ ừ ủ ớ ị
1,9M. Tính giá tr c a m và V ?ị ủ
Câu IV (2,0 đi m)ể
1. Đ trung hòa m t axit cacboxylic A đ n ch c c n 100ml dung NaOH 1M, sau ph nể ộ ơ ứ ầ ả
ng thu đ c dung d ch ch a 9,6 gam mu i.ứ ượ ị ứ ố
a. Xác đ nh công th c c u t o c a A.ị ứ ấ ạ ủ
b. Oxi hóa h n h p X g m (m t anđehit đ n ch c và m t ancol đ n ch c b c 1), thuỗ ợ ồ ộ ơ ứ ộ ơ ứ ậ
đ c m t axit h u c A duy nh t trên.ượ ộ ữ ơ ấ ở
N u ế đem đ t cháy hoàn toàn 37,0 gam h n h p X b ng oxi v a đ r i cho khí và h iố ỗ ợ ằ ừ ủ ồ ơ
thoát ra h p th hoàn toàn vào dung d ch Ca(OH)ấ ụ ị
2
thì thu đ c 87,5 gam k t t a và dungượ ế ủ
d ch Y. N u cho t i thi u 0,5 lit dung d ch NaOH 1M vào dung d ch Y thì thu đ c l ngị ế ố ể ị ị ượ ượ
k t t a là l n nh t. M t khác, n u cho 37 gam h n h p X vào l ng d dung d chế ủ ớ ấ ặ ế ỗ ợ ượ ư ị
AgNO
3
/NH
3
đun nóng nh thì thu đ c ẹ ượ m gam k t t a. Tính ế ủ m.
2. H p ch t h u c Aợ ấ ữ ơ
1
(ch a 3 nguyên t C, H, O) ch ch a m t lo i nhóm ch c. Choứ ố ỉ ứ ộ ạ ứ
0,05 mol ch t Aấ
1
tác d ng v a đ v i 500 ml dung d ch NaOH (kh i l ng riêng 1,2 g/ml)ụ ừ ủ ớ ị ố ượ
thu đ c dung d ch B. Làm bay h i dung d ch B thu đ c 594,9 gam h i n c và còn l i 14,8ượ ị ơ ị ượ ơ ướ ạ
gam h n h p các ch t r n khan D. N u đ t cháy hoàn toàn ch t r n D thu đ c 7,95 gamỗ ợ ấ ắ ế ố ấ ắ ượ
Na
2
CO
3
; 9,52 lít CO
2
(đktc) và 4,95 gam H
2
O. N u cho h n h p ch t r n D tác d ng v i dungế ỗ ợ ấ ắ ụ ớ
d ch Hị
2
SO
4
loãng d , r i ch ngư ồ ư c t thì đ c 3 ch t h u c X, Y, Z ch ch a các nguyên tấ ượ ấ ữ ơ ỉ ứ ố
C, H, O. Bi t X, Y là 2 axit h u c đ n ch c. Z tác d ng v i dung d ch Brế ữ ơ ơ ứ ụ ớ ị
2
t o ra s n ph m Tạ ả ẩ
có kh i l ng phân t l n h n Z là 237u và Mố ượ ử ớ ơ
Z
< 125u. Xác đ nh công th c c u t o c a Aị ứ ấ ạ ủ
1
,
X, Y, Z, T.
Câu V (2,0 đi m)ể
1. Cho h n h p g m tristearin và m t este đ n ch c, no, m ch h X tác d ng v i 2,0ỗ ợ ồ ộ ơ ứ ạ ở ụ ớ
lít dung d ch NaOH 0,3M. Sau khi ph n ng x y ra hoàn toàn thu đ c dung d ch A, trungị ả ứ ả ượ ị
hòa dung d ch A b ng dung d ch HCl v a đ thu đ c dung d ch B ch a a gam h n h pị ằ ị ừ ủ ượ ị ứ ỗ ợ
ancol và b gam h n h p mu i. Đ t cháy hoàn toàn a gam h n h p ancol trên trong khí oxiỗ ợ ố ố ỗ ợ
d thu đ c 35,2 gam COư ượ
2
và 18 gam n c. M t khác, đ t cháy hoàn toàn b gam mu iướ ặ ố ố
trong oxi d thu đ c 32,9 gam ch t r n khan; 334,8 gam h n h p COư ượ ấ ắ ỗ ợ
2
và H
2
O.
Xác đ nh công th c c a este X.ị ứ ủ
2. Cho 40 gam h n h p A g m FeCOỗ ợ ồ
3
, Fe, Cu, Al tác d ng v i 120 ml dung d chụ ớ ị
NaOH 2M thu đ c 5,376 lít khí hiđro (đktc). Sau khi k t thúc ph n ng cho ti p 1,48 lítượ ế ả ứ ế
dung d ch HCl 1M thu đ c h n h p khí B, c n r n C (C không tác d ng v i dung d chị ượ ỗ ợ ặ ắ ụ ớ ị
ki m) và dung d ch D. S c COề ị ụ
2
d vào dung d ch D không th y xu t hi n k t t a. Cho Bư ị ấ ấ ệ ế ủ
h p th h t vào dung d ch Ca(OH)ấ ụ ế ị
2
d thì thu đ c 20 gam k t t a. Cho C tác d ng v iư ượ ế ủ ụ ớ
dung d ch ch a 0,3 mol HNOị ứ
3
đ c, nóng d thu đ c dung d ch E và m t ch t khí duy nh tặ ư ượ ị ộ ấ ấ
màu nâu đ (s n ph m kh duy nh t c a Nỏ ả ẩ ử ấ ủ
+5
). Bi t r ng dung d ch E có th hòa tan t i đaế ằ ị ể ố
3,08 gam s t trong đi u ki n đun nóng, thu đ c m t ch t khí duy nh t màu nâu đ (s nắ ề ệ ượ ộ ấ ấ ỏ ả
ph m kh duy nh t c a Nẩ ử ấ ủ
+5
). Các ph n ng x y ra hoàn toàn. Tính kh i l ng c a các ch tả ứ ả ố ượ ủ ấ
trong h n h p A ? ỗ ợ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Cho nguyên t kh i: ử ố
H = 1; C = 12; N = 14; O = 16; Na = 23; Mg=24; Al = 27; S = 32; Cl = 35,5;
K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137; Pb=207.
---H T---Ế
H và tên thí sinhọ ....................................................S báo danh: ố ..................................
Ch kí cán b coi thi s 1: ữ ộ ố ..................... Ch kí cán b coi thi s 2: ữ ộ ố ..........................
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
H I D NGẢ ƯƠ
ĐÁP ÁN VÀ H NG D N CH M MÔNƯỚ Ẫ Ấ HÓA H CỌ
Đ THI HSG12 THPTỀ
NĂM H C 20Ọ 22 - 2023
(H ng d n ch m g m:08 trang)ướ ẫ ấ ồ
N u h c sinh làm cách khác đúng v n cho đi m t i đa.ế ọ ẫ ể ố
Câu Ý N i dungộ Điể
m
I 1 + Đi u ch NHề ế
4
HCO
3
CaCO
3
CaO + CO
2
NH
3
+ CO
2
+ H
2
O NH
4
HCO
3
0,25
+ Đi u ch NHề ế
4
NO
3
4NH
3
+ 5O
2
4NO + 6H
2
O
2NO + O
2
2
NO
2
0,25
4NO
2
+ O
2
+ 2H
2
O
4HNO
3
NH
3
+ HNO
3
NH
4
NO
3
0,25
2 CTCT c a 3 ch t l n l t làủ ấ ầ ượ :
X
1
: CH
3
CH
2
CHO ; X
2
: CH
2
= CH-CH
2
OH ; X
3
: CH
2
=CH-O-CH
3
.
0,25
- Cho 3 m u th tác d ng v i dung d ch AgNOẫ ử ụ ớ ị
3
/NH
3
, t
0
+ N u ch t nào t o k t t a tr ng là CHế ấ ạ ế ủ ắ
3
CH
2
CHO
CH
3
CH
2
CHO + 2 AgNO
3
+ 3 NH
3
+ H
2
O
CH
3
CH
2
COONH
4
+
2NH
4
NO
3
+ 2 Ag
- 2 ch t còn l i không hi n t ng. ấ ạ ệ ượ
Cho 2 m u th tác d ng v i Na ẫ ử ụ ớ
+ N u ch t nào có Hế ấ
2
bay ra là CH
2
=CH-CH
2
OH
CH
2
= CH-CH
2
OH + Na
CH
2
=CH-CH
2
ONa + 1/2H
2
Còn l i không có hi n t ng là CHạ ệ ượ
2
=CH-O-CH
3
0,25
3 A: H
2
S ; C: S ; X: Cl
2
; F : HCl
2H
2
S + O
2
2S + 2H
2
O
Cl
2
+ H
2
S → S + 2HCl
0,25
Y: H
2
SO
4
; G: Pb(NO
3
)
2
;H: PbS
0,25
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
4Cl
2
+ 4H
2
O + H
2
S → H
2
SO
4
+ 8HCl
BaCl
2
+ H
2
SO
4
→ BaSO
4
+ 2HCl
Pb(NO
3
)
2
+ H
2
S → PbS + 2HNO
3
0,25
II 1 a) n
C
= n
CO2
= 1,4 mol; n
H
= 2n
H2O
= 1,2 mol; n
O
= (m
A
-12n
C
-1.n
H
)/16= 0,6
mol
n
C
:n
H
:n
O
= 7:6:3 => CTĐGN là C
7
H
6
O
3
=> CTPT A: (C
7
H
6
O
3
)
n
Do M
A
< 150 => n=1
V y CTPT A: Cậ
7
H
6
O
3
0,25
Vì n
H2
= 1/2.n
A
và n
NaOH
= 3n
A
nên CTCT th a mãn c a A làỏ ủ
N u h c sinh ch vi t đ c 1-2 công th c s đ c 0,25 đi mế ọ ỉ ế ượ ứ ẽ ượ ể
0,5
PTHH
HCOOC
6
H
4
-OH + Na HCOOC
6
H
4
-ONa + 1/2H
2
HCOOC
6
H
4
-OH + 3NaOH HCOONa + NaOC
6
H
4
ONa + H
2
O
Chú thích: h c sinh có th vi t d ng thu g n nh trên ho c ch c n ọ ể ế ở ạ ọ ư ặ ỉ ầ
l y 1 đ ng phân minh h a đ u đ c đi m t i đaấ ồ ọ ề ượ ể ố
0,25
2 M
X
=12x+y+16z=60
* z=1 => 12x+y = 44=> x=3, y=8 => CTPT X: C
3
H
8
O
* z=2 => 12x+y = 28=> x=2, y=4=> CTPT X: C
2
H
4
O
2
*
z=3=> lo iạ
Đ th a mãn s đ thì X là Cể ỏ ơ ồ
3
H
8
O, có 2 đ ng phânồ
CH
3
CHOHCH
3
ho c CHặ
3
CH
2
CH
2
OH
0,25
D là: CH
2
OH-CHOH-CH
3
0,25
CH
3
-CHOH-CH
3
o
2 4
H SO (đ),170 C
CH
3
CH=CH
2
+ H
2
O
CH
3
-CH
2
-CH
2
-OH
o
2 4
H SO (đ),170 C
CH
3
CH=CH
2
+ H
2
O
0,25
3 CH
3
CH=CH
2
+ 2KMnO
4
+ 4H
2
O
3C
3
H
6
(OH)
2
+ 2KOH + 2MnO
2
2C
3
H
6
(OH)
2
+ Cu(OH)
2
[C
3
H
7
O
2
]
2
Cu + 2H
2
O
0,25
III 1 -Dung d ch G + KOH d ị ư
Fe
3+
+ 3OH
-
Fe(OH)
3
(1)
Al
3+
+ 3OH
-
Al(OH)
3
(2)
NH
4
+
+ OH
-
NH
3
+ H
2
O (3)
Al(OH)
3
+ OH
-
AlO
2
-
+ 2H
2
O (4)
0,25
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Theo (1):
Fe
3+¿
=n
Fe(OH )
3
=0,01 mol
n
¿
Theo (4): n (NH
4
+
) = n (NH
3
)= 0,01 mol
-Dung d ch G + NHị
3
d ư
Fe
3+
+ 3NH
3
+ 3H
2
O
Fe(OH)
3
+ 3NH
4
+
(5)
Al
3+
+ 3NH
3
+ 3H
2
O
Al(OH)
3
+ 3NH
4
+
(6)
m
Fe(OH)3
+ m
Al(OH)3
= 1,85 gam => n
Al(OH)3
= 0,01 mol
Theo (6),
Al
3+ ¿
=n
Al(OH )
3
=0,01mol
n
¿
0,25
- Dung d ch G + dung d ch HCl d ị ị ư
3Cu + 8H
+
+ 2NO
3
-
3Cu
2+
+ 2NO + 4H
2
O (7)
Cu + 2Fe
3+
Cu
2+
+ 2Fe
2+
(8)
Theo (7) và (8)
n
Cu
=
NO
3
−¿
3
2
n
¿
+
Fe
❑
3+¿
1
2
n
¿
=>
NO
3
−¿
=0,02 mol
n
¿
S d ng đ nh lu t b o toàn đi n tích=> ử ụ ị ậ ả ệ
SO
4
2−¿
n
¿
= 0,025 mol
Tính t ng kh i l ng mu i = 4,65 gamổ ố ượ ố
0,25
2 Các p x y ra khi s c COư ả ụ
2
vào dung d ch KOH:ị
CO
2
+ 2KOH
K
2
CO
3
+ H
2
O (1)
CO
2
+ KOH
KHCO
3
(2)
H
+¿
=0,35mol ;n
CO
2
❑
↑
=0,15mol
n
KOH
=0,7mol →n
¿
Cho t t dung d ch Y vào X:ừ ừ ị
Tr ng h p 1:ườ ợ ch x y ra p (1)ỉ ả ư
dung d ch X g m: Kị ồ
2
CO
3
và KOH
dư
G i s mol c a Kọ ố ủ
2
CO
3
là x
s mol KOH d là (0,7-2x) ố ư
(ĐK:
x 0,35
)
Nh t t dung d ch Y vào X x y ra các p theo th t sau:ỏ ừ ừ ị ả ư ứ ự
H
+
+ OH
-
H
2
O (3)
(0,7-2x)
(0,7-2x)
H
+
+ CO
3
2-
HCO
3
-
(4)
x
x
H
+
+ HCO
3
-
H
2
O + CO
2
(5)
n
H+( pu 5)ở
=0,35-n
H+ p (3),(4)ư ở
= x-0,35 0 ( lo i)ạ
0,25
Tr ng h p 2:ườ ợ X y ra c 2 p (1), (2) ả ả ư
dung d ch X g m: Kị ồ
2
CO
3
và
KHCO
3
G i s mol c a Kọ ố ủ
2
CO
3
= a mol
s mol c a KHCOố ủ
3
= 0,7-2a
(ĐK
0,35a
)
Nh t t dung d ch Y vào X x y ra các p theo th t sau:ỏ ừ ừ ị ả ư ứ ự
H
+
+ CO
3
2-
HCO
3
-
(6)
a
a
a (mol)
0,25
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ