Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Ấ T N Ỉ H L N Ạ G SƠN
LỚP 12 NĂM HỌC 2022 - 2023 Môn thi: Hoá h c ọ l p ớ 12 THPT Th i
ờ gian: 180 phút (không k t ể h i ờ gian giao đề) ĐỀ THI CHÍNH TH C Ứ (Đề thi g m ồ 03 trang, 08 câu) Câu 1 (4,0 điểm).
1. Nguyên tử nguyên tố X có 2 electron ở phân l p
ớ p và nguyên tử nguyên tố Y có 16 proton trong hạt nhân. a) Vi t
ế cấu hình electron và xác đ nh ị vị trí c a
ủ X, Y trong bảng tu n
ầ hoàn các nguyên tố hoá h c ọ .
b) Nguyên tố X, Y đều tạo đư c
ợ oxit XO2, YO2. K t ế quả th c ự nghi m ệ cho th y ấ YO2 tan nhi u ề trong nư c ớ h n
ơ XO2. Giải thích k t ế qu t ả rên d a ự theo c u t ấ o phâ ạ n t c ử a ủ hai oxit trên.
c) Urê ((NH2)2CO) là m t ộ lo i ạ phân đ m ạ đư c ợ s d ử ng ụ nhi u t ề rong s n xu ả t ấ nông nghi p ệ do có độ dinh dư ng c ỡ ao. Vi t ế phư ng t ơ rình s n xu ả t
ấ urê từ XO2 trong công nghi p. ệ
d) Axit H2SO4 đặc có tính háo nư c ớ , nó có thể l y ấ nư c ớ từ m t ộ số h p ợ ch t ấ h u ữ c . ơ Trong
quá trình than hóa saccarozơ có s n ả ph m ẩ g m ồ h i ơ nư c ớ và h n ỗ h p
ợ khí XO2, YO2. Viết các phương trình của ph n ả n
ứ g trên và trình bày phư n ơ g pháp hóa h c ọ ch n ứ g minh s ự có m t ặ c a ủ
các khí XO2, YO2 trong h n ỗ h p ợ . 2. Nêu hi n ệ tư ng và ợ vi t ế phư ng ơ trình hóa h c ọ gi i ả thích các thí nghi m ệ sau: - Thí nghi m ệ 1: Cho m t ộ lư ng ợ nh ki ỏ m loại Na vào dung d c ị h CuSO4. - Thí nghi m ệ 2: Đ t ố dây sắt nóng đ r ỏ ồi đ a ư vào bình ch a ứ khí clo. - Thí nghi m ệ 3: S c ụ khí ozon vào dung d c ị h KI có hồ tinh b t ộ . Câu 2 (3,25 điểm).
1. Cân bằng các phư ng t ơ rình phản ng s ứ au theo phư ng ơ pháp thăng b ng e ằ lectron:
a) CrI3 + Cl2 + KOH → KIO4 + K2CrO4 + KCl + H2O
b) Mg + HNO3 → Mg(NO3)2 + NO + H2O 2. Cho Fe3O4 tác d ng ụ v i ớ dung d c
ị h H2SO4 loãng dư thu đư c ợ dung d c ị h X. Cho l n ầ lư t ợ các
chất Cu, KMnO4, NaNO3, Cl2 vào dung d c
ị h X. Viết các phư ng ơ trình phản ng x ứ ảy ra (n u c ế ó). 3. Nung nóng m gam h n ỗ h p ợ X g m ồ Mg, Al và Cu trong O2 d , ư thu đư c ợ 23,7 gam h n ỗ h p ợ Y gồm các oxit. Hòa tan h t ế Y bằng lư ng ợ v a ừ đủ dung d c ị h g m ồ HCl 1M và H2SO4 0,5M, thu được dung d c ị h ch a ứ 64,2 gam h n ỗ h p ợ mu i ố trung hòa. Bi t ế các ph n ả ng ứ x y ả ra hoàn toàn. Tính giá tr c ị ủa m. Câu 3 (2,75 điểm). 1. Hòa tan h n ỗ h p ợ ch t ấ r n ắ g m
ồ CaO, NH4Cl, NaHCO3 có số mol các ch t ấ đ u ề b n ằ g nhau vào m t ộ c c ố nư c ớ l y ấ d , ư sau m t ộ th i ờ gian đun nóng nh ẹ trên ng n ọ l a ử đèn c n ồ khu y ấ đ u ề đ n ế khi ph n ả n ứ g x y ả ra hoàn toàn thu đư c ợ k t ế t a ủ A, dung d c ị h B và b t
ọ khí C thoát ra kh i ỏ dung d c ị h. Xác đ n ị h thành ph n ầ c a ủ A, ch t ấ tan trong dung d c ị h B và thành ph n ầ chính c a ủ khí C. Vi t ế phư n ơ g trình d n ạ g ion rút g n ọ các ph n ả n ứ g x y ả ra trong thí nghi m ệ trên. 2. Phư ng ơ pháp chu n
ẩ độ axit - bazơ là phư ng ơ pháp chu n ẩ đ ộ thể tích d a ự trên s ự tư ng ơ tác giữa các axit, baz , ơ t c ứ là d a
ự trên sự đo thể tích dung d c ị h thu c ố thử là axit (ho c ặ baz ) ơ có n ng ồ độ đã bi t ế ph n ả ng ứ v i ớ m t ộ thể tích xác đ nh ị dung d c ị h bazơ (ho c ặ axit) có n ng ồ độ chưa bi t ế cần xác đ nh. ị Hay nói cách khác ph n ả ng ứ chu n
ẩ độ axit-bazơ chính là ph n ả ng ứ trung hòa. Để xác đ nh ị n ng ồ độ c a ủ axit clohiđric trong m u ẫ dung d c ị h HCl, ti n ế hành thêm d n ầ dung d c ị h NaOH đã bi t ế n ng đ ồ ộ vào dung d c ị h HCl v i ớ ch t ấ chỉ thị thích h p. ợ a) Viết phư ng ơ trình phản ng x ứ ảy ra. b) Khi chu n ẩ độ 100 ml dung d c
ị h HCl 0,100M bằng V ml dung d c ị h chu n ẩ NaOH 0,100M, tính pH c a
ủ dung dịch thu được tại các giá tr : ị + V = 99,9 ml. M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) + V = 100 ml. + V = 100,1 ml.
c) Trong quá trình chuẩn đ c ộ n ầ thi t ế ph i ả d a ự vào m t ộ tín hi u nà ệ o đó đ d ể ng ừ phép chu n ẩ đ . ộ Chất có kh nă ả ng thay đ i ổ tín hiệ khi ụ chuẩn đ g ộ i ọ là ch t ấ ch t ỉ h .ị - Th i ờ đi m ể t i ạ đó ch t ấ ch ỉth ịthay đ i ổ tín hi u ệ g i ọ là đi m ể k t ế thúc chu n ẩ đ ộ (đi m ể d ng ừ chuẩn đ ha ộ
y điểm cuối chuẩn đ (Đ ộ CCĐ)). Bảng sau đây ghi kho ng ả pH đ i ổ màu c a ủ 2 ch t ấ chỉ th ịthư ng ờ đư c ợ s ử d ng ụ nhi u ề trong chuẩn đ a ộ xit- baz . ơ Tên chất chỉ Khoảng pH đ i ổ màu Màu dạng axit - d n ạ g bazơ thị Metyl đỏ 4,2 – 6,3 Đ – ỏ Vàng Phenolphtalein 8,3 – 10,0 Không màu- H ng ồ Có thể dùng (nh ng) ữ
chỉ thị nào trong số các chỉ thị đư c ợ cho trong b ng ả sau trong thí nghi m
ệ chuẩn độ ở ý b) trên? Nêu sự đ i ổ màu c a ủ dung d c ị h t i ạ đi m ể cu i ố chu n ẩ độ tư ng ơ ng ứ khi s d ử ng (c ụ ác) ch t ỉ h đó. ị Câu 4 (2,0 điểm). 1. Cho s đ ơ ồ các phản ng s ứ au: ®iÖnph©n (1) X cã mµng ng¨n 1 + H2O X2 + X3↑ + H2↑
(2) X2 + X4 → BaCO3 + Na2CO3 + H2O (3) X2 + X3 → X1 + X5 + H2O
(4) X4 + X6 → BaSO4 + Na2SO4 + CO2 + H2O Xác đ nh
ị các chất X1, X2, X3, X4, X5, X6 th a ỏ mãn và vi t ế phư ng ơ trình hoá h c ọ các ph n ả ng ứ trong s đ ơ t ồ rên bi t ế ph n ả ng (1) đ ứ ư c ợ dùng đ s ể n xu ả t
ấ X2 và X3 trong công nghi p. ệ 2. Cho 29,48 gam h n ỗ h p ợ g m
ồ Na, Na2O, Ba và BaO vào nư c ớ d , ư thu đư c ợ 1,792 lít khí H2 (đktc) và dung d c ị h X. S c
ụ 8,064 lít khí CO2 (đktc) vào X, thu đư c ợ a gam k t ế t a ủ và dung d c ị h Y. Tách k t ế t a ủ , cho từ từ dung d c
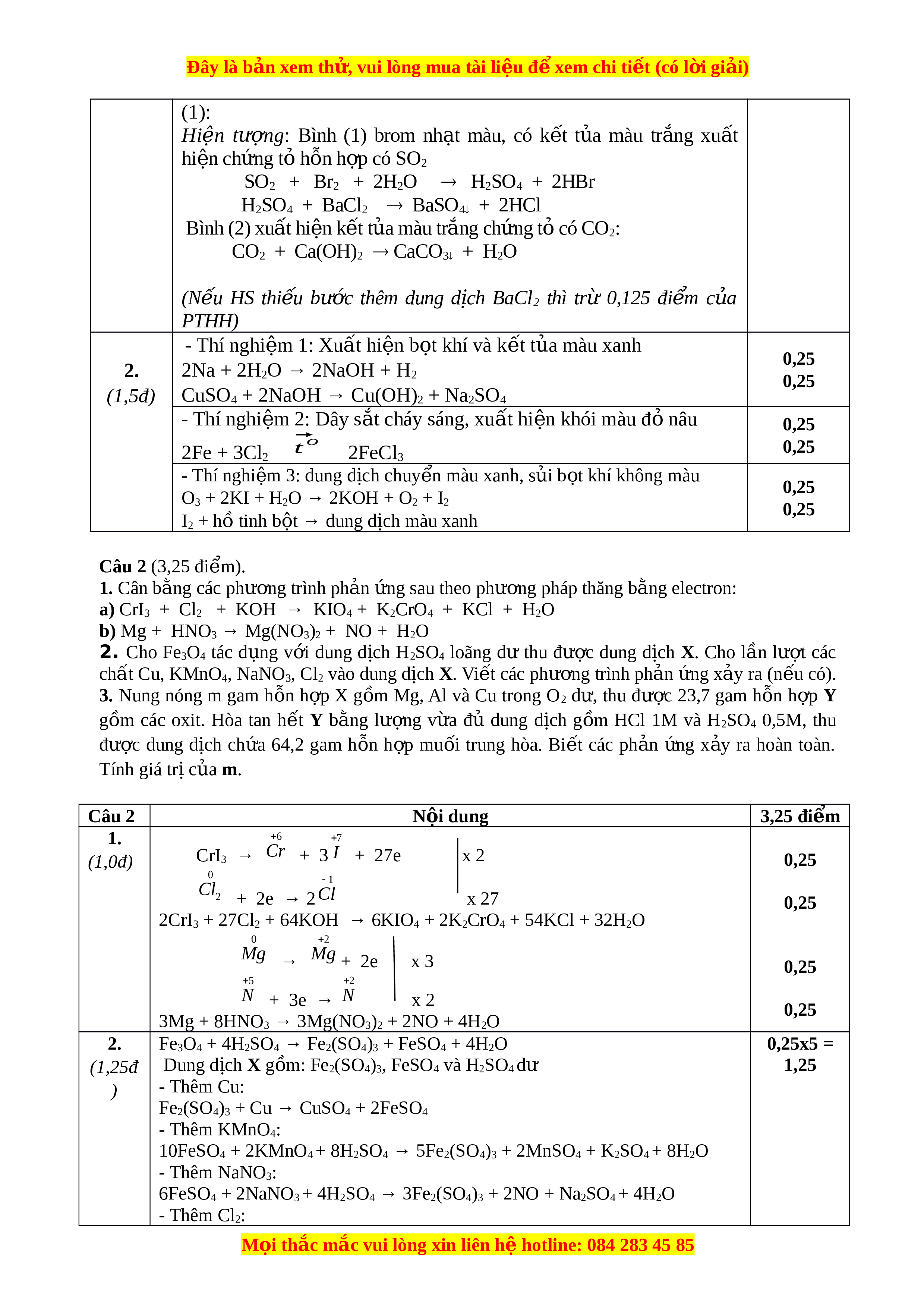
ị h HCl vào Y, sự phụ thu c
ộ số mol CO2 khi thêm dung d c ị h
HCl vào Y được biểu diễn theo đ t ồ h s ị au Tính giá tr c
ị ủa a và x. Câu 5 (2,25 điểm). 1. Ti n ế hành thí nghi m ệ đi u ề chế và thử tính ch t ấ c a
ủ hiđrocacbon X theo sơ đồ và các bư c ớ sau đây: Bước 1: Mở khoá ph u
ễ cho H2O chảy từ từ xu ng ố bình c u ầ đ ng ự CaC2.
Bước 2: Dẫn X vào bình 1 đ ng dung d ự c ị h Br2 d . ư
Bước 3: Dẫn X vào bình 2 đ ng dung d ự c ị h AgNO3 trong NH3. Bước 4: Đ t ố cháy X. Nêu hi n ệ tư ng ợ và vi t ế các phư ng ơ trình hoá h c ọ c a ủ các phản ng đã ứ xảy ra.
2. Cho X, Y, Z, T là các ch t
ấ khác nhau trong số 4 ch t ấ : CH3COOH, C2H5OH, CH3CHO, HCOOH và các giá tr nhi ị t ệ đ s ộ ôi đư c ợ ghi trong b ng s ả au: M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) Chất X Y Z T Nhiệt độ sôi (oC) 78,3 100,8 21,0 118,0 Ghép các chất v i ớ giá trị nhi t ệ đ s ộ ôi cho phù h p. G ợ i i ả thích. Câu 6 (1,75 điểm). 1. Nêu hi n ệ tư n ợ g và vi t ế phư n ơ g trình hóa h c ọ c a ủ các phản ng ứ x y ra ả khi: a) S c ụ khí etilen đ n d ế và ư o dung d c ị h KMnO4.
b) Chiếu sáng vào bình cầu thuỷ tinh đư c ợ nút kín có ch a ứ h n ỗ h p ợ g m ồ CH 4 và Cl2 (tỉ
lệ mol 1:1), sau đó cho mẫu quỳ tím m ẩ vào bình c u ầ .
2. Nung nóng 0,1 mol C4H10 có xúc tác thích h p, ợ thu đư c ợ h n ỗ h p ợ khí X g m ồ H2, CH4, C2H4,
C2H6, C3H6, C4H8 và C4H10. D n ẫ X qua bình đ ng ự dung d c ị h Br2 d , ư sau khi ph n ả ng ứ x y ả ra hoàn toàn thấy kh i ố lư ng
ợ bình tăng m gam và có h n ỗ h p
ợ khí Y thoát ra. Đ t ố cháy toàn bộ Y cần v a ừ đ 7,168 l ủ
ít khí O2 (đktc). Tính giá tr c ị a ủ m. Câu 7 (2,5 điểm). 1. Cho các ch t ấ l ng ỏ : anilin, lòng tr ng ắ tr ng, ứ axit axetic và dung d c ị h glucozơ đư c ợ kí hi u ệ
ngẫu nhiên là X, Y, Z, T. Kết quả thí nghi m ệ c a ủ các chất v i ớ thu c ố th đ ử ư c ợ ghi b ở ng s ả au: Mẫu thử Thu c ố thử Hi n ệ tư n ợ g X Tác d ng v ụ i ớ Cu(OH)2 Có màu tím Y CaCO3 S i ủ b t ọ khí không màu Z Dung d c ị h AgNO3 trong NH3, Kết t a ủ Ag trắng sáng đun nóng nhẹ T Dung dịch brom Kết t a ủ trắng Xác đ nh
ị X, Y, Z, T và viết phư ng t ơ rình hóa h c ọ của các phản ng x ứ ảy ra (n u c ế ó). 2. Từ tinh dầu h i ồ , ngư i ờ ta tách đư c ợ anetol là m t ộ ch t ấ th m ơ đư c ợ dùng s n ả xu t ấ k o ẹ cao
su. Anetol có tỉ kh i ố h i ơ so v i
ớ N2 là 5,286. Phân tích nguyên tố cho th y
ấ , anetol có phần trăm khối lư ng ợ cacbon và hiđro tư ng ơ ng
ứ là 81,08%; 8,10%, còn l i ạ là oxi. Xác đ nh ị công th c ứ phân t c ử a ủ anetol. Câu 8 (1,5 điểm). 1. H n ỗ h p ợ E g m ồ ba este đ u ề m c ạ h h , ở đ u ề đư c ợ t o ạ b i ở axit cacboxylic v i ớ ancol và đ u ề có phân tử kh i ố nhỏ h n ơ 146. Đ t
ố cháy hoàn toàn a mol E, thu đư c
ợ 10,976 lít khí CO2 (đktc) và
7,29 gam H2O. Mặt khác, th y
ủ phân hoàn toàn 29,06 gam E cần v a ừ đ 490 m ủ l dung dịch NaOH 1M, thu đư c ợ h n ỗ h p ợ ancol và 33,22 gam h n ỗ h p ợ mu i ố . Xác đ nh ị công th c ứ c u ấ t o ạ và tính phần trăm v kh ề i ố lư ng c ợ a ủ m i ỗ este trong h n h ỗ p ba ợ n đ u. ầ
2. Chất X (C6H16O4N2) là mu i
ố amoni của axit cacboxylic, chất Y (C6H15O3N3, mạch h ) l ở à mu i ố amoni c a
ủ đipeptit. Cho 8,94 gam h n ỗ h p
ợ E gồm X và Y tác d ng ụ h t ế v i ớ lư ng ợ d ư dung d c ị h NaOH, thu đư c ợ s n ả ph m ẩ h u ữ cơ g m ồ 0,05 mol hai amin no (đ u
ề có hai nguyên tử cacbon trong phân t và ử không là đ ng ồ phân c a
ủ nhau) và m gam hai mu i ố . Tính giá tr c ị ủa m. Cho bi t: ế Số hi u ệ nguyên tử c a ủ các nguyên t :
ố C (Z = 6); N (Z = 7); O (Z = 8); F (Z = 9); Mg (Z =
12); Al (Z = 13); Si (Z = 14); P (Z=15); S (Z = 16); Cl (Z = 17). Nguyên t ử kh i ố c a ủ các nguyên t :
ố H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27;
Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Br = 80; Ba = 137. (H c ọ sinh không đư c ợ s d ử ng
ụ bảng tuần hoàn các nguyên t hóa ố h c ọ )
---------------------H t
ế --------------------- H và ọ
tên thí sinh: ………………………………………………………....................... S bá ố
o danh: …………........... M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) Ch kí ữ giám th s ị 1:
ố ………………................................………Chữ kí giám thị s 2:
ố …......................……….... SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Ấ T N Ỉ H L N Ạ G SƠN L P
Ớ 12 NĂM HỌC 2022 - 2023 HƯỚNG D N Ẫ CH M Ấ THI MÔN HOÁ H C Ọ L P Ớ 12 THPT (Hư ng ớ
dẫn chấm gồm 08 trang) Chú ý: Nh ng ữ cách gi i
ả khác HDC mà đúng thì cho đi m ể theo thang đi m ể đã định. Câu 1 (4,0 điểm).
1. Nguyên tử nguyên tố X có 2 electron ở phân l p
ớ p và nguyên tử nguyên tố Y có 16 proton trong hạt nhân. a) Vi t
ế cấu hình electron và xác đ nh ị vị trí c a
ủ X, Y trong bảng tu n
ầ hoàn các nguyên tố hoá h c ọ .
b) Nguyên tố X, Y đều tạo đư c
ợ oxit XO2, YO2. K t ế quả th c ự nghi m ệ cho th y ấ YO2 tan nhi u ề trong nư c ớ h n
ơ XO2. Giải thích k t ế qu t ả rên d a ự theo c u t ấ o phâ ạ n t c ử a ủ hai oxit trên.
c) Urê ((NH2)2CO) là m t ộ lo i ạ phân đ m ạ đư c ợ s d ử ng ụ nhi u t ề rong s n xu ả t ấ nông nghi p ệ do có độ dinh dư ng c ỡ ao. Vi t ế phư ng t ơ rình s n xu ả t
ấ urê từ XO2 trong công nghi p. ệ
d) Axit H2SO4 đặc có tính háo nư c ớ , nó có thể l y ấ nư c ớ từ m t ộ số h p ợ ch t ấ h u ữ c . ơ Trong
quá trình than hóa saccarozơ có s n ả ph m ẩ g m ồ h i ơ nư c ớ và h n ỗ h p
ợ khí XO2, YO2. Viết các phương trình của ph n ả n
ứ g trên và trình bày phư n ơ g pháp hóa h c ọ ch n ứ g minh s ự có m t ặ c a ủ
các khí XO2, YO2 trong h n ỗ h p ợ . 2. Nêu hi n ệ tư ng và ợ vi t ế phư ng ơ trình hóa h c ọ gi i ả thích các thí nghi m ệ sau: - Thí nghi m ệ 1: Cho m t ộ lư ng ợ nh ki ỏ m loại Na vào dung d c ị h CuSO4. - Thí nghi m ệ 2: Đ t ố dây sắt nóng đ r ỏ ồi đ a ư vào bình ch a ứ khí clo. - Thí nghi m ệ 3: S c ụ khí ozon vào dung d c ị h KI có hồ tinh b t ộ . Câu 1 N i ộ dung 4,0 điểm 1.
a) Cấu hình electron và v t ị rí: (2,5đ) Nguyên t ử X: 1s22s22p2 0,25 → V t ị rí c a
ủ nguyên tố X trong BTH: ô thứ 6, chu kì 2, nhóm IVA 0,25 Nguyên t ử Y: 1s22s22p63s23p4 0,25 → V t ị rí c a ủ nguyên t
ố Y trong BTH: ô thứ 16, chu kì 3, nhóm VIA 0,25 - N u ế HS xác đ nh ị thi u ế ô v n ẫ cho đi m ể t i ố đa, thi u ế chu kì ho c ặ nhóm thì trừ 0,125 điểm.
b) Phân tử CO2 không phân c c
ự : O=C=O, ít tan trong dung môi 0,25 phân c c
ự như H2O, trong khi phân tử SO2 lại phân c c ự → tan nhi u ề trong nư c ớ h n ơ CO2. 0,25 S S O O O O c) CO2 + 2NH3 200atm (NH2)2CO + H2O 0,25 d) C H2S 4 O ®Æc 0,125x5pt
12H22O11 12C + 11H2O (tỏa nhiệt) C + 2H = 0,625
2SO4 (đặc nóng) CO2 + 2SO2 + 2H2O.
Chứng minh sự có mặt c a ủ hai khí trong h n ỗ h p ợ , ta d n ẫ h n ỗ h p ợ
khí lần lượt qua bình 1 đ n ự g dung d c
ị h Brom (dư) và bình 2 đựng 0,125
dung dịch Ca(OH)2 dư rồi thêm vài gi t ọ dung d c ị h BaCl2 vào bình M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Lạng Sơn năm 2023 có đáp án
1.7 K
872 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1053587071- NGUYEN VAN DOAN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Lạng Sơn năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1743 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
L NG S NẠ Ơ
KỲ THI CH N H C SINH GI I C P T NHỌ Ọ Ỏ Ấ Ỉ
L P 12 NĂM H C 2022 - 2023Ớ Ọ
Môn thi: Hoá h c l p 12 THPTọ ớ
Th i gian: ờ 180 phút (không k th i gian giao để ờ ề)
(Đ thi g m 03 trang, 08 câuề ồ )
Câu 1 (4,0 đi m). ể
1. Nguyên tử nguyên tố X có 2 electron phân l p pở ớ và nguyên tử nguyên tố Y có 16 proton
trong h t nhân.ạ
a) Vi t c u hình electron và xác đ nh v trí c a ế ấ ị ị ủ X, Y trong b ng tu nả ầ hoàn các nguyên t hoáố
h c.ọ
b) Nguyên t ố X, Y đ u t o đ c oxit ề ạ ượ XO
2
, YO
2
. K t qu th c nghi m cho th y ế ả ự ệ ấ YO
2
tan nhi uề
trong n c h n ướ ơ XO
2
. Gi i thích k t qu trên d a theo c u t o phân t c a hai oxit trên. ả ế ả ự ấ ạ ử ủ
c) Urê ((NH
2
)
2
CO) là m t lo i phân đ m đ c s d ng nhi u trong s n xu t nông nghi p do cóộ ạ ạ ượ ử ụ ề ả ấ ệ
đ dinh d ng cao. Vi t ph ng trình s n xu t urê t XOộ ưỡ ế ươ ả ấ ừ
2
trong công nghi p.ệ
d) Axit H
2
SO
4
đ c có tính háo n c, nó có th l y n c t m t s h p ch t h u c . Trongặ ướ ể ấ ướ ừ ộ ố ợ ấ ữ ơ
quá trình than hóa saccaroz có s n ph m g m h i n c và h n h p khí ơ ả ẩ ồ ơ ướ ỗ ợ XO
2
, YO
2
. Vi t cácế
ph ng trình c a ph n ng trên và trình bày ph ng pháp hóa h c ch ng minh s có m t c aươ ủ ả ứ ươ ọ ứ ự ặ ủ
các khí XO
2
, YO
2
trong h n h pỗ ợ .
2. Nêu hi n t ng và vi t ph ng trình hóa h c gi i thích các thí nghi m sau:ệ ượ ế ươ ọ ả ệ
- Thí nghi m ệ 1: Cho m t l ng nh kim lo i Na vào dung d ch CuSOộ ượ ỏ ạ ị
4
.
- Thí nghi m 2ệ : Đ t dây s t nóng đ r i đ a vào bình ch a khí clo.ố ắ ỏ ồ ư ứ
- Thí nghi m ệ 3: S c khí ozon vào dung d ch KI có h tinh b t.ụ ị ồ ộ
Câu 2 (3,25 đi m). ể
1. Cân b ng các ph ng trình ph n ng sau theo ph ng pháp thăng b ng electron:ằ ươ ả ứ ươ ằ
a) CrI
3
+ Cl
2
+ KOH → KIO
4
+ K
2
CrO
4
+ KCl + H
2
O
b) Mg + HNO
3
→ Mg(NO
3
)
2
+ NO + H
2
O
2. Cho Fe
3
O
4
tác d ng v i dung d ch Hụ ớ ị
2
SO
4
loãng d thu đ c dung d ch ư ượ ị X. Cho l n l t cácầ ượ
ch t Cu, KMnOấ
4
, NaNO
3
, Cl
2
vào dung d ch ị X. Vi t các ph ng trình ph n ng x y ra (n u có).ế ươ ả ứ ả ế
3. Nung nóng m gam h n h p X g m Mg, Al và Cu trong Oỗ ợ ồ
2
d , thu đ c 23,7 gam h n h p ư ượ ỗ ợ Y
g m các oxit. Hòa tan h t ồ ế Y b ng l ng v a đ dung d ch g m HCl 1M và Hằ ượ ừ ủ ị ồ
2
SO
4
0,5M, thu
đ c dung d ch ch a 64,2 gam h n h p mu i trung hòa. Bi t các ph n ng x y ra hoàn toàn.ượ ị ứ ỗ ợ ố ế ả ứ ả
Tính giá tr c a ị ủ m.
Câu 3 (2,75 đi m).ể
1. Hòa tan h n h p ch t r n g m CaO, NHỗ ợ ấ ắ ồ
4
Cl, NaHCO
3
có s mol các ch t đ u b ng nhau vàoố ấ ề ằ
m t c c n c l y d , sau m t th i gian đun nóng nh trên ng n l a đèn c n khu y đ u đ n khiộ ố ướ ấ ư ộ ờ ẹ ọ ử ồ ấ ề ế
ph n ng x y ra hoàn toàn thu đ c k t t a ả ứ ả ượ ế ủ A, dung d ch ị B và b t khí ọ C thoát ra kh i dung d ch.ỏ ị
Xác đ nh thành ph n c a ị ầ ủ A, ch t tan trong dung d ch ấ ị B và thành ph n chính c a khí ầ ủ C. Vi tế
ph ng trình d ng ion rút g n các ph n ng x y ra trong thí nghi m trên.ươ ạ ọ ả ứ ả ệ
2. Ph ng pháp chu n đ axit - baz là ph ng pháp chu n đ th tích d a trên s t ng tácươ ẩ ộ ơ ươ ẩ ộ ể ự ự ươ
gi a các axit, baz , t c là d a trên s đo th tích dung d ch thu c th là axit (ho c baz ) cóữ ơ ứ ự ự ể ị ố ử ặ ơ
n ng đ đã bi t ph n ng v i m t th tích xác đ nh dung d ch baz (ho c axit) có n ng đồ ộ ế ả ứ ớ ộ ể ị ị ơ ặ ồ ộ
ch a bi t c n xác đ nh. Hay nói cách khác ph n ng chu n đ axit-baz chính là ph n ngư ế ầ ị ả ứ ẩ ộ ơ ả ứ
trung hòa.
Đ xác đ nh n ng đ c a axit clohiđric trong m u dung d ch HCl, ti n hành thêm d n dungể ị ồ ộ ủ ẫ ị ế ầ
d ch NaOH đã bi t n ng đ vào dung d ch HCl v i ch t ch th thích h p.ị ế ồ ộ ị ớ ấ ỉ ị ợ
a) Vi t ph ng trình ph n ng x y ra.ế ươ ả ứ ả
b) Khi chu n đ 100 ml dung d ch HCl 0,100Mẩ ộ ị b ng V ml dung d ch chu n NaOH 0,100M,ằ ị ẩ
tính pH c a dung d ch thu đ c t i các giá tr : ủ ị ượ ạ ị
+ V = 99,9 ml.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đ THI CHÍNH TH CỀ Ứ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
+ V = 100 ml.
+ V = 100,1 ml.
c) Trong quá trình chu n đ c n thi t ph i d a vào m t tín hi u nào đó đ d ng phép chu nẩ ộ ầ ế ả ự ộ ệ ể ừ ẩ
đ . Ch t có kh năng thay đ i tín hi khi chu n đ g i là ch t ch th .ộ ấ ả ổ ệụ ẩ ộ ọ ấ ỉ ị
- Th i đi m t i đó ch t ch th thay đ i tín hi u g i là đi m k t thúc chu n đ (đi m d ngờ ể ạ ấ ỉ ị ổ ệ ọ ể ế ẩ ộ ể ừ
chu n đ hay đi m cu i chu n đ (ĐCCĐ)).ẩ ộ ể ố ẩ ộ
B ng sau đây ghi kho ng pH đ i màu c a 2 ch t ch th th ng đ c s d ng nhi u trongả ả ổ ủ ấ ỉ ị ườ ượ ử ụ ề
chu n đ axit- baz .ẩ ộ ơ
Tên ch t chấ ỉ
thị
Kho ng pH đ i màuả ổ Màu d ng axit - d ng bazạ ạ ơ
Metyl đỏ 4,2 – 6,3 Đ – Vàngỏ
Phenolphtalein 8,3 – 10,0 Không màu- H ngồ
Có th dùng (nh ng) ch th nào trong s các ch th đ c cho trong b ng sau trong thíể ữ ỉ ị ố ỉ ị ượ ả
nghi m chu n đ ý ệ ẩ ộ ở b) trên? Nêu s đ i màu c a dung d ch t i đi m cu i chu n đ t ngự ổ ủ ị ạ ể ố ẩ ộ ươ
ng khi s d ng (các) ch th đó.ứ ử ụ ỉ ị
Câu 4 (2,0 đi m).ể
1. Cho s đ các ph n ng sau:ơ ồ ả ứ
(1) X
1
+ H
2
O
®iÖnph©n
cã mµng ng¨n
X
2
+ X
3
↑ + H
2
↑
(2) X
2
+ X
4
→ BaCO
3
+ Na
2
CO
3
+ H
2
O
(3) X
2
+ X
3
→ X
1
+ X
5
+ H
2
O
(4) X
4
+ X
6
→ BaSO
4
+ Na
2
SO
4
+ CO
2
+ H
2
O
Xác đ nh các ch t Xị ấ
1
, X
2
, X
3
, X
4
, X
5
, X
6
th a mãn và vi t ph ng trình hoá h c các ph n ngỏ ế ươ ọ ả ứ
trong s đ trên bi t ph n ng (1) đ c dùng đ s n xu t Xơ ồ ế ả ứ ượ ể ả ấ
2
và X
3
trong công nghi p.ệ
2. Cho 29,48 gam h n h p g m Na, Naỗ ợ ồ
2
O, Ba và BaO vào n c d , thu đ c 1,792 lít khí Hướ ư ượ
2
(đktc) và dung d ch ị X. S c 8,064 lít khí COụ
2
(đktc) vào X, thu đ c ượ a gam k t t a và dung d chế ủ ị
Y. Tách k t t a, cho t t dung d ch HCl vào ế ủ ừ ừ ị Y, s ph thu c s mol COự ụ ộ ố
2
khi thêm dung d chị
HCl vào Y đ c bi u di n theo đ th sauượ ể ễ ồ ị
Tính giá tr c a ị ủ a và x.
Câu 5 (2,25 đi m).ể
1. Ti n hành thí nghi m đi u ch và th tính ch t c a hiđrocacbon ế ệ ề ế ử ấ ủ X theo s đ và các b cơ ồ ướ
sau đây:
B c 1: M khoá ph u cho Hướ ở ễ
2
O ch y t t xu ng bình c uả ừ ừ ố ầ
đ ng CaCự
2
.
B c 2: D n X vào bình 1 đ ng dung d ch Brướ ẫ ự ị
2
d .ư
B c 3: D n X vào bình 2 đ ng dung d ch AgNOướ ẫ ự ị
3
trong NH
3
.
B c 4: Đ t cháy X.ướ ố
Nêu hi n t ng và vi t các ph ng trình hoá h c c a cácệ ượ ế ươ ọ ủ
ph n ng đã x y ra.ả ứ ả
2. Cho X, Y, Z, T là các ch t khác nhau trong s 4 ch t: CHấ ố ấ
3
COOH, C
2
H
5
OH, CH
3
CHO,
HCOOH và các giá tr nhi t đ sôi đ c ghi trong b ng sau:ị ệ ộ ượ ả
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Ch tấ X Y Z T
Nhi t đ sôi (ệ ộ
o
C)
78,3 100,8 21,0 118,0
Ghép các ch t v i giá tr nhi t đ sôi cho phù h p. Gi i thích.ấ ớ ị ệ ộ ợ ả
Câu 6 (1,75 đi m).ể
1. Nêu hi n t ng và vi t ph ngệ ượ ế ươ trình hóa h c c a các ph n ng x y ra khi:ọ ủ ả ứ ả
a) S c khí etilen đ n d vào dung d ch KMnOụ ế ư ị
4
.
b) Chi u sáng vào bình c u thu tinh đ c nút kín có ch a h n h p g m CHế ầ ỷ ượ ứ ỗ ợ ồ
4
và Cl
2
(tỉ
l mol 1:1), sau đó cho m u quỳ tím m vào bình c u.ệ ẫ ẩ ầ
2. Nung nóng 0,1 mol C
4
H
10
có xúc tác thích h p, thu đ c h n h p khí ợ ượ ỗ ợ X g m Hồ
2
, CH
4
, C
2
H
4
,
C
2
H
6
, C
3
H
6
, C
4
H
8
và C
4
H
10
. D n ẫ X qua bình đ ng dung d ch Brự ị
2
d , sau khi ph n ng x y raư ả ứ ả
hoàn toàn th y kh i l ng bình tăng ấ ố ượ m gam và có h n h p khí ỗ ợ Y thoát ra. Đ t cháy toàn b ố ộ Y
c n v a đ 7,168 lít khí Oầ ừ ủ
2
(đktc). Tính giá tr c a ị ủ m.
Câu 7 (2,5 đi m).ể
1. Cho các ch t l ng: anilin, lòng tr ng tr ng, axit axetic và dung d ch glucoz đ c kí hi uấ ỏ ắ ứ ị ơ ượ ệ
ng u nhiên là ẫ X, Y, Z, T. K t qu thí nghi m c a các ch t v i thu c th đ c ghi b ng sau:ế ả ệ ủ ấ ớ ố ử ượ ở ả
M u thẫ ử Thu c thố ử Hi n t ngệ ượ
X Tác d ng v i Cu(OH)ụ ớ
2
Có màu tím
Y CaCO
3
S i b t khí không màuủ ọ
Z Dung d ch AgNOị
3
trong NH
3
,
đun nóng nhẹ
K t t a Ag tr ng sángế ủ ắ
T Dung d ch bromị K t t a tr ng ế ủ ắ
Xác đ nh ị X, Y, Z, T và vi t ph ng trình hóa h c c a các ph n ng x y ra (n u có).ế ươ ọ ủ ả ứ ả ế
2. T tinh d u h i, ng i ta tách đ c ừ ầ ồ ườ ượ anetol là m t ch t th m đ c dùng s n xu t k o caoộ ấ ơ ượ ả ấ ẹ
su. Anetol có t kh i h i so v i Nỉ ố ơ ớ
2
là 5,286. Phân tích nguyên t cho th y, ố ấ anetol có ph n trămầ
kh i l ng cacbon và hiđro t ng ng là 81,08%; 8,10%, còn l i là oxi. Xác đ nh công th cố ượ ươ ứ ạ ị ứ
phân t c a ử ủ anetol.
Câu 8 (1,5 đi m).ể
1. H n h p ỗ ợ E g m ba este đ u m ch h , đ u đ c t o b i axit cacboxylic v i ancol và đ u cóồ ề ạ ở ề ượ ạ ở ớ ề
phân t kh i nh h n 146. Đ t cháy hoàn toàn a mol ử ố ỏ ơ ố E, thu đ c 10,976 lít khí COượ
2
(đktc) và
7,29 gam H
2
O. M t khác, th y phân hoàn toàn 29,06 gam ặ ủ E c n v a đ 490 ml dung d ch NaOHầ ừ ủ ị
1M, thu đ c h n h p ancol và 33,22 gam h n h p mu i. Xác đ nh công th c c u t o và tínhượ ỗ ợ ỗ ợ ố ị ứ ấ ạ
ph n trăm v kh i l ng c a m i este trong h n h p ban đ u. ầ ề ố ượ ủ ỗ ỗ ợ ầ
2. Ch t ấ X (C
6
H
16
O
4
N
2
) là mu i amoni c a axit cacboxylic, ch t ố ủ ấ Y (C
6
H
15
O
3
N
3
, m ch h ) là mu iạ ở ố
amoni c a đipeptit. Cho 8,94 gam h n h p ủ ỗ ợ E g m ồ X và Y tác d ng h t v i l ng d dung d chụ ế ớ ượ ư ị
NaOH, thu đ c s n ph m h u c g m 0,05 mol hai amin no (đ u có hai nguyên t cacbonượ ả ẩ ữ ơ ồ ề ử
trong phân t và không là đ ng phân c a nhau) và ử ồ ủ m gam hai mu i. Tính giá tr c a ố ị ủ m.
Cho bi t:ế
S hi u nguyên t c a các nguyên t : ố ệ ử ủ ố C (Z = 6); N (Z = 7); O (Z = 8); F (Z = 9); Mg (Z =
12); Al (Z = 13); Si (Z = 14); P (Z=15); S (Z = 16); Cl (Z = 17).
Nguyên t kh i c a các nguyên t :ử ố ủ ố H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27;
Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Br = 80; Ba = 137.
(H c sinh ọ không đ c s d ng b ng tu n hoàn các nguyên t hóa h c)ượ ử ụ ả ầ ố ọ
---------------------H tế ---------------------
H và tên thí sinh: ọ ………………………………………………………....................... S báo danh:ố …………...........
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Ch kí giám th s 1:ữ ị ố ………………................................………Ch kí giám th s 2:ữ ị ố …......................………....
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
L NG S NẠ Ơ
KỲ THI CH N H C SINH GI I C P T NHỌ Ọ Ỏ Ấ Ỉ
L P 12 NĂM H C 2022 - 2023Ớ Ọ
H NG ƯỚ D N CH M THI MÔN HOÁ H C L P 12 THPTẪ Ấ Ọ Ớ
(H ng d n ch m g m 08 trangướ ẫ ấ ồ )
Chú ý: Nh ng cách gi i khác HDC mà đúng thì cho đi m theo thang đi m đã ữ ả ể ể
đ nh. ị
Câu 1 (4,0 đi m). ể
1. Nguyên tử nguyên tố X có 2 electron phân l p pở ớ và nguyên tử nguyên tố Y có 16 proton
trong h t nhân.ạ
a) Vi t c u hình electron và xác đ nh v trí c a ế ấ ị ị ủ X, Y trong b ng tu nả ầ hoàn các nguyên t hoáố
h c.ọ
b) Nguyên t ố X, Y đ u t o đ c oxit ề ạ ượ XO
2
, YO
2
. K t qu th c nghi m cho th y ế ả ự ệ ấ YO
2
tan nhi uề
trong n c h n ướ ơ XO
2
. Gi i thích k t qu trên d a theo c u t o phân t c a hai oxit trên. ả ế ả ự ấ ạ ử ủ
c) Urê ((NH
2
)
2
CO) là m t lo i phân đ m đ c s d ng nhi u trong s n xu t nông nghi p do cóộ ạ ạ ượ ử ụ ề ả ấ ệ
đ dinh d ng cao. Vi t ph ng trình s n xu t urê t XOộ ưỡ ế ươ ả ấ ừ
2
trong công nghi p.ệ
d) Axit H
2
SO
4
đ c có tính háo n c, nó có th l y n c t m t s h p ch t h u c . Trongặ ướ ể ấ ướ ừ ộ ố ợ ấ ữ ơ
quá trình than hóa saccaroz có s n ph m g m h i n c và h n h p khí ơ ả ẩ ồ ơ ướ ỗ ợ XO
2
, YO
2
. Vi t cácế
ph ng trình c a ph n ng trên và trình bày ph ng pháp hóa h c ch ng minh s có m t c aươ ủ ả ứ ươ ọ ứ ự ặ ủ
các khí XO
2
, YO
2
trong h n h pỗ ợ .
2. Nêu hi n t ng và vi t ph ng trình hóa h c gi i thích các thí nghi m sau:ệ ượ ế ươ ọ ả ệ
- Thí nghi m ệ 1: Cho m t l ng nh kim lo i Na vào dung d ch CuSOộ ượ ỏ ạ ị
4
.
- Thí nghi m 2ệ : Đ t dây s t nóng đ r i đ a vào bình ch a khí clo.ố ắ ỏ ồ ư ứ
- Thí nghi m ệ 3: S c khí ozon vào dung d ch KI có h tinh b t.ụ ị ồ ộ
Câu 1 N i dungộ
4,0 đi mể
1.
(2,5đ)
a) C u hình electron và v trí: ấ ị
Nguyên t ử X: 1s
2
2s
2
2p
2
→ V trí c a nguyên t ị ủ ố X trong BTH: ô th 6, chu kì 2, nhóm IVAứ
Nguyên t Y: 1sử
2
2s
2
2p
6
3s
2
3p
4
→ V trí c a nguyên t ị ủ ố Y trong BTH: ô th 16, chu kì 3, nhóm VIAứ
- N u HS xác đ nh thi u ô v n cho đi m t i đa, thi u chu kì ho c nhómế ị ế ẫ ể ố ế ặ
thì tr 0,125 đi m.ừ ể
0,25
0,25
0,25
0,25
b) Phân t COử
2
không phân c c: O=C=O, ít tan trong dung môiự
phân c c nh Hự ư
2
O, trong khi phân t SOử
2
l i phân c c → tanạ ự
nhi u trong n c h n COề ướ ơ
2
.
S
O
O
S
O
O
0,25
0,25
c) CO
2
+ 2NH
3
200atm
(NH
2
)
2
CO + H
2
O
0,25
d) C
12
H
22
O
11
2 4
H SO ®Æc
12C + 11H
2
O (t a nhi t)ỏ ệ
C + 2H
2
SO
4 (đ c nóng)ặ
CO
2
+ 2SO
2
+ 2H
2
O.
Ch ng minh s có m t c a hai khí trong h n h p, ta d n h n h pứ ự ặ ủ ỗ ợ ẫ ỗ ợ
khí l n l t qua bình 1 đ ng dung d ch Brom ầ ượ ự ị (d )ư và bình 2 đ ngự
dung d ch Ca(OH)ị
2
d r i thêm vài gi t dung d ch BaClư ồ ọ ị
2
vào bình
0,125x5pt
= 0,625
0,125
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
(1):
Hi n t ngệ ượ : Bình (1) brom nh t màu, có k t t a màu tr ng xu tạ ế ủ ắ ấ
hi n ch ng t h n h p có SOệ ứ ỏ ỗ ợ
2
SO
2
+ Br
2
+ 2H
2
O H
2
SO
4
+ 2HBr
H
2
SO
4
+ BaCl
2
BaSO
4
+ 2HCl
Bình (2) xu t hi n k t t a màu tr ng ch ng t có COấ ệ ế ủ ắ ứ ỏ
2
:
CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O
(N u HS thi u b c thêm dung d ch BaClế ế ướ ị
2
thì tr 0,125 đi m c aừ ể ủ
PTHH)
2.
(1,5đ)
- Thí nghi m 1: ệ Xu t hi n b t khí và k t t a màu xanh ấ ệ ọ ế ủ
2Na + 2H
2
O → 2NaOH + H
2
CuSO
4
+ 2NaOH → Cu(OH)
2
+ Na
2
SO
4
0,25
0,25
- Thí nghi m 2: ệ Dây s t cháy sáng, xu t hi n khói màu đ nâuắ ấ ệ ỏ
2Fe + 3Cl
2
t
o
2FeCl
3
0,25
0,25
- Thí nghi m 3: dung d ch chuy n màu xanh, s i b t khí không màuệ ị ể ủ ọ
O
3
+ 2KI + H
2
O → 2KOH + O
2
+ I
2
I
2
+ h tinh b t → dung d ch màu xanhồ ộ ị
0,25
0,25
Câu 2 (3,25 đi m). ể
1. Cân b ng các ph ng trình ph n ng sau theo ph ng pháp thăng b ng electron:ằ ươ ả ứ ươ ằ
a) CrI
3
+ Cl
2
+ KOH → KIO
4
+ K
2
CrO
4
+ KCl + H
2
O
b) Mg + HNO
3
→ Mg(NO
3
)
2
+ NO + H
2
O
2. Cho Fe
3
O
4
tác d ng v i dung d ch Hụ ớ ị
2
SO
4
loãng d thu đ c dung d ch ư ượ ị X. Cho l n l t cácầ ượ
ch t Cu, KMnOấ
4
, NaNO
3
, Cl
2
vào dung d ch ị X. Vi t các ph ng trình ph n ng x y ra (n u có).ế ươ ả ứ ả ế
3. Nung nóng m gam h n h p X g m Mg, Al và Cu trong Oỗ ợ ồ
2
d , thu đ c 23,7 gam h n h p ư ượ ỗ ợ Y
g m các oxit. Hòa tan h t ồ ế Y b ng l ng v a đ dung d ch g m HCl 1M và Hằ ượ ừ ủ ị ồ
2
SO
4
0,5M, thu
đ c dung d ch ch a 64,2 gam h n h p mu i trung hòa. Bi t các ph n ng x y ra hoàn toàn.ượ ị ứ ỗ ợ ố ế ả ứ ả
Tính giá tr c a ị ủ m.
Câu 2 N i dungộ 3,25 đi mể
1.
(1,0đ)
CrI
3
→
6
Cr
+ 3
7
I
+ 27e x 2
0
2
Cl
+ 2e → 2
1
Cl
x 27
2CrI
3
+ 27Cl
2
+ 64KOH → 6KIO
4
+ 2K
2
CrO
4
+ 54KCl + 32H
2
O
0
Mg
→
2
Mg
+ 2e x 3
5
N
+ 3e →
2
N
x 2
3Mg + 8HNO
3
→ 3Mg(NO
3
)
2
+ 2NO + 4H
2
O
0,25
0,25
0,25
0,25
2.
(1,25đ
)
Fe
3
O
4
+ 4H
2
SO
4
→ Fe
2
(SO
4
)
3
+ FeSO
4
+ 4H
2
O
Dung d ch ị X g m:ồ Fe
2
(SO
4
)
3
, FeSO
4
và H
2
SO
4
dư
- Thêm Cu:
Fe
2
(SO
4
)
3
+ Cu → CuSO
4
+ 2FeSO
4
- Thêm KMnO
4
:
10FeSO
4
+ 2KMnO
4
+ 8H
2
SO
4
→ 5Fe
2
(SO
4
)
3
+ 2MnSO
4
+ K
2
SO
4
+ 8H
2
O
- Thêm NaNO
3
:
6FeSO
4
+ 2NaNO
3
+ 4H
2
SO
4
→ 3Fe
2
(SO
4
)
3
+ 2NO + Na
2
SO
4
+ 4H
2
O
- Thêm Cl
2
:
0,25x5 =
1,25
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ