Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) S Ở GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ T NH Ỉ L P Ớ 12 NGH Ệ AN NĂM H C Ọ 2022 – 2023 Môn thi: HÓA H C Ọ – B n ả g A ĐỀ CHÍNH TH C Ứ (Đ ề thi có 3 trang)
Câu I (2,0 đi m ể ) 1. Lập phư ng ơ trình hóa h c ọ b ng ằ phư ng ơ pháp thăng b ng ằ electron, xác đ nh ị ch t ấ oxi hóa, ch t ấ kh ử c a ủ các ph n ả ng ứ oxi hóa kh ử sau: Phản ng ứ tạo gỉ s t ắ trong trong t ự nhiên
Fe + O2 + H2O Fe(OH)3 Dùng dung d c ị h H2O2 đ ể ph c ụ h i ồ các b c ứ tranh c ổ b ịhóa đen b i ở PbS
PbS + H2O2 PbSO4 + H2O 2. Vi t ế phư ng ơ trình đi n ệ li các ch t ấ sau: NaOH, HClO, NaHSO3.
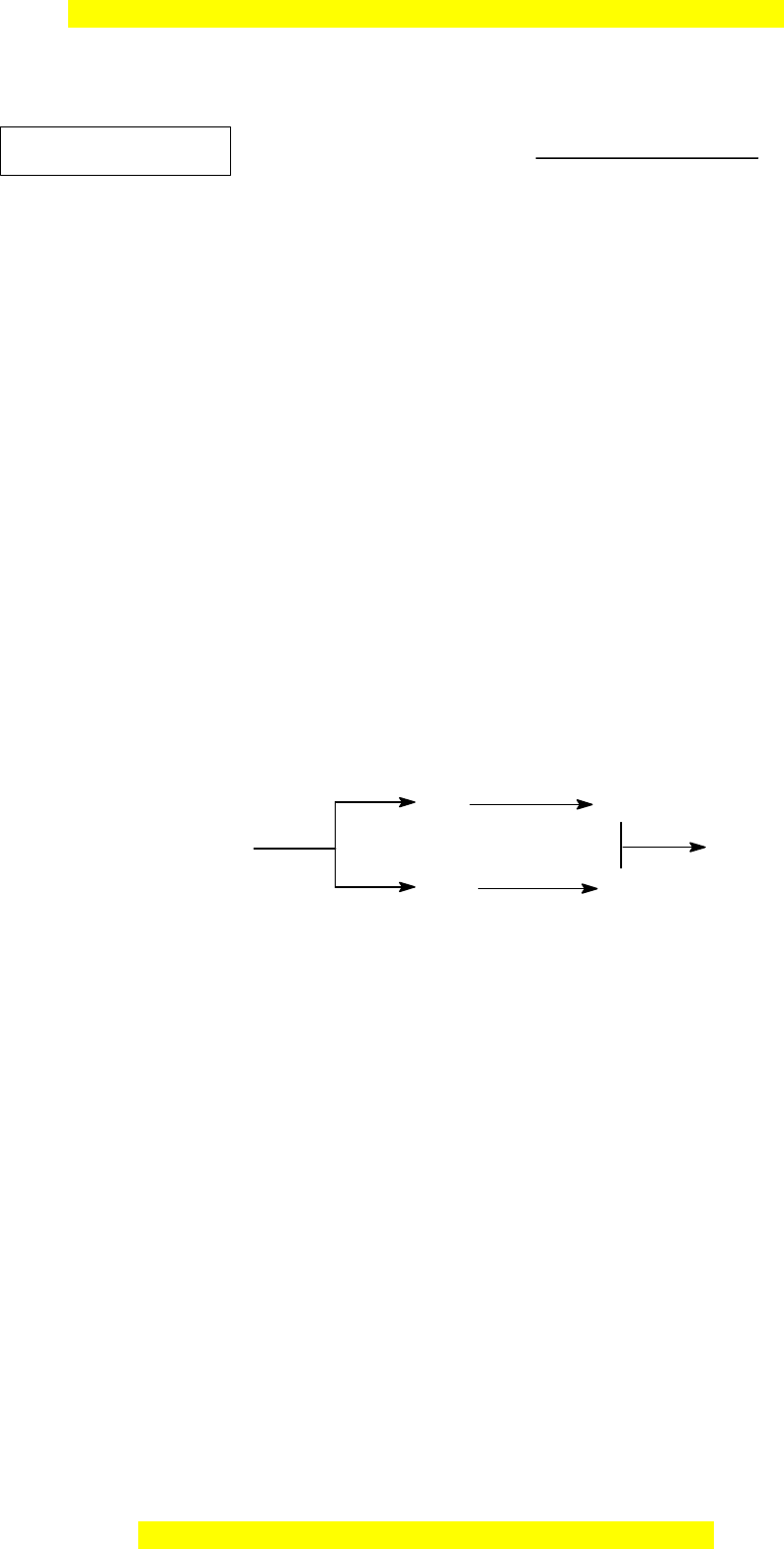
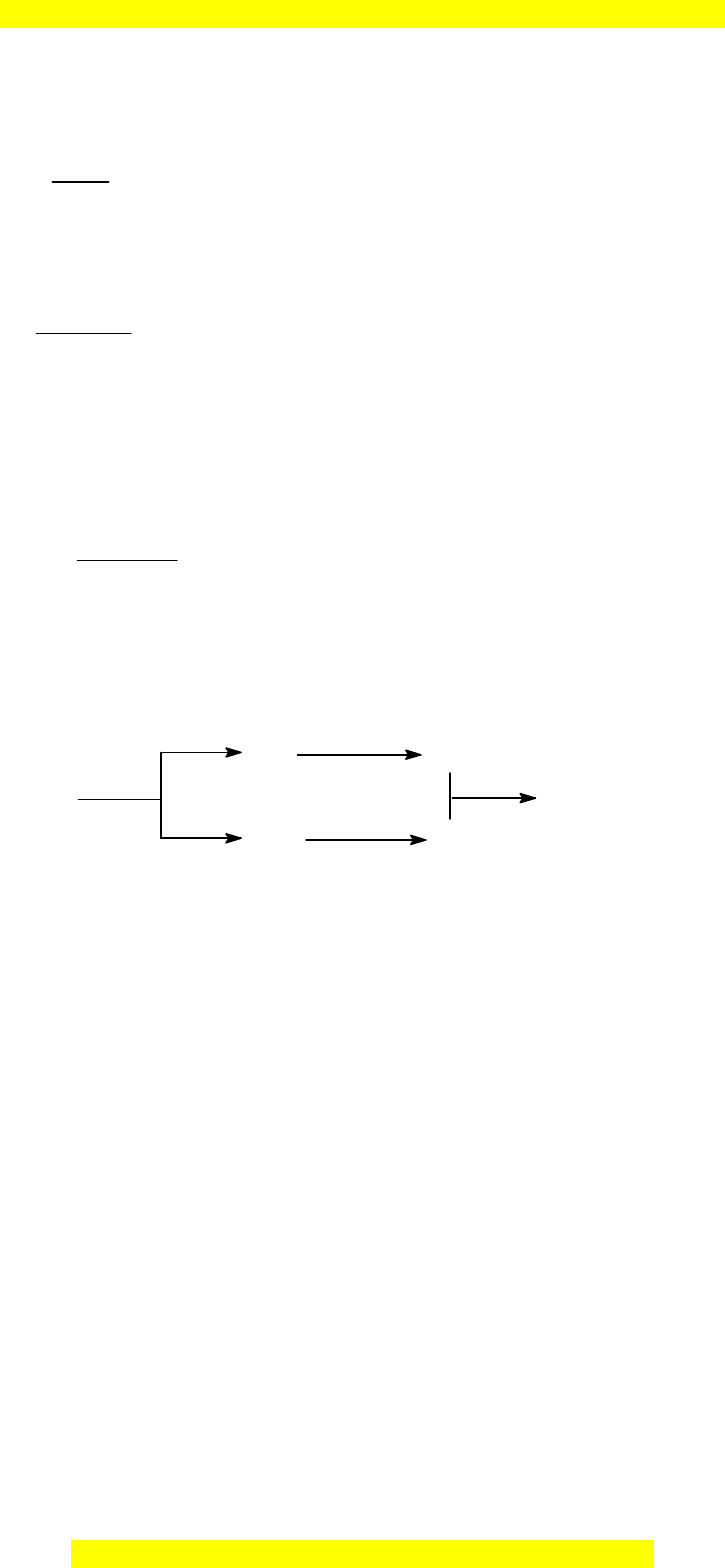
Câu II (4,0 điểm) 1. Vi t ế phư ng ơ trình hóa h c ọ (ghi rõ đi u ề ki n ệ n u ế có) th c ự hi n ệ s ơ đ ồ chuy n ể hóa sau: Cl 2 NaCl HCl Cl2 CaOCl2 (clorua vôi)
2. Quá trình s n ả xu t ấ H2SO4 trong công nghi p ệ , ở công đo n ạ 3 ngư i ờ ta dùng dung d c ị h
H2SO4 nồng độ 98% để h p
ấ thụ SO3 tạo thành oleum. Tính khối lư ng ợ (t n) ấ oleum thu đư c ợ khi dùng 3,6 t n ấ dung d c ị h H2SO4 98% để h p
ấ thụ SO3 thành oleum (giả thi t
ế oleum tạo thành có công th c ứ là H2SO4.2SO3). 3. Vi t ế bốn phư ng ơ trình hóa h c ọ (ghi rõ đi u ề ki n ệ n u ế có) th c ự hi n ệ sơ đồ chuy n ể hóa sau: (2) X Z (1) (4) Cacbon urê (3) Y T 4. Hòa tan h t ế 16 gam gam kim lo i ạ M trong 105 gam dung d c ị h HNO3 48% thu đư c ợ dung dịch X chỉ ch a ứ m t ộ mu i ố . Chia X thành 2 ph n ầ b ng ằ nhau. Ph n ầ 1 cho tác dụng v i ớ 150 ml dung d c ị h NaOH 2M, l c ọ b ỏ k t ế t a ủ r i ồ cô c n ạ dung d c ị h thu đư c ợ chất rắn Y. Nung Y t i ớ kh i ố lư ng ợ không đ i ổ thu đư c ợ 19,25 gam ch t ấ r n. ắ Làm l nh ạ phần 2 đ n
ế 200C thì có 14,8 gam tinh thể (E) tách ra và dung d c ị h còn l i ạ có n ng ồ độ 35,61%. Bi t ế hiđroxit c a
ủ M không tan trong dung d c ị h ki m. ề Xác đ nh ị công th c ứ c a ủ E.
Câu III (2,0 đi m ể ) Hỗn h p ợ X g m ồ hai mu i
ố M2CO3 và MHCO3. Cho dung d c ị h HCl d ư vào 8,84 gam X, thu đư c ợ dung d c
ị h Y và CO2. Hấp thụ h t ế lư ng
ợ CO2 ở trên vào dung d c ị h ch a ứ 0,02 mol
Ba(OH)2 và 0,10 mol KOH, sau khi các ph n ả ng ứ x y ả ra hoàn toàn thu đư c ợ k t ế t a ủ Z và dung dịch T ch ỉ ch a ứ 8,76 gam mu i. ố 1. Xác đ nh ị công th c ứ hai mu i ố trong X.
2. Tính % khối lư ng ợ mỗi muối trong X.
Câu IV (4,0 đi m ể )
1. Oximen có công th c ứ phân t
ử C10H16 (có trong tinh d u ầ lá húng qu ) ế , có c u ấ t o ạ m c ạ h h , ở chỉ ch a ứ liên k t ế đôi và liên k t ế đ n ơ trong phân t . ử Xác đ nh ị s ố liên k t ế π (pi), liên k t ế (xích ma), liên k t ế đ n ơ có trong m t ộ phân t ử oximen. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) 2. Hãy gi i ả thích: T i ạ sao không đư c ợ đ ể các bình ch a ứ xăng, d u ầ (g m ồ các ankan) g n ầ l a ử , trong khi đó ngư i ờ ta có thể n u ấ ch y ả nh a ự đư n ờ g (trong thành ph n ầ cũng có các ankan) đ ể làm đư n ờ g giao thông. Không dùng nư c ớ để d p
ậ các đám cháy xăng, d u ầ mà ph i ả dùng cát ho c ặ khí cacbonic. 3. H p ợ ch t ấ h u ữ cơ X, Y, Z đ u ề đ n ơ ch c ứ , m c ạ h h . ở Hai ch t ấ X, Y có cùng công th c ứ
phân tử C3H6O và khi tác d n ụ g v i ớ H2 (xúc tác Ni, to) t o ạ ra cùng s n ả ph m ẩ h u ữ c . ơ Ch t ấ Z có công th c ứ phân t ử C3H4O2 ph n ả n ứ g đư c ợ v i ớ Na và dung d c ị h NaOH. Vi t ế phư n ơ g trình hóa h c ọ c a ủ ph n ả n ứ g x y ả ra trong các thí nghi m ệ trên. 4. Cho 17,2 gam h n ỗ h p ợ X g m ồ hai anđehit A, B (đ u ề m c ạ h h , ở không phân nhánh) tác d n ụ g v i ớ H o
2 dư (xúc tác Ni, t ), thu đư c ợ 18,4 gam h n ỗ h p ợ Y g m ồ hai ancol. Đ t ố cháy h t ế 18,4 gam Y trong O2 d , ư thu đư c
ợ 0,7 mol CO2 và 1,0 mol H2O. Bi t ế các ph n ả n ứ g x y ả ra hoàn toàn. Xác đ n ị h công th c ứ c u ấ t o ạ c a ủ A, B. Câu V (2,0 đi m ể ) 1. Mỡ đ ng ộ v t ậ và d u ầ th c ự v t ậ là th c ứ ăn quan tr ng ọ c a ủ con ngư i ờ vì v y ậ chúng thư ng ờ đư c ợ s ử dụng làm th c ự ph m. ẩ D a ự vào tính ch t ấ c a ủ chúng hãy cho bi t: ế Chảo rán dính d u ầ mỡ đ ng ộ th c ự v t ậ khi ta tráng b ng ằ nư c ớ ở nhi t ệ độ thư ng ờ thì có sạch đư c ợ không? Gi i ả thích. Các ng ố nư c ớ th i ả nhà b p ế thư ng ờ hay b ị t c ắ do d u ầ m ỡ đóng r n ắ và bám vào đư ng ờ ng. ố Có thể dùng nư c ớ sôi đổ vào đư ng ờ ng ố bị t c ắ đó để thông đư ng ờ ng ố đư c ợ không? Gi i ả thích. Xác đ nh ị công th c ứ c a ủ este X.
2. Đốt cháy hoàn toàn 0,15 mol h n ỗ h p ợ E g m ồ 2 este X, Y (đ u ề ch ỉch a ứ nhóm ch c ứ este, m c ạ h h ; ở MX < MY), thu đư c
ợ 0,55 mol CO2 và 0,5 mol H2O. M t ặ khác, cho E phản ứng hoàn toàn v i ớ dung d c ị h NaOH d , ư thu đư c ợ h n ỗ h p ợ hai ancol (có cùng số
nguyên tử cacbon) và hai mu i ố h n ơ kém nhau m t
ộ nguyên tử cacbon. Xác đ nh ị công thức cấu tạo c a ủ X, Y và ph n ầ trăm kh i ố lư ng ợ c a ủ Y trong E. 3. Vi t ế phư ng ơ trình hóa h c ọ c a ủ ph n ả ng ứ x y ả ra trong các trư ng ờ h p ợ sau: Thủy phân tinh b t
ộ (có xúc tác enzim) thu đư c ợ glucoz . ơ Lên men glucoz ơ trong dung d c ị h t o
ạ ra ancol etylic và khí cacbonic. Trong dung d c ị h, saccarozơ ph n ả ng ứ v i ớ Cu(OH)2 tạo ra dung d c ị h màu xanh lam. Xenlulozơ tác d ng ụ v i ớ axit HNO3 đ c ặ (xúc tác H2SO4 đ c ặ ) t o ạ ra xenlulozơ trinitrat (dùng ch
ế tạo thuốc súng không khói). 4. Thực hi n ệ ph n ả ng ứ este hóa h n ỗ h p ợ g m ồ X g m ồ CH3COOH, C2H5COOH và
C2H4(OH)2 (có xúc tác H2SO4 đặc), thu đư c ợ h n ỗ h p ợ Y g m ồ các ch t ấ h u ữ cơ ch a ứ ch c ứ este. Vi t ế phư ng ơ trình hóa h c ọ c a ủ ph n ả ng ứ t o ạ ra các ch t ấ trong Y. Câu VI (4,0 đi m ể ) Hỗn h p ợ E g m
ồ axit cacboxylic X, ancol Y và este Z (ch ỉch a ứ nhóm ch c ứ este, m c ạ h h , ở đư c ợ t o ạ từ X v i ớ Y; Mz < 170). Đ t
ố cháy hoàn toàn 21,3 gam E thu đư c ợ H2O và 13,44 lít CO2. M t
ặ khác, 21,3 gam E tác d ng ụ đư c ợ t i ố đa v i
ớ 0,3 mol NaOH trong dung d c ị h thu đư c
ợ muối và m gam ancol Y. Cho toàn b ộ m gam Y tác d ng ụ v i ớ Na d , ư thu đư c ợ 3,36 lít H2. 1. Xác đ nh ị công th c ứ c u ấ t o ạ c a ủ X, Y, Z.
2. Tính phần trăm khối lư ng ợ các ch t ấ trong E. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) Câu VII (2,0 đi m ể ) Thí nghi m ệ tráng bạc c a ủ glucoz ơ đư c ợ ti n ế hành theo hai bư c ớ sau: Bước 1: Cho vào m t ộ ng ố nghi m ệ s c ạ h 1 ml dung d c
ị h AgNO3 1%, sau đó nhỏ ti p ế từng gi t ọ dung d c ị h NH3 vào cho đ n ế khi k t ế t a ủ v a ừ xu t ấ hi n ệ l i ạ tan h t ế . Bước 2: Thêm ti p ế 1 ml dung d c ị h glucozơ 1% vào ng ố nghi m ệ trên r i ồ đun nóng nhẹ. Hãy: + Nêu hi n ệ tư ng ợ , vi t ế phư ng ơ trình hóa h c ọ c a ủ ph n ả ng ứ x y ả ra ở bư c ớ 2. + Cho bi t ế hi n ệ tư ng ợ x y ả ra n u ế ở bư c ớ 2 đun sôi dung d c ị h. + Xác đ nh ị ch t ấ oxi hóa, ch t ấ kh ử trong ph n ả ng ứ tráng b c ạ c a ủ glucoz . ơ + Giải thích t i ạ sao ngư i ờ ta dùng saccaroz ơ làm nguyên li u ệ trong công nghi p ệ tráng ru t
ộ phích mà không dùng glucoz . ơ Cho nguyên t ử kh i: ố
H = 1; C = 12; N = 14; O = 16; Na = 23; Mg=24; Al = 27; S = 32; Cl = 35,5;
K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137; Pb=207. ---HẾT---
Họ và tên thí sinh....................................................Số báo danh: .................................. Chữ kí cán b coi ộ thi số 1: Chữ kí cán b coi ộ thi số 2: M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) S Ở GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ T NH Ỉ L P Ớ 12 NGH Ệ AN NĂM H C Ọ 2022 – 2023 Môn thi: HÓA H C Ọ – B n ả g A HDC CHÍNH TH C Ứ (Hư ng ớ
dẫn chấm gồm 8 trang) Câ Ý N i ộ dung Điểm u 1 Lập phư ng ơ trình hóa h c ọ b ng ph ằ ư ng phá ơ p thăng b ng e ằ lectron, xác đ nh c ị h t ấ 1 đi m ể oxi hóa, chất kh c ử a ủ các phản ng ứ oxi hóa kh s ử au: + Phản ng
ứ tạo gỉ sắt trong trong tự nhiên 1 Fe + O2 + H2O Fe(OH)3 + Dùng dung d c ị h H2O2 để ph c ụ h i ồ các b c ứ tranh cổ b hóa ị đen b i ở PbS PbS + H2O2 PbSO4 + H2O
+ Chất oxi hóa là O2, chất kh l ử à Fe M i ỗ trư n ờ g h p ợ 0,5 điểm
+ Chất oxi hóa là H2O2, chất khử là PbS 2 Viết phư ng ơ trình đi n
ệ li các chất sau: NaOH, HClO, NaHSO3. 1 đi m ể NaOH Na + OH M i ỗ phư n ơ HClO H ClO g trình NaHSO Na HSO 3 3 đúng = HSO H 2 SO 0,25 3 3 1 Viết phư ng ơ trình hóa h c ọ (ghi rõ đi u ề ki n n ệ u c ế ó) th c ự hi n s ệ đ ơ ồ chuy n hóa ể 1 đi m ể sau: 2 Cl
2 NaCl HCl Cl2 CaOCl2 (clorua vôi) Cl + 2Na 2NaCl M i ỗ 2 NaCl (r¾n) + H SO (®Æc) o phư n ơ t NaHSO + HCl 2 4 4 g trình MnO o 4HCl(® Æc) t MnCl + Cl + 2H O đúng = 2 2 2 2 Cl + Ca(OH) (v«i s÷a) 0,25 CaOCl + H O 2 2 2 2
2 Quá trình s n ả xu t ấ H2SO4 trong công nghi p ệ , ở công đo n ạ 3 người ta dùng dung 1 đi m ể M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Nghệ An năm 2023 có đáp án
4.2 K
2.1 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1053587071- NGUYEN VAN DOAN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Nghệ An năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(4234 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
NGH ANỆ
KỲ THI CH N H C SINH GI I T NH L P 12Ọ Ọ Ỏ Ỉ Ớ
NĂM H C 2022 – 2023Ọ
Môn thi: HÓA H C – B ng AỌ ả
(Đ thi có 3 trang)ề
Câu I (2,0 đi m)ể
1. L p ph ng trình hóa h c b ng ph ng pháp thăng b ng electron, xác đ nh ch t oxiậ ươ ọ ằ ươ ằ ị ấ
hóa, ch t kh c a các ph n ng oxi hóa kh sau:ấ ử ủ ả ứ ử
Ph n ng t o g s t trong trong t nhiênả ứ ạ ỉ ắ ự
Fe + O
2
+ H
2
O
Fe(OH)
3
Dùng dung d ch Hị
2
O
2
đ ph c h i các b c tranh c b hóa đen b i PbSể ụ ồ ứ ổ ị ở
PbS + H
2
O
2
PbSO
4
+ H
2
O
2. Vi t ph ng trình đi n li các ch t sau: NaOH, HClO, NaHSOế ươ ệ ấ
3
.
Câu II (4,0 đi m)ể
1. Vi t ph ng trình hóa h c (ghi rõ đi u ki n n u có) th c hi n s đ chuy n hóa sau:ế ươ ọ ề ệ ế ự ệ ơ ồ ể
Cl
2
NaCl
HCl
Cl
2
CaOCl
2
(clorua vôi)
2. Quá trình s n xu t Hả ấ
2
SO
4
trong công nghi p, công đo n 3 ng i ta dùng dung d chệ ở ạ ườ ị
H
2
SO
4
n ng đ 98% đ h p th SOồ ộ ể ấ ụ
3
t o thành oleumạ . Tính kh i l ng (t n) oleumố ượ ấ
thu đ c khi dùng 3,6 t n dung d ch Hượ ấ ị
2
SO
4
98% đ h p th SOể ấ ụ
3
thành oleum (giả
thi t oleum t o thành có công th c là Hế ạ ứ
2
SO
4
.2SO
3
).
3. Vi t ế b nố ph ng trình hóa h cươ ọ (ghi rõ đi u ki n n u có)ề ệ ế th c hi n s đ chuy n hóaự ệ ơ ồ ể
sau:
Cacbon
X
Y
Z
T
urê
(1)
(2)
(3)
(4)
4. Hòa tan h t 16 gam gam kim lo i M trong 105 gam dung d ch HNOế ạ ị
3
48% thu đ cượ
dung d ch X ch ch a m t mu i. Chia X thành 2 ph n b ng nhau. Ph n 1 cho tácị ỉ ứ ộ ố ầ ằ ầ
d ng v i 150 ml dung d ch NaOH 2M, l c b k t t a r i cô c n dung d ch thu đ cụ ớ ị ọ ỏ ế ủ ồ ạ ị ượ
ch t r n Y. Nung Y t i kh i l ng không đ i thu đ c 19,25 gam ch t r n. Làm l nhấ ắ ớ ố ượ ổ ượ ấ ắ ạ
ph n 2 đ n 20ầ ế
0
C thì có 14,8 gam tinh th (ể E) tách ra và dung d ch còn l i có n ng đị ạ ồ ộ
35,61%. Bi t hiđroxit c a M không tan trong dung d ch ki m. Xác đ nh công th c c aế ủ ị ề ị ứ ủ
E.
Câu III (2,0 đi m)ể
H n h p X g m hai mu i Mỗ ợ ồ ố
2
CO
3
và MHCO
3
.
Cho dung d ch HCl d vào 8,84 gam X,ị ư
thu đ c dung d ch Y và COượ ị
2
. H p th h t l ng COấ ụ ế ượ
2
trên vào dung d ch ch a 0,02 molở ị ứ
Ba(OH)
2
và 0,10 mol KOH, sau khi các ph n ng x y ra hoàn toàn thu đ c k t t a Z vàả ứ ả ượ ế ủ
dung d ch T ch ch a 8,76 gam mu i.ị ỉ ứ ố
1. Xác đ nh công th c hai mu i trong X.ị ứ ố
2. Tính % kh i l ng m i mu i trong X.ố ượ ỗ ố
Câu IV (4,0 đi m)ể
1. Oximen có công th c phân t Cứ ử
10
H
16
(có trong tinh d u lá húng qu ), có c u t o m chầ ế ấ ạ ạ
h , ch ch a liên k t đôi và liên k t đ n trong phân t . Xác đ nh s liên k t π (pi),ở ỉ ứ ế ế ơ ử ị ố ế
liên k t ế (xích ma), liên k t đ n có trong m t phân t oximen.ế ơ ộ ử
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đ CHÍNH TH CỀ Ứ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
2. Hãy gi i thích:ả
T i sao không đ c đ các bình ch a xăng, d u (g m các ankan) g n l a, trongạ ượ ể ứ ầ ồ ầ ử
khi đó ng i ta có th n u ch y nh a đ ng (trong thành ph n cũng có cácườ ể ấ ả ự ườ ầ
ankan) đ làm đ ng giao thông.ể ườ
Không dùng n c đ d p các đám cháy xăng, d u mà ph i dùng cát ho c khíướ ể ậ ầ ả ặ
cacbonic.
3. H p ch t h u c X, Y, Z đ u đ n ch c, m ch h . Hai ch t X, Y có cùng công th cợ ấ ữ ơ ề ơ ứ ạ ở ấ ứ
phân t Cử
3
H
6
O và khi tác d ng v i Hụ ớ
2
(xúc tác Ni, t
o
) t o ra cùng s n ph m h u c .ạ ả ẩ ữ ơ
Ch t Z có công th c phân t Cấ ứ ử
3
H
4
O
2
ph n ng đ c v i Na và dung d ch NaOH. Vi tả ứ ượ ớ ị ế
ph ng trình hóa h c c a ph n ng x y ra trong các thí nghi m trên.ươ ọ ủ ả ứ ả ệ
4. Cho 17,2 gam h n h p X g m hai anđehit A, B (đ u m ch h , không phân nhánh) tácỗ ợ ồ ề ạ ở
d ng v i Hụ ớ
2
d (xúc tác Ni, tư
o
), thu đ c 18,4 gam h n h p Y g m hai ancol. Đ t cháyượ ỗ ợ ồ ố
h t 18,4 gam Y trong Oế
2
d , thu đ c 0,7 mol COư ượ
2
và 1,0 mol H
2
O. Bi t các ph n ngế ả ứ
x y ra hoàn toàn. Xác đ nh công th c c u t o c a A, B.ả ị ứ ấ ạ ủ
Câu V (2,0 đi m)ể
1. M đ ng v t và d u th c v t là th c ăn quan tr ng c a con ng i vì v y chúngỡ ộ ậ ầ ự ậ ứ ọ ủ ườ ậ
th ng đ c s d ng làm th c ph m. D a vào tính ch t c a chúng hãy cho bi t:ườ ượ ử ụ ự ẩ ự ấ ủ ế
Ch o rán dính d u m đ ng th c v t khi ta tráng b ng n c nhi t đả ầ ỡ ộ ự ậ ằ ướ ở ệ ộ
th ng thì có s ch đ c không? Gi i thích. ườ ạ ượ ả
Các ng n c th i nhà b p th ng hay b t c do d u m đóng r n và bám vàoố ướ ả ế ườ ị ắ ầ ỡ ắ
đ ng ng. Có th dùng n c sôi đ vào đ ng ng b t c đó đ thôngườ ố ể ướ ổ ườ ố ị ắ ể
đ ng ng đ c không? Gi i thích.ườ ố ượ ả
Xác đ nh công th c c a este X.ị ứ ủ
2. Đ t cháy hoàn toàn 0,15 mol h n h p E g m 2 este X, Y (đ u ch ch a nhóm ch cố ỗ ợ ồ ề ỉ ứ ứ
este, m ch h ; Mạ ở
X
< M
Y
), thu đ c 0,55 mol COượ
2
và 0,5 mol H
2
O. M t khác, cho Eặ
ph n ng hoàn toàn v i dung d ch NaOH d , thu đ c h n h p hai ancol (có cùng sả ứ ớ ị ư ượ ỗ ợ ố
nguyên t cacbon) và hai mu i h n kém nhau m t nguyên t cacbon. Xác đ nh côngử ố ơ ộ ử ị
th c c u t o c a X, Y và ph n trăm kh i l ng c a Y trong E.ứ ấ ạ ủ ầ ố ượ ủ
3. Vi t ph ng trình hóa h c c a ph n ng x y ra trong các tr ng h p sau:ế ươ ọ ủ ả ứ ả ườ ợ
Th y phân tinh b t (có xúc tác enzim) thu đ c glucoz . ủ ộ ượ ơ
Lên men glucoz trong dung d ch t o ra ancol etylic và khí cacbonic.ơ ị ạ
Trong dung d ch, saccaroz ph n ng v i Cu(OH)ị ơ ả ứ ớ
2
t o ra dung d ch màu xanhạ ị
lam.
Xenluloz tác d ng v i axit HNOơ ụ ớ
3
đ c (xúc tác Hặ
2
SO
4
đ c) t o ra xenlulozặ ạ ơ
trinitrat (dùng ch t o thu c súng không khói).ế ạ ố
4. Th c hi n ph n ng este hóa h n h p g m X g m CHự ệ ả ứ ỗ ợ ồ ồ
3
COOH, C
2
H
5
COOH và
C
2
H
4
(OH)
2
(có xúc tác H
2
SO
4
đ c), thu đ c h n h p Y g m các ch t h u c ch aặ ượ ỗ ợ ồ ấ ữ ơ ứ
ch c este. Vi t ph ng trình hóa h c c a ph n ng t o ra các ch t trong Y.ứ ế ươ ọ ủ ả ứ ạ ấ
Câu VI (4,0 đi m)ể
H n h p E g m axit cacboxylic X, ancol Y và este Z (ch ch a nhóm ch c este, m chỗ ợ ồ ỉ ứ ứ ạ
h , đ c t o t X v i Y; Mở ượ ạ ừ ớ
z
< 170). Đ t cháy hoàn toàn 21,3 gam E thu đ c Hố ượ
2
O và 13,44
lít CO
2
. M t khác, 21,3 gam E tác d ng đ c t i đa v i 0,3 mol NaOH trong dung d ch thuặ ụ ượ ố ớ ị
đ c mu i và m gam ancol Y. Cho toàn b m gam Y tác d ng v i Na d , thu đ c 3,36 lítượ ố ộ ụ ớ ư ượ
H
2
.
1. Xác đ nh công th c c u t o c a X, Y, Z.ị ứ ấ ạ ủ
2. Tính ph n trăm kh i l ng các ch t trong E.ầ ố ượ ấ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Câu VII (2,0 đi m)ể
Thí nghi m tráng b c c a glucoz đ c ti n hành theo hai b c sau:ệ ạ ủ ơ ượ ế ướ
B c 1: ướ Cho vào m t ng nghi m s ch 1 ml dung d ch AgNOộ ố ệ ạ ị
3
1%, sau đó nh ti pỏ ế
t ng gi t dung d ch NHừ ọ ị
3
vào cho đ n khi k t t a v a xu t hi n l i tan h t.ế ế ủ ừ ấ ệ ạ ế
B c 2: ướ Thêm ti p 1 ml dung d ch glucoz 1% vào ng nghi m trên r i đun nóngế ị ơ ố ệ ồ
nh .ẹ
Hãy:
+ Nêu hi n t ng, vi t ph ng trình hóa h c c a ph n ng x y ra b c 2.ệ ượ ế ươ ọ ủ ả ứ ả ở ướ
+ Cho bi t hi n t ng x y ra n u b c 2 đun sôi dung d ch.ế ệ ượ ả ế ở ướ ị
+ Xác đ nh ch t oxi hóa, ch t kh trong ph n ng tráng b c c a glucoz .ị ấ ấ ử ả ứ ạ ủ ơ
+ Gi i thích t i sao ng i ta dùng saccaroz làm nguyên li u trong công nghi p trángả ạ ườ ơ ệ ệ
ru t phích mà không dùng glucoz .ộ ơ
Cho nguyên t kh i: ử ố
H = 1; C = 12; N = 14; O = 16; Na = 23; Mg=24; Al = 27; S = 32; Cl = 35,5;
K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137; Pb=207.
---H T---Ế
H và tên thí sinhọ ....................................................S báo danh: ố ..................................
Ch kí cán b coi thi s 1:ữ ộ ố Ch kí cán b coi thi s 2: ữ ộ ố
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
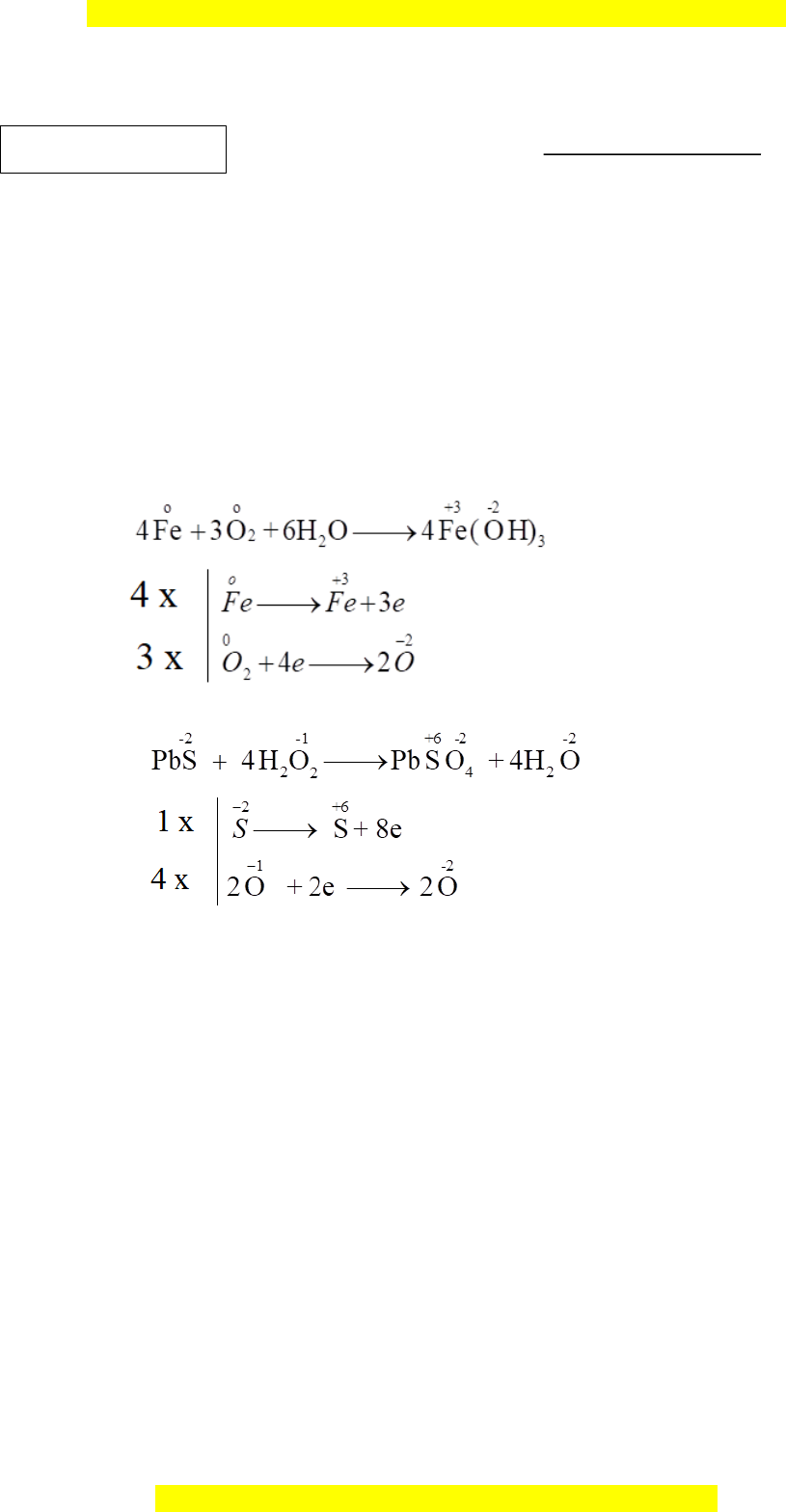
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
NGH ANỆ
KỲ THI CH N H C SINH GI I T NH L P 12Ọ Ọ Ỏ Ỉ Ớ
NĂM H C 2022 – 2023Ọ
Môn thi: HÓA H C – B ng AỌ ả
(H ng d n ch m g m ướ ẫ ấ ồ 8 trang)
Câ
u
Ý N i dungộ Đi mể
1
1
L p ph ng trình hóa h c b ng ph ng pháp thăng b ng electron, xác đ nh ch t ậ ươ ọ ằ ươ ằ ị ấ
oxi hóa, ch t kh c a các ph n ng oxi hóa kh sau:ấ ử ủ ả ứ ử
+ Ph n ng t o g s t trong trong t nhiênả ứ ạ ỉ ắ ự
Fe + O
2
+ H
2
O
Fe(OH)
3
+ Dùng dung d ch Hị
2
O
2
đ ph c h i các b c tranh c b hóa đen b i PbSể ụ ồ ứ ổ ị ở
PbS + H
2
O
2
PbSO
4
+ H
2
O
1 đi mể
+ Ch t oxi hóa là Oấ
2
, ch t kh là Feấ ử
+ Ch t oxi hóa là Hấ
2
O
2
, ch t kh là PbSấ ử
M iỗ
tr ngườ
h pợ
0,5
đi mể
2
Vi t ph ng trình đi n li các ch t sau: NaOH, HClO, NaHSOế ươ ệ ấ
3
.
1 đi mể
3 3
2
3 3
NaOH Na + OH
HClO H ClO
NaHSO Na HSO
HSO H SO
M i ỗ
ph nươ
g trình
đúng =
0,25
2
1
Vi t ph ng trình hóa h c (ghi rõ đi u ki n n u có) th c hi n s đ chuy n hóa ế ươ ọ ề ệ ế ự ệ ơ ồ ể
sau:
Cl
2
NaCl
HCl
Cl
2
CaOCl
2
(clorua vôi)
1 đi mể
2
2 4 4
2 2 2 2
2 2 2 2
Cl + 2Na 2NaCl
NaCl (r¾n) + H SO (®Æc) NaHSO + HCl
MnO 4HCl(®Æc) MnCl + Cl + 2H O
Cl + Ca(OH) (v«i s÷a) CaOCl + H O
o
o
t
t
M iỗ
ph nươ
g trình
đúng =
0,25
2
Quá trình s n xu t Hả ấ
2
SO
4
trong công nghi p, công đo n 3 ng i ta dùng dung ệ ở ạ ườ
1 đi mể
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
HDC CHÍNH TH CỨ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
d ch Hị
2
SO
4
n ng đ 98% đ h p th SOồ ộ ể ấ ụ
3
t o thành oleumạ . Tính kh i l ng (t n) ố ượ ấ
oleum thu đ c khi dùng 3,6 t n dung d ch Hượ ấ ị
2
SO
4
98% đ h p th SOể ấ ụ
3
thành oleum
(gi thi t oleum t o thành có công th c là Hả ế ạ ứ
2
SO
4
.2SO
3
).
m H
2
O =
3,6.2
=0,072(tÊn)
100
; m H
2
SO
4
= 3,6 – 0,072 = 3,528(t n) ấ
SO
3
+ H
2
O
H
2
SO
4
(1)
m SO
3
=
0,072.80
=0,32(tÊn)
18
m H
2
SO
4
(1) = 0,072 + 0,32 = 0,392 (t n); t ng kh i l ng Hấ ổ ố ượ
2
SO
4
= 3,528 + 0,392
= 3,92 (t n)ấ
2SO
3
+ H
2
SO
4
H
2
SO
4
.2SO
3
(2)
m SO
3
(2)
=
3,92.2.80
=6,4(tÊn)
98
m oleum = 6,4 + 0,32 +3,6 = 10,32 (t n) ấ
0,25
0,75
3
Vi t ế b nố ph ng trình hóa h cươ ọ (ghi rõ đi u ki n n u có)ề ệ ế th c hi n s đ chuy n ự ệ ơ ồ ể
hóa sau:
Cacbon
X
Y
Z
T
urê
(1)
(2)
(3)
(4)
1 đi mể
2 2
2 2
,
2 2 3
,
3 2 2 2 2
C + H O CO + H
2CO + O 2CO
3H N 2NH
2NH + CO (NH ) CO + H O
o
o
o
o
t
t
xt t
t p
M iỗ
ph nươ
g trình
đúng =
0,25
4
Hòa tan h t 16 gam gam kim lo i M trong 105 gam dung d ch HNOế ạ ị
3
48% thu
đ c dung d ch X ch ch a m t mu i. Chia X thành 2 ph n b ng nhau. Ph n 1ượ ị ỉ ứ ộ ố ầ ằ ầ
cho tác d ng v i 150 ml dung d ch NaOH 2M, l c b k t t a r i cô c n dungụ ớ ị ọ ỏ ế ủ ồ ạ
d ch thu đ c ch t r n Y. Nung Y t i kh i l ng không đ i thu đ c 19,25ị ượ ấ ắ ớ ố ượ ổ ượ
gam ch t r n. Làm l nh ph n 2 đ n 20ấ ắ ạ ầ ế
0
C thì có 14,8 gam tinh th (ể E) tách ra và
dung d ch còn l i có n ng đ 35,61%. Bi t hiđroxit c a M không tan trong dungị ạ ồ ộ ế ủ
d ch ki m. ị ề Xác đ nh công th c c a ị ứ ủ E.
1 đi mể
3
NaOH
0,8 mol; n = 0,3 mol
HNO
n
3 3 2
M + HNO M(NO ) + khÝ + H O (1)
n
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ







