Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Ấ T N Ỉ H THPT NĂM 2022 T N Ỉ H QU N Ả G NINH Môn thi: HÓA H C Ọ - Bảng A Ngày thi: 02/12/2022 Th i
ờ gian làm bài: 180 phút, không kể th i ờ gian giao đề ĐỀ THI CHÍNH TH C Ứ
(Đề thi này có 02 trang) Câu 1 (4,0 điểm)
1. Nguyên tử X có c u ấ hình electron l p
ớ ngoài cùng là 3sx, nguyên tử Y có c u ấ hình electron phân l p ớ ngoài cùng là 3py. T ng ổ số electron l p ớ ngoài cùng c a
ủ hai nguyên tử X và Y b ng ằ 7. Vi t ế c u ấ hình electron c a
ủ nguyên tử X, Y và xác đ nh v ị ị trí c a ủ chúng trong b ng t ả u n hoà ầ n.
2. X, Y, R, A, B, M theo thứ tự là sáu nguyên t ố liên ti p ế trong b ng ả tu n ầ hoàn có t ng ổ s ố đ n ơ v ịđi n ệ
tích hạt nhân là 63 (X có s đ ố n ơ v đi ị n t ệ ích h t ạ nhân nh nh ỏ t ấ ). a. Xác đ nh ị s đ ố n v ơ đi ị n ệ tích hạt nhân c a ủ X, Y, R, A, B, M.
b. Viết cấu hình electron c a
ủ X2−, Y−, R, A+, B2+, M3+. So sánh bán kính c a ủ chúng và gi i ả thích. 3. Cân bằng phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ oxi hóa - khử sau b ng ằ phư ng ơ pháp thăng b ng ằ electron: a. FeS2 + H2SO4 Fe2(SO4)3 + SO2 + H2O b. Na2SO3 + KMnO4 + NaHSO4 Na2SO4 + MnSO4 + K2SO4 + H2O 4. Phần trăm kh i ố lư ng ợ c a ủ nguyên tố R trong h p ợ ch t ấ khí v i
ớ hiđro (trong đó R có s ố oxi hóa th p ấ
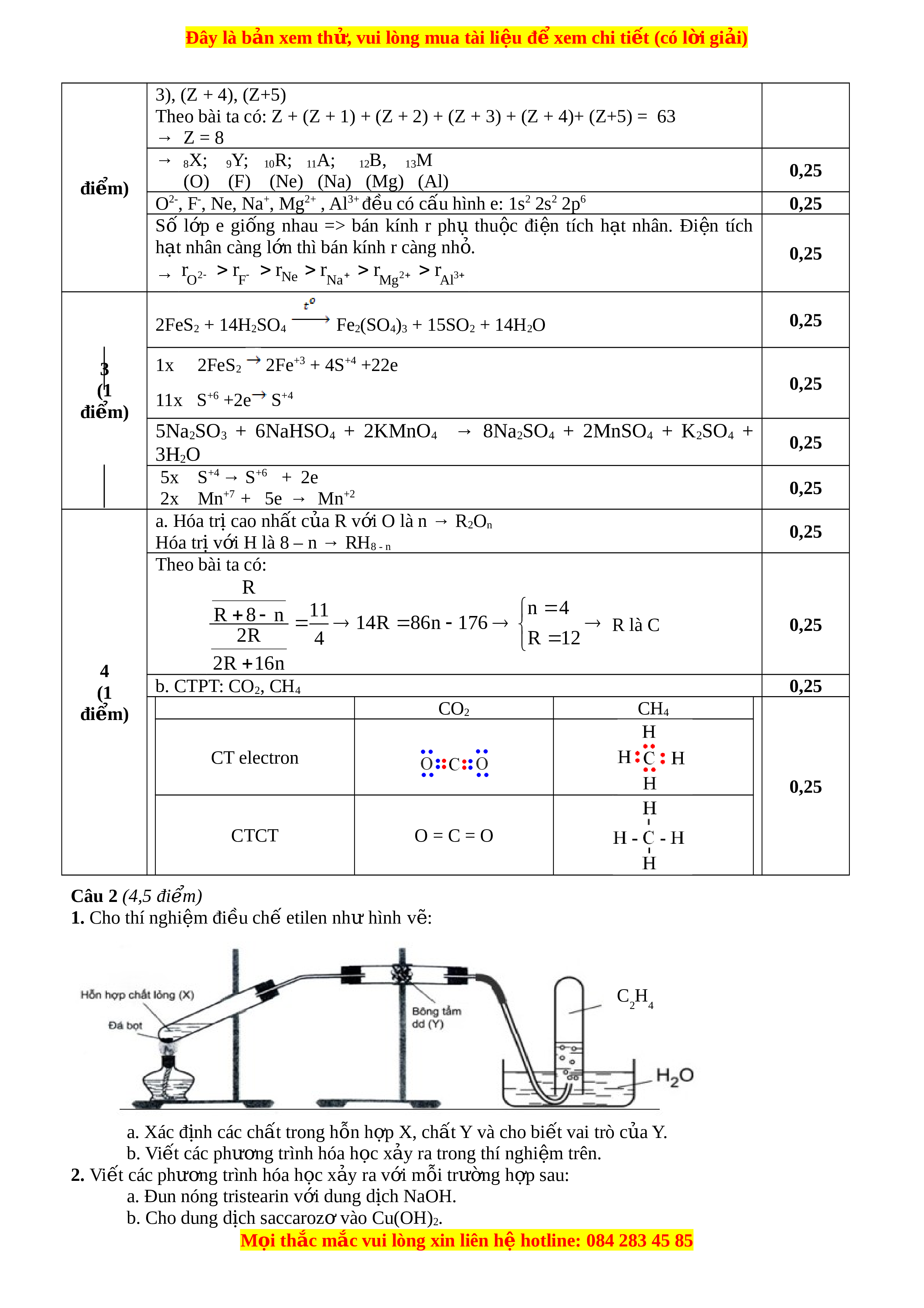
nhất) là a%, còn trong oxit cao nhất là b%. a. Xác đ nh ị R bi t ế a : b = 11 : 4. b. Vi t ế công th c ứ phân t , ử công th c ứ electron, công th c ứ c u ấ t o ạ c a ủ hai h p ợ ch t ấ trên. Câu 2 (4,5 điểm) 1. Cho thí nghi m ệ đi u c ề hế etilen như hình vẽ: C H 2 4 a. Xác đ nh ị các chất trong h n h ỗ p X ợ , chất Y và cho bi t ế vai trò c a ủ Y. b. Viết các phư ng ơ trình hóa h c ọ x y ra ả trong thí nghi m ệ trên. 2. Viết các phư ng ơ trình hóa h c ọ x y ra ả v i ớ m i ỗ trư ng ờ h p s ợ au: a. Đun nóng tristearin v i ớ dung d c ị h NaOH b. Cho dung d c ị h saccarozơ vào Cu(OH)2 c. Cho nư c ớ Br2 vào dung d c ị h anilin d. Đi u c ề
hế poli(hexametylen - ađipamit) từ monome tư ng ơ ng. ứ 3. M t
ộ loại cao su buna - S có ch a ứ 10,28% hiđro v ề kh i ố lư ng. ợ Tính t ỉl ệ m t ắ xích butađien và stiren
trong loại cao su buna - S trên.
4. Hoàn thành các phư ng ơ trình hóa h c ọ theo s ơ đ ồ ph n ả ng ứ sau, bi t ế dung d c ị h bão hòa c a ủ X3 dùng để ngâm xác đ ng v ộ
ật và X6 là este có mùi hoa nhài. CH (3) (4) (5) 3COOCH=CH2 (1) X1 (2)
X2 X3 X4 X5 (6) X6 Câu 3 (4,0 điểm) 1. Nêu hi n t ệ ư ng ợ và vi t ế các phư ng ơ trình hóa h c ọ x y ra ả trong các thí nghi m ệ sau: a. Cho dung d c
ị h đạm urê vào dung d c ị h nư c ớ vôi trong (d ) ư b. Cho dung d c ị h BaCl2 vào dung d c ị h KHSO4 M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) c. Cho dung d c ị h Fe(NO3)2 vào dung d c ị h HCl loãng
d. Dẫn khí SO2 vào dung d c ị h KMnO4. 2. Sắp x p ế các chất sau theo chi u ề gi m ả d n
ầ tính axit: axit cacbonic, axit axetic, nư c ớ , phenol. Ch ng ứ minh bằng phản ng hóa ứ h c ọ .
3. Cho 3 hợp chất h u
ữ cơ mạch hở X, Y, Z. Trong đó X và Y có cùng công th c ứ phân tử C5H6O; Z có công th c ứ phân t ử C4H2O2. Biết rằng:
- Cứ 1,0 mol X hoặc Y tác d ng ụ vừa đủ v i
ớ 3,0 mol AgNO3 trong dung dịch NH3 - V i ớ 1,0 mol Z tác d n ụ g vừa đủ v i
ớ 4,0 mol AgNO3 trong dung dịch NH3
Tìm công thức cấu tạo thu g n
ọ của X, Y, Z và viết các phư ng t ơ rình hoá h c ọ xảy ra. 4. Dung d c ị h X g m
ồ a mol H+; b mol Mg2+; 0,24 mol NO - 2-
3 và 0,04 mol SO4 . Cho 200 ml dung d c ị h Y g m
ồ KOH 1,16M và Ba(OH)2 0,12M vào dung d c ị h X, sau khi các ph n ả ng ứ k t ế thúc, thu đư c ợ 7,912 gam kết t a ủ . Tính giá trị c a ủ a và b. Câu 4 (4,0 điểm)
1. Nêu và giải thích hi n ệ tư ng qua ợ n sát đư c ợ c a ủ hai thí nghi m ệ sau: - Thí nghi m ệ 1: Cho vào ng ố nghi m ệ 2 ml dung d c ị h nư c ớ ép quả chu i ố xanh, thêm vài gi t ọ dung d c ị h iot 0,05%, lắc nh . Đ ẹ un nóng dung d c ị h r i ồ đ ngu ể i ộ . - Thí nghi m ệ 2: Cho 1 ml dung d c ị h AgNO3 1% vào ng ố nghi m ệ s c ạ h, l c ắ nh , s ẹ au đó nh ỏ t t ừ ừ t ng ừ gi t ọ NH3 2M cho đ n ế khi k t ế t a ủ sinh ra bị hòa tan h t ế . Dung d c ị h thu đư c ợ g i ọ là thu c ố thử Tollens. Nhỏ ti p ế 3 - 5 gi t ọ dung d c ị h nư c ớ ép quả chu i
ố chín sau đó đun nóng nh ẹ h n ỗ h p ợ trong vài phút.
2. Trong công nghiệp, giấm ăn đư c ợ sản xuất b ng ph ằ ư ng ơ pháp lên men theo s đ ơ s ồ au: 1 H 60% H2 50% H3 5 0% (C6 1 H 0 5 O )n 6 C 1 H 2 6
O C2H5OH CH3COOH Từ 1 tấn g o ạ (ch a ứ 80% tinh b t ộ , còn l i ạ là t p ạ ch t ấ tr ) ơ s n ả xu t ấ đư c ợ V m3 giấm ăn (ch a ứ 5% CH3COOH). a. Viết các phư ng t ơ rình hóa h c ọ xảy ra. b. Tính V (coi kh i ố lư ng ợ riêng c a ủ gi m ấ không khác kh i ố lư ng ri ợ êng c a ủ nư c ớ ). 3. Cho m gam h n ỗ h p ợ kim lo i ạ Ba, Na (đư c ợ tr n ộ theo t ỉl ệ s ố mol 1:1) vào nư c ớ đư c ợ 3,36 lít H2 (ở đktc) và dung d c
ị h X. Cho CO2 hấp thụ t t ừ ừ vào dung d c ị h X. a. Viết các phư ng t ơ rình hoá h c ọ xảy ra. b. V đ
ẽ ồ thị biểu diễn s ph ự t ụ hu c ộ c a ủ s m ố ol k t ế t a ủ theo s m ố ol CO2 đư c ợ hấp th . ụ
4. Hòa tan hoàn toàn 25 gam m t ộ cacbonat kim lo i ạ b ng ằ dung d c ị h HCl 7,3% (v a ừ đ ) ủ thu đư c ợ dung d c ị h mu i ố 10,511%. Khi làm l nh ạ dung d c ị h này th y ấ thoát ra 26,28 gam mu i ố r n ắ A và n ng ồ đ ộ ph n ầ trăm c a ủ mu i ố trong dung d c
ị h còn lại là 6,07%. Xác đ nh c ị ông th c ứ c a ủ mu i ố A? Câu 5 (3,5 điểm) 1. H n ỗ h p ợ E g m ồ ch t ấ X (CnH2n+4O4N2, là mu i ố c a ủ axit cacboxylic hai ch c ứ ) và ch t ấ Y (CmH2m+3O2N, là mu i ố c a ủ axit cacboxylic đ n ơ ch c ứ ). Đ t
ố cháy hoàn toàn 10,56 gam E c n ầ v a ừ đ ủ 5,376 lít O2 (đktc) thu đư c
ợ N2, H2O và 0,2 mol CO2. Mặt khác, cho 0,09 mol E tác d ng ụ h t ế v i ớ dung d c ị h NaOH thu đư c ợ h n ỗ h p ợ Z g m ồ hai khí đ u ề làm xanh quỳ tím m ẩ . Cô c n ạ dung d c ị h sau ph n ả ng ứ thu đư c ợ m gam h n ỗ h p m ợ u i ố khan. a. Tính m. b. H n h ỗ p khí ợ Z nặng hay nh h ẹ n không khí ơ bao nhiêu lần? 2. Cho 9,072 gam ch t ấ r n ắ X g m
ồ Mg, MgCO3 và Mg(NO3)2 (trong đó nguyên tố oxi chi m ế 28,57% về kh i ố lư ng ợ h n ỗ h p) ợ vào dung d c ị h ch a
ứ 2,268 gam HNO3 và 66,912 gam KHSO4, khuấy đ u ề cho các phản ng
ứ xảy ra hoàn toàn, thu đư c ợ dung d c ị h Y chỉ ch a ứ các mu i ố trung hòa có kh i ố lư ng ợ 72,396 gam và V lít h n ỗ h p ợ khí Z (ở đktc) g m
ồ N2O, N2, CO2 và H2 (trong đó số mol c a ủ N2O bằng số mol c a ủ CO2). Tính giá tr c ị a ủ V. 3. Đ t
ố cháy hoàn toàn 30,8 gam h n h ỗ p ợ E g m ồ este đ n c ơ h c ứ X và hai este no, m c ạ h h ở Y, Z (MX > MY > MZ) cần v a
ừ đủ 1,84 mol O2, thu đư c
ợ 20,16 gam H2O. Mặt khác 30,8 gam E tác d ng ụ v a ừ đủ v i ớ NaOH, thu đư c ợ 7,4 gam hai ancol cùng s ố nguyên t ử cacbon, cô c n ạ dung d c ị h sau ph n ả ng ứ thu đư c ợ h n ỗ h p ợ T g m ồ 2 mu i ố khan. Đ t
ố cháy hoàn toàn T thu đư c ợ H2O cùng v i ớ 21,2 gam Na2CO3 và 1,1 M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) mol CO2. Xác đ nh ị công th c ứ c u ấ t o ạ c a ủ X, Y, Z và tính ph n ầ trăm kh i ố lư ng ợ c a ủ m i ỗ ch t ấ trong h n h ỗ p ợ E.
Cho: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; S = 32; K = 39; Ca = 40; Ag = 108; Ba = 137.
---------------------------- HẾT --------------------------- - Thí sinh không đư c ợ s d ử ng t ụ ài li u; ệ -
Giám thị không giải thích gì thêm. H và ọ
tên thí sinh: .............................................................. S bá ố
o danh: .................................................. Ch k ữ í c a G ủ
iám thị 1: .............................................Chữ kí c a
ủ Giám thị 2: ............................................. SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ HƯ N Ớ G D N Ẫ CH M Ấ THI CH N Ọ H C Ọ SINH GI I Ỏ T N Ỉ H QU N Ả G NINH C P Ấ T N Ỉ H THPT NĂM 2022 Môn thi: HÓA H C Ọ – Bảng A Ngày thi: 02/12/2022 ĐỀ THI CHÍNH TH C Ứ Th i
ờ gian làm bài: 180 phút, không kể th i ờ gian giao đề (Hư ng
ớ dẫn này có 08 trang) I. HƯỚNG D N Ẫ CHUNG
1. Giám khảo chấm đúng theo hư ng d ớ ẫn c a ủ S G ở iáo d c ụ và Đào t o. ạ 2. N u
ế thí sinh có cách trả l i ờ khác đáp án nh ng ư đúng thì giám kh o ả v n ẫ ch m ấ theo bi u ể đi m ể c a ủ Hư ng d ớ ẫn chấm thi.
3. Giám khảo không quy tròn điểm thành phần c a ủ t ng c ừ âu, đi m ể c a ủ bài thi. II. ĐÁP ÁN, BI U Ể ĐI M Ể Câu 1 (4,0 điểm)
1. Nguyên tử X có c u ấ hình electron l p
ớ ngoài cùng là 3sx, nguyên tử Y có c u ấ hình electron phân l p ớ ngoài cùng là 3py. T ng ổ số electron l p ớ ngoài cùng c a
ủ 2 nguyên tử X và Y b ng ằ 7. Vi t ế c u ấ hình electron c a
ủ nguyên tử X, Y và xác đ nh v ị ị trí c a ủ X, Y trong b ng t ả u n hoà ầ n.
2. X, Y, R, A, B, M theo thứ tự là 6 nguyên tố liên ti p ế trong b ng ả tu n ầ hoàn có t ng ổ s ố đ n ơ v ịđi n ệ
tích hạt nhân là 63 (X có s đ ố n ơ v đi ị n t ệ ích h t ạ nhân nh nh ỏ t ấ ). a. Xác đ nh ị s đ ố n v ơ đi ị n ệ tích hạt nhân c a ủ X, Y, R, A, B, M.
b. Viết cấu hình electron c a
ủ X2−, Y−, R, A+, B2+, M3+. So sánh bán kính c a ủ chúng và gi i ả thích.
3. Cân bằng các phản ng s ứ au bằng phư ng phá ơ p thăng bằng electron: a. FeS2 + H2SO4 Fe2(SO4)3 + SO2 + H2O b. Na2SO3 + KMnO4 + NaHSO4 Na2SO4 + MnSO4 + K2SO4 + H2O 4. Phần trăm kh i ố lư ng ợ c a ủ nguyên tố R trong h p ợ ch t ấ khí v i
ớ hiđro (trong đó R có s ố oxi hóa th p ấ
nhất) là a%, còn trong oxit cao nhất là b%. a. Xác đ nh ị R bi t ế a : b = 11 : 4. b. Vi t ế công th c ứ phân t , ử công th c ứ electron, công th c ứ c u ấ t o ạ c a ủ hai h p ợ ch t ấ trên. Câu S l ơ ư c ợ lời giải/M t ộ s g ố i ợ ý chính Đi m ể Theo gi ả thi t
ế : x + 2 + y = 7 → x + y = 5 + TH1: x = 1 → y = 4 1 X: 1s22s22p63s1 → X: thu c ộ chu kỳ 3, nhóm IA. 0,25 (1
Y: 1s22s22p63s23p4 → Y: thu c ộ chu kỳ 3, nhóm VIA 0,25 đi m) ể + TH2: x = 2 → y =3 X: 1s22s22p63s2 → X: thu c
ộ chu kỳ 3, nhóm IIA. 0,25
Y: 1s22s22p63s23p3 → Y: thu c
ộ chu kỳ 3, nhóm VA 0,25 2 G i ọ Z là số đi n t ệ ích hạt nhân c a ủ X 0,25 (1 → Số đi n ệ tích h t ạ nhân c a ủ Y, R, A, B, M l n ầ lư t
ợ là: (Z + 1), (Z + 2), (Z + M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) 3), (Z + 4), (Z+5)
Theo bài ta có: Z + (Z + 1) + (Z + 2) + (Z + 3) + (Z + 4)+ (Z+5) = 63 → Z = 8 → 8X; 9Y; 10R; 11A; 12B, 13M 0,25 đi m) ể (O) (F) (Ne) (Na) (Mg) (Al)
O2-, F-, Ne, Na+, Mg2+ , Al3+ đều có cấu hình e: 1s2 2s2 2p6 0,25 Số l p ớ e gi ng
ố nhau => bán kính r phụ thu c ộ đi n ệ tích h t ạ nhân. Đi n ệ tích hạt nhân càng l n
ớ thì bán kính r càng nh . ỏ 0,25 → r 2 r r r r 2 r 3 Ne O F Na Mg Al 2FeS2 + 14H2SO4 Fe2(SO4)3 + 15SO2 + 14H2O 0,25 3 1x 2FeS2 2Fe+3 + 4S+4 +22e (1 0,25 11x S+6 +2e S+4 đi m) ể
5Na2SO3 + 6NaHSO4 + 2KMnO4 → 8Na2SO4 + 2MnSO4 + K2SO4 + 0,25 3H2O 5x S+4 → S+6 + 2e 0,25 2x Mn+7 + 5e → Mn+2 a. Hóa trị cao nhất c a ủ R v i ớ O là n → R2On 0,25 Hóa trị v i ớ H là 8 – n → RH8 - n Theo bài ta có: R 11 n 4 R 8 n 14R 86 n 176 2R R là C 0,25 4 R 12 4 2R 16n (1 b. CTPT: CO2, CH4 0,25 đi m) ể CO2 CH4 CT electron 0,25 CTCT O = C = O Câu 2 (4,5 điểm) 1. Cho thí nghi m ệ đi u c ề hế etilen như hình vẽ: C H 2 4 a. Xác đ nh ị các chất trong h n h ỗ p X ợ , chất Y và cho bi t ế vai trò c a ủ Y. b. Viết các phư ng ơ trình hóa h c ọ x y ra ả trong thí nghi m ệ trên. 2. Viết các phư ng ơ trình hóa h c ọ x y ra ả v i ớ m i ỗ trư ng ờ h p s ợ au: a. Đun nóng tristearin v i ớ dung d c ị h NaOH. b. Cho dung d c ị h saccarozơ vào Cu(OH)2. M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Quảng Ninh năm 2023 có đáp án
2.4 K
1.2 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1053587071- NGUYEN VAN DOAN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Quảng Ninh năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(2437 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
T NH QU NG NINHỈ Ả
Đ THI CHÍNH TH CỀ Ứ
KỲ THI CH N H C SINH GI I C P T NH THPT NĂM 2022Ọ Ọ Ỏ Ấ Ỉ
Môn thi: HÓA H C -Ọ B ng ả A
Ngày thi: 02/12/2022
Th i gian làm bài: ờ 180 phút, không k th i gian giao để ờ ề
(Đ thi này có 02 trang)ề
Câu 1 (4,0 đi m)ể
1. Nguyên t X có c u hình electron l p ngoài cùng là 3sử ấ ớ
x
, nguyên t Y có c u hình electron phân l pử ấ ớ
ngoài cùng là 3p
y
. T ng s electron l p ngoài cùng c a hai nguyên t X và Y b ng 7. Vi t c u hìnhổ ố ớ ủ ử ằ ế ấ
electron c a nguyên t X, Y và xác đ nh v trí c a chúng trong b ng tu n hoàn.ủ ử ị ị ủ ả ầ
2. X, Y, R, A, B, M theo th t là sáu nguyên t liên ti p trong b ng tu n hoàn có t ng s đ n v đi nứ ự ố ế ả ầ ổ ố ơ ị ệ
tích h t nhân là 63 (X có s đ n v đi n tích h t nhân nh nh t).ạ ố ơ ị ệ ạ ỏ ấ
a. Xác đ nh s đ n v đi n tích h t nhân c a X, Y, R, A, B, M.ị ố ơ ị ệ ạ ủ
b. Vi t c u hình electron c a Xế ấ ủ
2−
, Y
−
, R, A
+
, B
2+
, M
3+
. So sánh bán kính c a chúng và gi i thích.ủ ả
3. Cân b ng ph ng trình hóa h c c a các ph n ng oxi hóa - kh sau b ng ph ng pháp thăng b ngằ ươ ọ ủ ả ứ ử ằ ươ ằ
electron:
a. FeS
2
+ H
2
SO
4
Fe
2
(SO
4
)
3
+ SO
2
+ H
2
O
b. Na
2
SO
3
+ KMnO
4
+ NaHSO
4
Na
2
SO
4
+ MnSO
4
+ K
2
SO
4
+ H
2
O
4. Ph n trăm kh i l ng c a nguyên t R trong h p ch t khí v i hiđro (trong đó R có s oxi hóa th pầ ố ượ ủ ố ợ ấ ớ ố ấ
nh t) là a%, còn trong oxit cao nh t làấ ấ b%.
a. Xác đ nh R bi tị ế a : b = 11 : 4.
b. Vi tế công th cứ phân t ,ử công th cứ electron, công th cứ c uấ t oạ c aủ hai h pợ ch tấ trên.
Câu 2 (4,5 đi m)ể
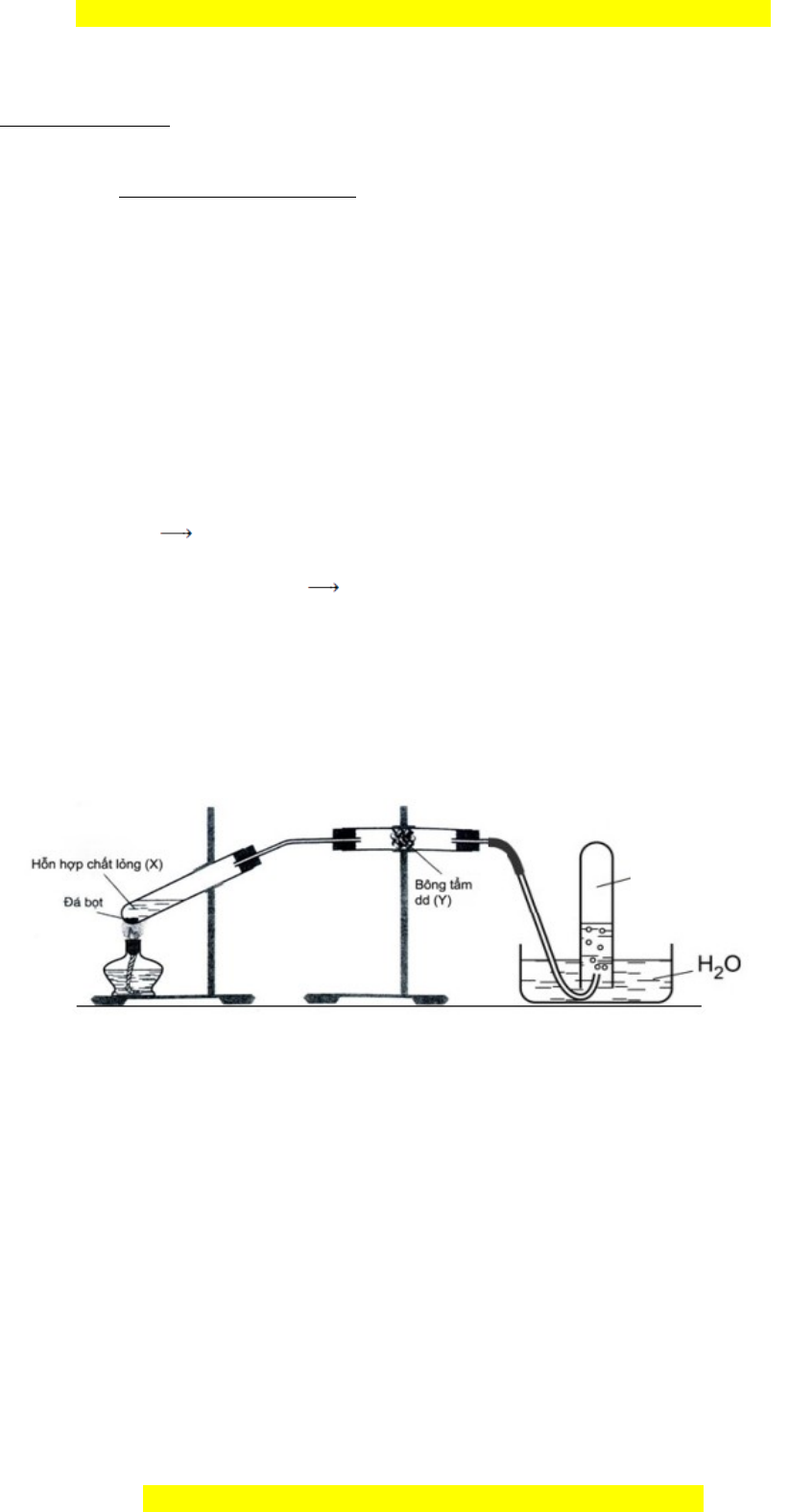
1. Cho thí nghi m đi u ch etilen nhệ ề ế ư hình vẽ:
a. Xác đ nh các ch t trong h n h p X, ch t Y và cho bi t vai trò c a Y.ị ấ ỗ ợ ấ ế ủ
b. Vi t các ph ng trình hóa h c x y ra trong thí nghi m trên. ế ươ ọ ả ệ
2. Vi t các ph ng trình hóa h c x y ra v i m i tr ng h p sau:ế ươ ọ ả ớ ỗ ườ ợ
a. Đun nóng tristearin v i dung d ch NaOHớ ị
b. Cho dung d ch saccaroz vào Cu(OH)ị ơ
2
c. Cho n c Brướ
2
vào dung d ch anilinị
d. Đi u ch poli(hexametylen - ađipamit) t monome t ng ng.ề ế ừ ươ ứ
3. M t lo i cao su buna - S có ch a 10,28% hiđro v kh i l ng. Tính t l m t xích butađien và stirenộ ạ ứ ề ố ượ ỉ ệ ắ
trong lo i cao su buna - S trên.ạ
4. Hoàn thành các ph ng trình hóa h c theo s đ ph n ng sau, bi t dung d ch bão hòa c a Xươ ọ ơ ồ ả ứ ế ị ủ
3
dùng
đ ngâm xác đ ng v t và Xể ộ ậ
6
là este có mùi hoa nhài.
CH
3
COOCH=CH
2
(1)
X
1
(2)
X
2
(3)
X
3
(4)
X
4
(5)
X
5
(6)
X
6
Câu 3 (4,0 đi m)ể
1. Nêu hi n t ng và vi t các ph ng trình hóa h c x y ra trong các thí nghi m sau: ệ ượ ế ươ ọ ả ệ
a. Cho dung d ch đ m urê vào dung d ch n c vôi trong (d )ị ạ ị ướ ư
b. Cho dung d ch BaClị
2
vào dung d ch KHSOị
4
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
C
2
H
4

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
c. Cho dung d ch Fe(NOị
3
)
2
vào dung d ch HCl loãngị
d. D n khí SOẫ
2
vào dung d ch KMnOị
4
.
2. S p x p các ch t sau theo chi u gi m d n tính axit: axit cacbonic, axit axetic, n c, phenol. Ch ngắ ế ấ ề ả ầ ướ ứ
minh b ng ph n ng hóa h c.ằ ả ứ ọ
3. Cho 3 h p ợ chất h uữ c m ch hơ ạ ở X, Y, Z. Trong đó X và Y có cùng công th c phân t Cứ ử
5
H
6
O; Z có
công th c phân t Cứ ử
4
H
2
O
2
. Bi tế r ng:ằ
- C ứ 1,0 mol X hoặc Y tác d ngụ vừa đ ủ v iớ 3,0 mol AgNO
3
trong dung dịch NH
3
- V i 1ớ ,0 mol Z tác d ngụ vừa đ ủ v iớ 4,0 mol AgNO
3
trong dung dịch NH
3
Tìm công th c ứ c u t o thu g nấ ạ ọ của X, Y, Z và viết các ph ng trình hoá h c ươ ọ xảy ra.
4. Dung d ch X g m ị ồ a mol H
+
; b mol Mg
2+
; 0,24 mol NO
3
-
và 0,04 mol SO
4
2-
. Cho 200 ml dung d ch Yị
g m KOH 1,16M và Ba(OH)ồ
2
0,12M vào dung d ch X, sau khi các ph n ng k t thúc, thu đ c 7,912ị ả ứ ế ượ
gam k t t a. Tính giá tr c a a và b. ế ủ ị ủ
Câu 4 (4,0 đi m)ể
1. Nêu và gi i thíchả hi n t ng quan sát đ c c a hai thí nghi m sauệ ượ ượ ủ ệ :
- Thí nghi m 1: Cho vào ng nghi m 2 ml dung d ch n c ép qu chu i xanh, thêm vài gi tệ ố ệ ị ướ ả ố ọ
dung d ch iot 0,05%, l c nh . Đun nóng dung d ch r i đ ngu i.ị ắ ẹ ị ồ ể ộ
- Thí nghi m 2: Cho 1 ml dung d ch AgNOệ ị
3
1% vào ng nghi m s ch, l c nh , sau đó nh t tố ệ ạ ắ ẹ ỏ ừ ừ
t ng gi t NHừ ọ
3
2M cho đ n khi k t t a sinh ra b hòa tan h t. Dung d ch thu đ c g i là thu c thế ế ủ ị ế ị ượ ọ ố ử
Tollens. Nh ti p 3 ỏ ế - 5 gi t dung d ch n c ép qu chu i chín sau đó đun nóng nh h n h p trong vàiọ ị ướ ả ố ẹ ỗ ợ
phút.
2. Trong công nghi p, gi m ăn đ c s n xu t b ng ph ng pháp lên men theo s đ sau:ệ ấ ượ ả ấ ằ ươ ơ ồ
3
1 2
H 50%H 60% H 50%
6 10 5 n 6 12 6 2 5 3
(C H O ) C H O C H OH CH COOH
T 1 t n g o (ch a 80% tinh b t, còn l i là t p ch t tr ) s n xu t đ c V mừ ấ ạ ứ ộ ạ ạ ấ ơ ả ấ ượ
3
gi m ăn (ch a 5%ấ ứ
CH
3
COOH).
a. Vi t các ph ng trình hóa h c x y ra.ế ươ ọ ả
b. Tính V (coi kh i l ng riêng c a gi m không khác kh i l ng riêng c a n c).ố ượ ủ ấ ố ượ ủ ướ
3. Cho m gam h n h p kim lo i Ba, Na (đ c tr n theo t l s mol 1:1) vào n c đ c 3,36 lít Hỗ ợ ạ ượ ộ ỉ ệ ố ướ ượ
2
(ở
đktc) và dung d ch X. Cho COị
2
h p th t t vào dung d ch X. ấ ụ ừ ừ ị
a. Vi t các ph ng trình hoá h c x y ra.ế ươ ọ ả
b. V đ th bi u di n s ph thu c c a s mol k t t a theo s mol COẽ ồ ị ể ễ ự ụ ộ ủ ố ế ủ ố
2
đ c h p th .ượ ấ ụ
4. Hòa tan hoàn toàn 25 gam m t cacbonat kim lo i b ng dung d ch HCl 7,3% (v a đ ) thu đ c dungộ ạ ằ ị ừ ủ ượ
d ch mu i 10,511%. Khi làm l nh dung d ch này th y thoát ra 26,28 gam mu i r n A và n ng đ ph nị ố ạ ị ấ ố ắ ồ ộ ầ
trăm c a mu i trong dung d ch còn l i là 6,07%. Xác đ nh công th c c a mu i A?ủ ố ị ạ ị ứ ủ ố
Câu 5 (3,5 đi m)ể
1. H n h p E g m ch t X (Cỗ ợ ồ ấ
n
H
2n+4
O
4
N
2
, là mu i c a axit cacboxylic hai ch c) và ch t Y (Cố ủ ứ ấ
m
H
2m+3
O
2
N,
là mu i c a axit cacboxylic đ n ch c). Đ t cháy hoàn toàn 10,56 gam E c n v a đ 5,ố ủ ơ ứ ố ầ ừ ủ 376 lít O
2
(đktc)
thu đ c Nượ
2
, H
2
O và 0,2 mol CO
2
. M t khác, cho 0,09 mol E tác d ng h t v i dung d ch NaOH thuặ ụ ế ớ ị
đ c h n h p Z g m hai khí đ u làm xanh quỳ tím m. Cô c n dung d ch sau ph n ng thu đ c mượ ỗ ợ ồ ề ẩ ạ ị ả ứ ượ
gam h n h p mu i khan. ỗ ợ ố
a. Tính m.
b. H n h p khí Z n ng hay nh h n không khí bao nhiêu l n?ỗ ợ ặ ẹ ơ ầ
2. Cho 9,072 gam ch t r n X g m Mg, MgCOấ ắ ồ
3
và Mg(NO
3
)
2
(trong đó nguyên t oxi chi m 28,57% vố ế ề
kh i l ng h n h p) vào dung d ch ch a 2,268 gam HNOố ượ ỗ ợ ị ứ
3
và 66,912 gam KHSO
4
, khu y đ u cho cácấ ề
ph n ng x y ra hoàn toàn, thu đ c dung d ch Y ch ch a các mu i trung hòa có kh i l ng 72,396ả ứ ả ượ ị ỉ ứ ố ố ượ
gam và V lít h n h p khí Zỗ ợ ( đktc)ở g m Nồ
2
O, N
2
, CO
2
và H
2
(trong đó s mol c a Nố ủ
2
O b ng s molằ ố
c a COủ
2
). Tính giá tr c a V.ị ủ
3. Đ t cháy hoàn toàn ố 30,8 gam h n h p ỗ ợ E g m este đ n ch c X và hai este no, m ch h Y, Z (Mồ ơ ứ ạ ở
X
> M
Y
> M
Z
) c n v a đ 1,8ầ ừ ủ 4 mol O
2
, thu đ c ượ 20,16 gam H
2
O. M t khác ặ 30,8 gam E tác d ng v a đ v iụ ừ ủ ớ
NaOH, thu đ c ượ 7,4 gam hai ancol cùng s nguyên t cacbon, cô c n dung d ch sau ph n ng thu đ cố ử ạ ị ả ứ ượ
h n h p T g m 2 mu i khan. Đ t cháy hoàn toàn T thu đ cỗ ợ ồ ố ố ượ H
2
O cùng v i ớ 21,2 gam Na
2
CO
3
và 1,1
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
mol CO
2
. Xác đ nh công th c c u t o c a X, Y, Z và tính ph n trăm kh i l ng c a m i ch t trongị ứ ấ ạ ủ ầ ố ượ ủ ỗ ấ
h n h p ỗ ợ E.
Cho: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; S = 32; K = 39; Ca = 40; Ag = 108; Ba = 137.
---------------------------- H TẾ ---------------------------
- Thí sinh không đ c s d ng tài li u;ượ ử ụ ệ
- Giám th không gi i thích gì thêm.ị ả
H và tên thí sinh: .............................................................. S báo danh: ..................................................ọ ố
Ch kí c a Giám th 1ữ ủ ị : .............................................Ch kí c a Giám th 2ữ ủ ị : .............................................
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
T NH QU NG NINHỈ Ả
Đ THI CHÍNH TH CỀ Ứ
H NG D N CH M THI CH N H C SINH GI I ƯỚ Ẫ Ấ Ọ Ọ Ỏ
C P T NH THPT NĂM 2022Ấ Ỉ
Môn thi: HÓA H C Ọ – B ng ả A
Ngày thi: 02/12/2022
Th i gian làm bài: ờ 180 phút, không k th i gian giao để ờ ề
(H ng d n này có 08 trang)ướ ẫ
I. H NG D N CHUNGƯỚ Ẫ
1. Giám kh o ch m đúng theo h ng d n c a S Giáo d c và Đào t o.ả ấ ướ ẫ ủ ở ụ ạ
2. N u thí sinh có cách tr l i khác đáp án nh ng đúng thì giám kh o v n ch m theo bi u đi m c aế ả ờ ư ả ẫ ấ ể ể ủ
H ng d n ch m thi.ướ ẫ ấ
3. Giám kh o không quy tròn đi m thành ph n c a t ng câu, đi m c a bài thi.ả ể ầ ủ ừ ể ủ
II. ĐÁP ÁN, BI U ĐI MỂ Ể
Câu 1 (4,0 đi m)ể
1. Nguyên t X có c u hình electron l p ngoài cùng là 3sử ấ ớ
x
, nguyên t Y có c u hình electron phân l pử ấ ớ
ngoài cùng là 3p
y
. T ng s electron l p ngoài cùng c a 2 nguyên t X và Y b ng 7. Vi t c u hìnhổ ố ớ ủ ử ằ ế ấ
electron c a nguyên t X, Y và xác đ nh v trí c a X, Y trong b ng tu n hoàn.ủ ử ị ị ủ ả ầ
2. X, Y, R, A, B, M theo th t là 6 nguyên t liên ti p trong b ng tu n hoàn có t ng s đ n v đi nứ ự ố ế ả ầ ổ ố ơ ị ệ
tích h t nhân là 63 (X có s đ n v đi n tích h t nhân nh nh t).ạ ố ơ ị ệ ạ ỏ ấ
a. Xác đ nh s đ n v đi n tích h t nhân c a X, Y, R, A, B, M.ị ố ơ ị ệ ạ ủ
b. Vi t c u hình electron c a Xế ấ ủ
2−
, Y
−
, R, A
+
, B
2+
, M
3+
. So sánh bán kính c a chúng và gi i thích.ủ ả
3. Cân b ng các ph n ng sau b ng ph ng pháp thăng b ng electron:ằ ả ứ ằ ươ ằ
a. FeS
2
+ H
2
SO
4
Fe
2
(SO
4
)
3
+ SO
2
+ H
2
O
b. Na
2
SO
3
+ KMnO
4
+ NaHSO
4
Na
2
SO
4
+ MnSO
4
+ K
2
SO
4
+ H
2
O
4. Ph n trăm kh i l ng c a nguyên t R trong h p ch t khí v i hiđro (trong đó R có s oxi hóa th pầ ố ượ ủ ố ợ ấ ớ ố ấ
nh t) là a%, còn trong oxit cao nh t làấ ấ b%.
a. Xác đ nh R bi tị ế a : b = 11 : 4.
b. Vi tế công th cứ phân t ,ử công th cứ electron, công th cứ c uấ t oạ c aủ hai h pợ ch tấ trên.
Câu S l c l i gi i/M t s g i ý chínhơ ượ ờ ả ộ ố ợ Đi mể
1
(1
đi m)ể
Theo gi thi t: x + 2 + y = 7 → x + y = 5ả ế
+ TH1: x = 1 → y = 4
X: 1s
2
2s
2
2p
6
3s
1
→ X: thu c chu kỳ 3, nhóm IA.ộ
Y: 1s
2
2s
2
2p
6
3s
2
3p
4
→ Y: thu c chu kỳ 3, nhóm VIAộ
0,25
0,25
+ TH2: x = 2 → y =3
X: 1s
2
2s
2
2p
6
3s
2
→ X: thu c chu kỳ 3, nhóm IIA.ộ
Y: 1s
2
2s
2
2p
6
3s
2
3p
3
→ Y: thu c chu kỳ 3, nhóm VAộ
0,25
0,25
2
(1
G i Z là s đi n tích h t nhân c a Xọ ố ệ ạ ủ
→ S đi n tích h t nhân c a Y, R, A, B, M l n l t là: (Z + 1), (Z + 2), (Z +ố ệ ạ ủ ầ ượ
0,25
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
đi m)ể
3), (Z + 4), (Z+5)
Theo bài ta có: Z + (Z + 1) + (Z + 2) + (Z + 3) + (Z + 4)+ (Z+5) = 63
→ Z = 8
→
8
X;
9
Y;
10
R;
11
A;
12
B,
13
M
(O) (F) (Ne) (Na) (Mg) (Al)
0,25
O
2-
, F
-
, Ne, Na
+
, Mg
2+
, Al
3+
đ u có c u hình e: 1sề ấ
2
2s
2
2p
6
0,25
S l p e gi ng nhau => bán kính r ph thu c đi n tích h t nhân. Đi n tíchố ớ ố ụ ộ ệ ạ ệ
h t nhân càng l n thì bán kính r càng nh .ạ ớ ỏ
→
2 2 3
Ne
O F Na Mg Al
r r r r r r
0,25
3
(1
đi m)ể
2FeS
2
+ 14H
2
SO
4
Fe
2
(SO
4
)
3
+ 15SO
2
+ 14H
2
O
0,25
1x 2FeS
2
2Fe
+3
+ 4S
+4
+22e
11x S
+6
+2e S
+4
0,25
5Na
2
SO
3
+ 6NaHSO
4
+ 2KMnO
4
→ 8Na
2
SO
4
+ 2MnSO
4
+ K
2
SO
4
+
3H
2
O
0,25
5x S
+4
→ S
+6
+ 2e
2x Mn
+7
+ 5e
→ Mn
+2
0,25
4
(1
đi m)ể
a. Hóa tr cao nh t c a R v i O là n → Rị ấ ủ ớ
2
O
n
Hóa tr v i H là 8 – n → RHị ớ
8 - n
0,25
Theo bài ta có:
R
n 4
11
R 8 n
14R 86n 176
2R
R 12
4
2R 16n
R là C 0,25
b. CTPT: CO
2
, CH
4
0,25
CO
2
CH
4
CT electron
CTCT O = C = O
0,25
Câu 2 (4,5 đi m)ể
1. Cho thí nghi m đi u ch etilen nhệ ề ế ư hình vẽ:
a. Xác đ nh các ch t trong h n h p X, ch t Y và cho bi t vai trò c a Y.ị ấ ỗ ợ ấ ế ủ
b. Vi t các ph ng trình hóa h c x y ra trong thí nghi m trên. ế ươ ọ ả ệ
2. Vi t các ph ng trình hóa h c x y ra v i m i tr ng h p sau:ế ươ ọ ả ớ ỗ ườ ợ
a. Đun nóng tristearin v i dung d ch NaOH.ớ ị
b. Cho dung d ch saccaroz vào Cu(OH)ị ơ
2
.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
C
2
H
4
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
c. Cho n c Brướ
2
vào dung d ch anilin.ị
d. Đi u ch poli(hexametylen – ađipamit) t monome t ng ng.ề ế ừ ươ ứ
3. M t lo i cao su buna – S có ch a 10,28% hiđro v kh i l ng. Tính t l m t xích butađien và stirenộ ạ ứ ề ố ượ ỉ ệ ắ
trong lo i cao su buna – S trên.ạ
4. Hoàn thành các ph ng trình hóa h c theo s đ ph n ng sau, bi t dung d ch bão hòa c a Xươ ọ ơ ồ ả ứ ế ị ủ
3
dùng
đ ngâm xác đ ng v t và Xể ộ ậ
6
là este có mùi hoa nhài.
CH
3
COOCH=CH
2
(1)
X
1
(2)
X
2
(3)
X
3
(4)
X
4
(5)
X
5
(6)
X
6
Câu S l c l i gi i/M t s g i ý chínhơ ượ ờ ả ộ ố ợ Đi mể
1
(1
đi m)ể
a. H n h p X: Cỗ ợ
2
H
5
OH và H
2
SO
4
đ cặ 0,25
Y: dung d ch ki m (NaOH ho c Ca(OH)ị ề ặ
2
,…)
Vai trò c a Y: Gi l i SOủ ữ ạ
2
, CO
2
0,25
b. C
2
H
5
OH
2 4
o
H SO , t
®Æc
C
2
H
4
+ H
2
O 0,25
C
2
H
5
OH + 6H
2
SO
4 đ cặ
t
o
2CO
2
+ 6SO
2
+ 9H
2
O
SO
2
+ 2NaOH → Na
2
SO
3
+ H
2
O
CO
2
+ 2NaOH → Na
2
CO
3
+ H
2
O
0,25
2
(1
đi m)ể
a. (C
17
H
35
COO)
3
C
3
H
5
3NaOH
t
o
3C
17
H
35
COONa + C
3
H
5
(OH)
3
0,25
b. 2C
12
H
22
O
11
+ Cu(OH)
2
→ (C
12
H
21
O
11
)
2
Cu + 2H
2
O 0,25
c.
N H
2
N H
2
+ 3 B r
2
B r B r
B r
( T )
+ 3 H B r
H
2
O
0,25
d.
n H N - [CH ] -NH + n HOOC -[CH ]- COOH HN -[CH ] - NHOC- [CH ] - CO +2nH O
2 6
2 4
22
2
6 2 4
n
2
0,25
3
(1
đi m)ể
Công th c cao su có d ngứ ạ : (C
4
H
6
)
n
(C
8
H
8
)
m
0,5
H
6n 8m n
%m .100% 10,28% 6.
54n 104m m
0,5
4
(1,5
đi m)ể
CH
3
COOCH=CH
2
+ NaOH
t
o
CH
3
COONa + CH
3
CHO
(X
1
)
0,25
CH
3
COONa + NaOH
0
CaO, t
CH
4
+ Na
2
CO
3
(X
2
)
0,25
CH
4
+ O
2
0
Xóc t¸c, t
HCHO + H
2
O
(X
3
)
0,25
HCHO + H
2
o
t ,xt
CH
3
OH
(X
4
)
0,25
CH
3
OH + CO
o
t ,xt
CH
3
COOH
(X
5
)
0,25
CH
3
COOH + C
6
H
5
CH
2
OH
o
2 4
H SO ®Æc,t
CH
3
COOCH
2
C
6
H
5
+ H
2
O
(X
6
)
0,25
Câu 3 (4,0 đi m)ể
1. Nêu hi n t ng và vi t các ph ng trình hóa h c x y ra trong các thí nghi m sau: ệ ượ ế ươ ọ ả ệ
a. Cho dung d ch đ m urê vào dung d ch n c vôi trong (d ).ị ạ ị ướ ư
b. Cho dung d ch BaClị
2
vào dung d ch KHSOị
4
.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
t
o