ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 002
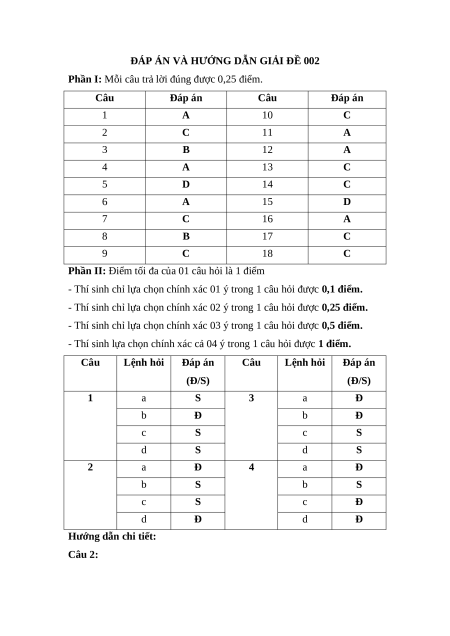
Phần I: Mỗi câu trả lời đúng được 0,25 điểm. Câu Đáp án Câu Đáp án 1 A 10 C 2 C 11 A 3 B 12 A 4 A 13 C 5 D 14 C 6 A 15 D 7 C 16 A 8 B 17 C 9 C 18 C
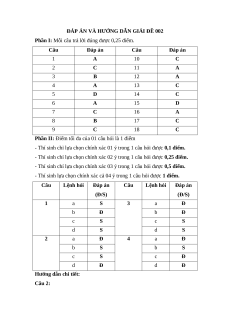
Phần II: Điểm tối đa của 01 câu hỏi là 1 điểm
- Thí sinh chỉ lựa chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm.
- Thí sinh chỉ lựa chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm.
- Thí sinh chỉ lựa chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm.
- Thí sinh lựa chọn chính xác cả 04 ý trong 1 câu hỏi được 1 điểm. Câu Lệnh hỏi Đáp án Câu Lệnh hỏi Đáp án (Đ/S) (Đ/S) 1 a S 3 a Đ b Đ b Đ c S c S d S d S 2 a Đ 4 a Đ b S b S c S c Đ d Đ d Đ
Hướng dẫn chi tiết: Câu 2:
> 0, phản ứng thuận là phản ứng thu nhiệt.
a. Đúng, vôi sống là CaO. Để thu được nhiều vôi sống hơn, cần phải làm
cân bằng chuyển dịch theo chiều thuận.
b. Sai vì tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu
nhiệt, tức chiều thuận.
c. Sai vì phản ứng thuận là phản ứng thu nhiệt. d. Đúng.
Phần III: Mỗi câu trả lời đúng được 0,25 điểm Câu Đáp án Câu Đáp án 1 (1) và (6) 4 Chất khử 2 pH tăng 5 4 chất 3 Tăng áp suất 6 19
Hướng dẫn chi tiết: Câu 1:
phản ứng thuận là phản ứng toả nhiệt.
(1) Tăng nhiệt độ: cân bằng chuyển dịch theo phản ứng thu nhiệt tức chiều nghịch.
(2) Tăng áp suất chung của hệ phản ứng: cân bằng chuyển dịch theo chiều
làm giảm số mol khí tức chiều thuận.
(3) Hạ nhiệt độ: cân bằng chuyển dịch theo chiều phản ứng toả nhiệt tức chiều thuận.
(4) Thêm chất xúc tác V2O5: không làm chuyển dịch cân bằng.
(5) Giảm nồng độ SO3: cân bằng chuyển dịch theo chiều làm tăng nồng độ SO3 tức chiều thuận.
(6) Giảm áp suất chung của hệ phản ứng: cân bằng chuyển dịch theo
chiều làm tăng số mol khí tức chiều nghịch.
Vậy các tác động (1) và (6) làm cân bằng chuyển dịch theo chiều nghịch. Câu 2: Phương trình thuỷ phân
được biểu diễn đơn giản như sau:
Quá trình thuỷ phân này sinh ra OH− làm tăng pH của dung dịch. Câu 3:
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí
tức chiều thuận (chiều làm tăng hiệu suất phản ứng).
Câu 5: Có 4 chất điện li mạnh: KNO3, HCl, Ba(OH)2, NaHCO3. Câu 6:
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
Tổng hệ số: 1 + 8 + 1 + 2 + 5 + 2 = 19 Sở GD - ĐT …
ĐỀ KIỂM TRA GIỮA HỌC KÌ I TRƯỜNG THPT … Năm học: …. Môn: Hóa học 11 Mã đề thi: 003 Bộ: Cánh diều
Thời gian làm bài: 50 phút;
(Đề theo cấu trúc MH2025)
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:.....................................................................
Lớp: ............................. Đề bài:
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời
từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Phản ứng nào sau đây là phản ứng thuận nghịch? A. . B. . C. . D. .
Câu 2: Trong phản ứng thuận nghịch, kết luận nào sao đây là đúng tại thời điểm ban đầu?
A. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
B. Nồng độ các chất trong hệ phản ứng không đổi.
C. Tốc độ phản ứng nghịch bằng 0 sau đó giảm dần.
D. Tốc độ phản ứng thuận đạt lớn nhất sau đó giảm dần.
Câu 3: Hằng số cân bằng của phản ứng N2O4 (g) ⇌ 2NO2 (g) là A. . B. .
Đề thi Hóa học 11 Giữa kì 1 Cánh diều Cấu trúc mới 2025 (Đề 3)
279
140 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ đề thi giữa kì 1 Cấu trúc mới 2025 có đầy đủ ma trận và lời giải chi tiết Hóa học 11 Cánh diều nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi Hóa 11.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(279 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)