SỞ GD&ĐT PHÚ YÊN
ĐỀ KIỂM TRA HỌC KÌ I MÔN: Hóa – Lớp 11
Thời gian làm bài: 45 phút; không kể thời gian phát đề I. TRẮC NGHIỆM
Câu 1 (NB): Muối nào sau đây là muối trung hòa? A. Na2HPO4 B. Na2SO3 C. KHCO3 D. NH4HSO4
Câu 2 (NB): Để nhận biết ion PO 3-
4 người ta thường dùng dung dịch AgNO3 vì sản phẩm có
A. khí không màu hóa nâu trong không khí
B. kết tủa màu vàng.
C. dung dịch màu vàng
D. khí màu nâu đỏ
Câu 3 (NB): Cho sơ đồ phản ứng sau :
. Công thức hóa học của chất Y là A. P2O5 B. PH3 C. P2O3 D. H3PO4
Câu 4 (NB): Phương trình ion thu gọn H+ + OH- → H2O biểu diễn bản chất của phản ứng hóa học nào sau đây ?
A. H2SO4 + BaCl2 → BaSO4 + 2HCl.
B. 3HCl + Fe(OH)3 → 3FeCl3 + 3H2O.
C. H2SO4 + 2NaOH → Na2SO4 + 2H2O.
D. NaOH + NaHCO3 → Na2CO3 + H2O.
Câu 5 (NB): Phản ứng nào dưới đây, cacbon thể hiện tính oxi hóa A. 3C + 4Al Al4C3 B. C + O2 CO2 C. C + H2O CO + H2 D. 2CuO + C 2Cu + CO2
Câu 6 (NB): "Nước đá khô" không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và
khô rất tiện cho việc bảo quản thực phẩm. Thành phần chính của nước đá khô là: A. CO2 rắn B. CO rắn C. SO2 rắn D. H2O rắn
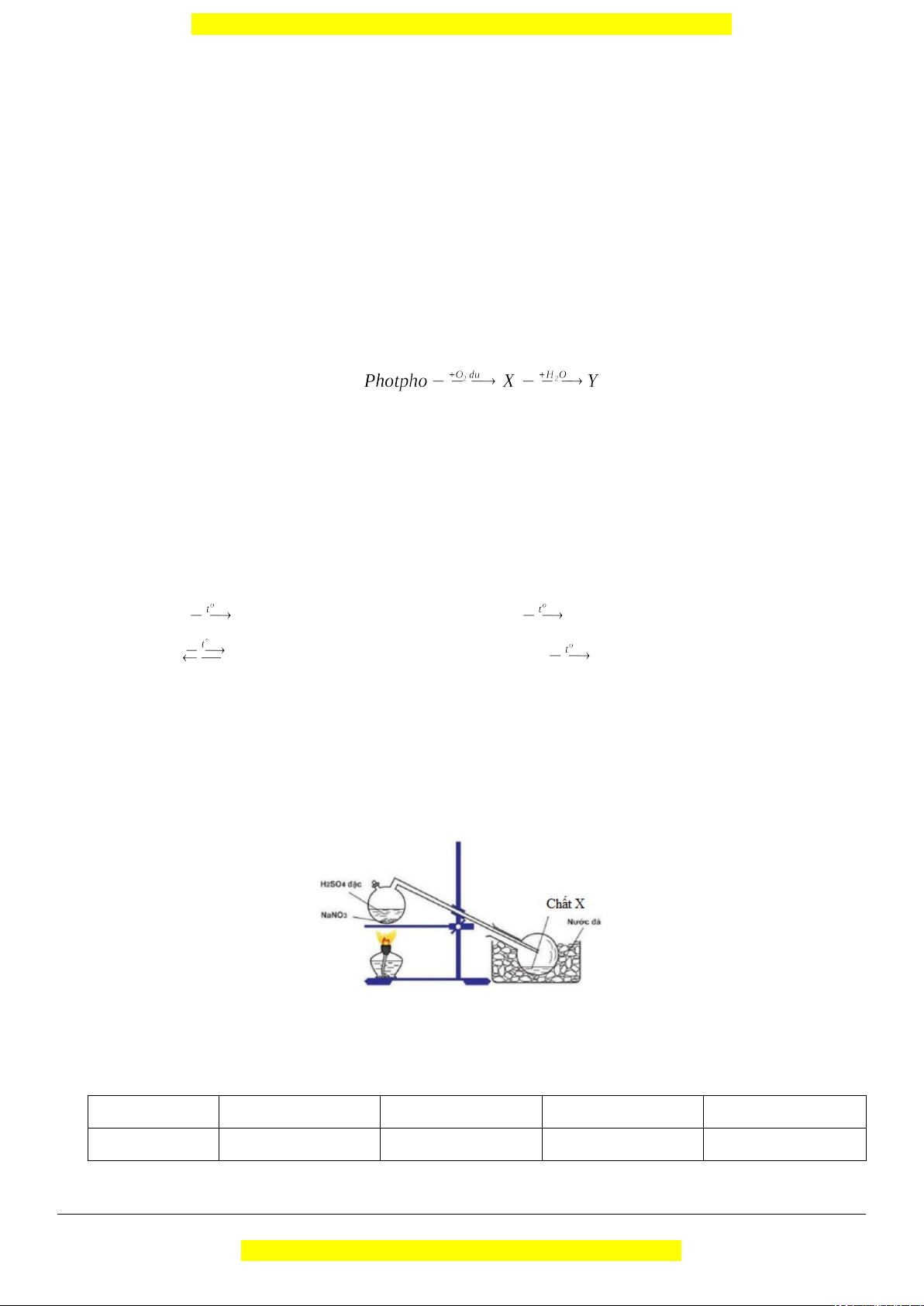
Câu 7 (TH): Để điều chế chất X trong phòng thí nghiệm, người ta cho NaNO3 rắn phản ứng với H2SO4 đặc theo bình sau: Chất X là: A. H3PO4 B. N2 C. NH3 D. HNO3
Câu 8 (TH): Cho giá trị pH của một số mẫu chất lỏng sau: Mẫu Giấm Sữa Dịch dạ dày Nước mắt pH 3 6,5 1-2 7,4
Mẫu dịch lỏng nào có nồng độ ion H+ cao nhất? Trang 1
A. Nước mắt. B. Dịch dạ dày. C. Giấm. D. Sữa.
Câu 9 (TH): Chất bột X màu đen, có khả năng hấp phụ các chất khí độc nên được dùng trong nhiều loại
mặt nạ phòng độc. Chất X là: A. Than hoạt tính B. Lưu huỳnh C. Than đá D. Đá vôi
Câu 10 (TH): Cho dung dịch AlCl3 0,2M. Nồng độ mol của ion Al3+ và Cl- lần lượt là A. 0,6 và 0,2 B. 0,2 và 0,3 C. 0,2 và 0,2 D. 0,2 và 0,6
Câu 11 (NB): Chất nào sau đây là chất điện li yếu khi hòa tan trong nước ? A. H2S B. Ba(OH)2 C. HCl D. Na2SO4
Câu 12 (NB): Chất nào sau đây là hidroxit lưỡng tính? A. NaOH B. Ca(OH)2 C. KOH D. Al(OH)3
Câu 13 (NB): Phân đạm cung cấp nitơ cho cây trồng dưới dạng ion A. NH + 3- - + 3- + 4 và PO4 . B. NO3 và NH4 . C. PO4 và K+. D. K+ và NH4 .
Câu 14 (NB): Thuốc thử để nhận biết khí NH3 là A. dung dịch NaCl B. quỳ tím ẩm C. dung dịch NaOH D. dung dịch NaNO3
Câu 15 (VD): Cho dung dịch chứa 0,3 mol KOH vào dung dịch chứa 0,2 mol H3PO4 thu được dung dịch
X. Các chất hòa tan có trong dung dịch X là: A. K3PO4 và KOH
B. KH2PO4 và K2HPO4
C. K2HPO4 và K3PO4 D. KH2PO4 và K3PO4
Câu 16 (TH): Cặp chất nào sau đây có thể tồn tại trong một dung dịch A. HCl và AgNO3 B. KOH và HCl
C. NaHCO3 và NaOH D. NaCl và NH4NO3
Câu 17 (NB): Chất nào sau đây là chất điện li ? A. Saccarozo B. Benzen C. Ancol etylic D. Axit clohidric
Câu 18 (VD): Dung dịch HCl 0,01M có giá trị pH là: A. 12 B. 13 C. 2 D. 3
Câu 19 (NB): Để khắc chữ trên thủy tinh (thành phần chính là SiO2) người ta dùng dung dịch chứa chất tan nào sau đây? A. HF B. HBr C. HI D. HCl
Câu 20 (NB): Trong phòng thí nghiệm, nito được điều chế theo phương trình nào? A. 2NH3 + 3CuO 3Cu + N2 + 3H2O B. 4NH3 + O2 2N2 + 6H2O C. NH4Cl + NaNO2 NaCl + N2 + 2H2O
D. 2NH3 + 3Cl2 → N2 + 6HCl
Câu 21 (VD): Trung hòa dung dịch chứa 0,2 mol NaOH cần dùng V ml dung dịch HNO3 2M. Giá trị của V là A. 400 B. 300 C. 100 D. 200 Trang 2
Câu 22 (NB): Nhiệt phân hoàn toàn Cu(NO3)2 thu được các sản phẩm là A. CuO, NO2, O2 B. Cu, NO2, O2 C. Cu(NO2)2, O2 D. CuO, NO2
Câu 23 (NB): Dung dịch nào sau đây có pH < 7? A. NaCl B. HCl C. NaOH D. NaNO3
Câu 24 (NB): Dung dịch nào sau đây làm quỳ tím chuyển xanh A. KCl B. HCl C. NaOH D. Na2SO4 II. TỰ LUẬN
Câu hỏi 1 (NB): Viết phương trình dạng phân tử và ion thu gọn của các phản ứng sau a. BaCl2 + K2SO4 →
b. Na2CO3 + … → CO2 + … + …
Câu 2 (VD): Hấp thụ hoàn toàn 6,72 lít khí (đktc) khí CO2 vào 400 ml dung dịch KOH 2M. Tính nồng độ
mol của các chất có trong dung dịch sau phản ứng (giả sử thể tích dung dịch không thay đổi).
Câu hỏi 3 (VD): Cho 1,92 gam Cu vào dung dịch HNO3 1,5M loãng lấy dư thu được V lít khí NO (đktc)
và dung dịch A. Biết khí NO sinh ra là sản phẩm khử duy nhất của các phản ứng, các phản ứng xảy ra hoàn toàn. a. Tính V
b. Cho dung dịch A tác dụng với Fe dư, thấy khối lượng Fe đã phản ứng là 2,52 gam và sinh ra khí NO.
Tính thể tích dung dịch HNO3 1,5M đã dùng Đáp án 1-B 2-B 3-D 4-C 5-A 6-A 7-D 8-B 9-A 10-D 11-A 12-D 13-B 14-B 15-B 16-D 17-D 18-C 19-A 20-C 21-C 22-A 23-B 24-C LỜI GIẢI CHI TIẾT
Câu 1: Đáp án B Phương pháp giải:
Muối axit là muối là muối mà H trong gốc axit vẫn còn khả năng phân li ra H+
→ Muối trung hòa thường không có H (ngoại lệ là , ...) Giải chi tiết:
Muối axit là muối là muối mà H trong gốc axit vẫn còn khả năng phân li ra H+
→ Muối trung hòa thường không có H (ngoại lệ là , ...) Vậy:
Na2HPO4, KHCO3, NH4HSO4 là muối axit. Na2SO3 là muối trung hòa.
Câu 2: Đáp án B Trang 3
Phương pháp giải:
Dựa vào phương pháp nhận biết ion PO 3- 4 trong dung dịch. Giải chi tiết: Để nhận biết ion PO 3-
4 người ta thường dùng dung dịch AgNO3 vì sản phẩm có kết tủa màu vàng. PT ion: 3Ag+ + PO 3-
4 → Ag3PO4 (kết tủa vàng)
Câu 3: Đáp án D Phương pháp giải:
Tính chất hóa học của P và hợp chất của photpho. Giải chi tiết: PTHH: 4P + 5O2 2P2O5 (X) P2O5 + 3H2O → 2H3PO4 (Y)
Câu 4: Đáp án C Phương pháp giải:
Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để
nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn. Giải chi tiết:
A có PT ion thu gọn là SO 2- 4 + Ba2+ → BaSO4 → loại
B có PT ion thu gọn là 3H+ + Fe(OH)3 → Fe3++ 3H2O → loại
C có PT ion thu gọn là H+ + OH- → H2O → thỏa mãn
D có PT ion thu gọn là OH- + HCO - 2- 3 → CO3 + H2O → loại
Câu 5: Đáp án A Phương pháp giải:
Chất oxi hóa là chất nhận electron => số oxi hóa giảm. Giải chi tiết:
Xét số oxi hóa của C trong các phản ứng:
- Phương án A số oxi hóa giảm từ 0 xuống -4 => Tính oxi hóa
- Phương án B số oxi hóa tăng từ 0 lên +4 => Tính khử
- Phương án C số oxi hóa tăng từ 0 lên +2 => Tính khử
- Phương án D số oxi hóa tăng từ 0 lên +4 => Tính khử
Câu 6: Đáp án A Phương pháp giải: Giải chi tiết:
Thành phần chính của nước đá khô là CO2 rắn Trang 4
Đề thi học kì I Hóa lớp 11 Sở GD và ĐT Phú Yên
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ 29 Đề thi học kì 1 Hóa học năm 2023 - 2024 chọn lọc từ các trường bản word có lời giải chi tiết:
+ Đề thi học kì 1 Hóa học năm 2023 trường THPT Trần Hưng Đạo - Hà Nội;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Tenlơman - TP. Hồ Chí Minh;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Bình Chánh - TP. Hồ Chí Minh;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Quang Trung;
+Đề thi học kì 1 Hóa học năm 2023 Sở GD_ĐT tỉnh Quảng Nam.
…..……………………
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(557 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất