SỞ GD&ĐT THÁI NGUYÊN
ĐỀ KIỂM TRA HỌC KÌ I TRƯỜNG THPT MÔN: Hóa – Lớp 11 LƯƠNG NGỌC QUYẾN
Thời gian làm bài: 45 phút; không kể thời gian phát đề I. TRẮC NGHIỆM
Câu 1 (NB): Công thức hoá học của supephotphat kép là: A. CaHPO4. B. Ca3(PO4)2.
C. Ca(H2PO4)2 và CaSO4. D. Ca(H2PO4)2.
Câu 2 (NB): Cho các phản ứng sau: (1) N2 + O2 2NO (2) N2 + 3H2 2NH3
Trong hai phản ứng trên thì nitơ
A. chỉ thể hiện tính khử.
B. thể hiện tính khử và tính oxi hóa.
C. chỉ thể hiện tính oxi hóa.
D. không thể hiện tính khử và tính oxi hóa.
Câu 3 (NB): Cho 4 lọ dung dịch riêng biệt X, Y, Z, T chứa các chất khác nhau trong số 4 chất:
(NH4)2CO3, NaHCO3, NaNO3, NH4NO3. Thực hiện nhận biết bốn dung dịch trên bằng dung dịch Ba(OH)2 thu được kết quả sau: Chất X Y Z T Dung dịch Ba(OH)2 Kết tủa trắng Khí mùi khai Không hiện tượng Kết tủa trắng, khí mùi khai
Nhận xét nào sau đây là đúng?
A. Z là dung dịch NH4NO3.
B. X là dung dịch NaNO3.
C. T là dung dịch (NH4)2CO3.
D. Y là dung dịch NaHCO3.
Câu 4 (NB): Phản ứng trao đổi ion trong dung dịch các chất điện li xảy ra khi
A. sản phẩm tạo màu.
B. chất phản ứng là các chất dễ tan.
C. sản phẩm tạo thành có chất kết tủa hoặc chất bay hơi hoặc chất điện li yếu.
D. chất phản ứng là các chất điện li mạnh.
Câu 5 (VD): Hòa tan hoàn toàn 1,2 gam kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí nitơ
duy nhất (đktc). Kim loại X là A. Zn. B. Al . C. Mg. D. Cu.
Câu 6 (TH): Hiệu ứng nhà kính là hiện tượng Trái đất đang ấm dần lên, do các bức xạ có bước sóng dài
trong vùng hồng ngoại bị giữ lại, mà không bức xạ ra ngoài vũ trụ. Chất khí là nguyên nhân chủ yếu gây
nên hiệu ứng nhà kính là A. N2. B. O2. C. H2. D. CO2.
Câu 7 (TH): Chọn phát biểu đúng trong số các phát biểu sau đây ? Trang 1
A. Giá trị pH tăng thì độ axit giảm.
B. Giá trị pH tăng thì độ axit tăng.
C. Dung dịch có pH > 7 làm quỳ tím hoá đỏ. D. Dung dịch có pH < 7 làm quỳ tím hoá xanh.
Câu 8 (VD): Dung dịch X chứa lần lượt a mol Mg2+, b mol Al3+, 0,1 mol SO 2– – 4 và 0,6 mol NO3 . Cô cạn
dung dịch X thu được 54,6 gam muối khan. Giá trị của a và b lần lượt là: A. 0,1 và 0,2.
B. 0,05 và 0,1. C. 0,2 và 0,1. D. 0,2 và 0,05
Câu 9 (TH): Cho 20 gam NaOH vào 200 ml dung dịch H3PO4 1M. Muối nào thu được sau phản ứng?
A. NaH2PO4 và Na2HPO4. B. Na2HPO4 và Na3PO4. C. Na2HPO4. D. Na3PO4.
Câu 10 (TH): Dung dịch HNO3 thể hiện tính axit khi phản ứng với chất nào sau đây? A. Fe(OH)2 B. Fe2O3 C. FeO D. FeS
Câu 11 (NB): Theo A–rê–ni–ut chất nào sau đây là axit? A. H2SO4 B. Ca(OH)2 C. NaCl. D. NaHCO3
Câu 12 (TH): Cho các phản ứng sau:
(1) Ca(OH)2 + Na2CO3 → (4) (NH4)2CO3 + Ca(NO3)2 → (2) Ca(HCO3)2 + NaOH → (5) Ca(HCO3)2 + Ca(OH)2 → (3) Na2CO3 + CaCl2 → (6) K2CO3 +Ca(NO3)2 →
Có bao nhiêu phản ứng có cùng phương trình ion rút gọn là: Ca2+ + CO 2– 3 → CaCO3↓ A. 4. B. 3. C. 5. D. 2.
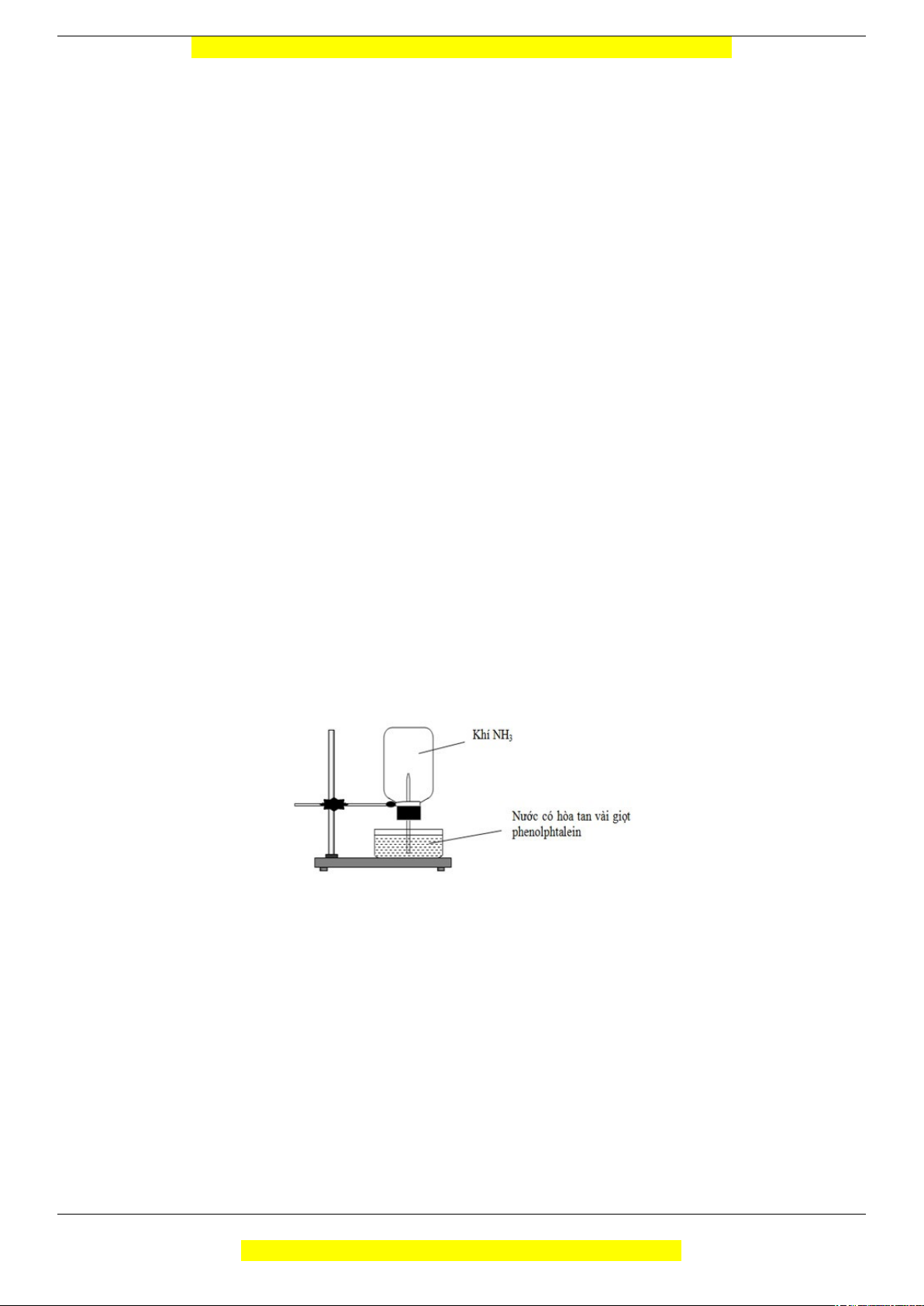
Câu 13 (VD): Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa
nước có nhỏ vài giọt phenolphtalein.
Hiện tượng xảy ra trong thí nghiệm là:
A. Nước phun vào bình và không có màu
B. Nước phun vào bình và chuyển thành màu hồng
C. Nước phun vào bình và chuyển thành màu tím
D. Nước phun vào bình và chuyển thành màu xanh
Câu 14 (VD): Dung dịch axit mạnh H2SO4 0,01M có A. pH = 2,00.
B. pH > 2,00 .
C. [H+] > 0,02M. D. pH < 2,00.
Câu 15 (VD): Chất nào sau đây là chất không điện li? A. HCl. B. KOH. C. C2H5OH. D. NaCl.
Câu 16 (TH): Chọn phát biểu đúng Trang 2
A. Photpho trắng được bảo quản bằng cách ngâm trong nước
B. Ở điều kiện thường photpho trắng chuyển dần thành photpho đỏ
C. Photpho trắng tan trong nước không độc
D. Photpho đỏ phát quang màu lục nhạt trong bóng tối
Câu 17 (NB): Kim loại nào sau đây thụ động trong dung dịch HNO3 đặc, nguội? A. Al. B. Cu. C. Pb D. Mg.
Câu 18 (VD): Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm Al2O3 và CuO nung nóng đến khi
phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là A. 0,8 gam. B. 8,3 gam. C. 2,0 gam. D. 4,0 gam. II. TỰ LUẬN
Câu 19 (TH): Viết phương trình dạng phân tử của các phản ứng hóa học sau:
a) NH4Cl + NaOH → NH3↑ + .... + .....
b) CaCO3 (rắn) + HCl → ....+ ... + ...
c) Na3PO4 + AgNO3 → .... + ....
Câu 20: Cho m gam hỗn hợp gồm A gồm Cu và Fe tác dụng với 200 ml dung dịch HNO3 đặc, nóng 1M
(axit dư), thu được 3,68 gam khí NO2 là sản phẩm khử duy nhất và dung dịch X. Mặt khác cũng cho m
gam hỗn hợp A tác dụng với dung dịch HCl dư thu được 0,448 lít khí (đktc).
1) Tính tỉ lệ % về khối lượng của mỗi kim loại trong A.
2) Tính thể tích dung dịch Ba(OH)2 0,5M dùng để phản ứng hết với các chất trong dung dịch X. Đáp án 1–B 2–B 3–C 4–C 5–C 6–D 7–A 8–A 9–B 10–B 11–A 12–A 13–B 14–D 15–C 16–A 17–A 18–D 19– 20– 21– 22– 23– 24– 25– 26– 27– 28– 29– 30– 31– 32– 33– 34– 35– 36– 37– 38– 39– 40– LỜI GIẢI CHI TIẾT
Câu 1: Đáp án B
Công thức hoá học của supephotphat kép là Ca(H2PO4)2.
Câu 2: Đáp án B Phương pháp giải:
Chất khử là chất nhường electron nên số oxi hóa tăng
Chất oxi hóa là chất nhận electron nên số oxi hóa giảm Giải chi tiết:
(1) nitơ thể hiện tính khử vì số oxi hóa của N tăng N0 → N+2 Trang 3
(2) nitơ thể hiện tính oxi hóa vì số oxi hóa của N giảm N0 → N–3
Câu 3: Đáp án C Phương pháp giải:
Dựa vào chất sản phẩm khi cho 4 chất trên vào dung dịch Ba(OH)2
Ba(OH)2 + (NH4)2CO3 → BaCO3 ↓ + 2NH3 ↑ + 2H2O
Ba(OH)2 + NaHCO3 → BaCO3 ↓ + NaOH + H2O
Ba(OH)2 + NaNO3 → không phản ứng
Ba(OH)2 + NH4NO3 → Ba(NO3)2 + NH3 ↑ +H2O Giải chi tiết:
Ba(OH)2 + (NH4)2CO3 → BaCO3 ↓ + 2NH3 ↑+ 2H2O
Ba(OH)2 + NaHCO3 → BaCO3 ↓ + NaOH + H2O
Ba(OH)2 + NaNO3 → không phản ứng
Ba(OH)2 + NH4NO3 → Ba(NO3)2 + NH3 ↑ +H2O
Qua 4 phương trình trên ta thấy
X tạo kết tủa trắng với Ba(OH)2 nên X là NaHCO3 → B sai
Y tạo khí mùi khai với Ba(OH)2 nên Y là NH4NO3 → D sai
Z không hiện tượng khi phản ứng với Ba(OH)2 nên Z là NaNO3 → A sai
T tạo cả kết tủa trắng và khí mùi khai với Ba(OH)2 nên T là (NH4)2CO3 → C đúng
Câu 4: Đáp án C Phương pháp giải:
Dựa vào điều kiện để xảy ra phản ứng trao đổi ion trong dung dịch. Giải chi tiết:
Phản ứng trao đổi ion trong các dung dịch điện li xảy ra khi sản phẩm tạo thành có ít nhất 1 trong 3 loại
chất: kết tủa, chất bay hơi, chất điện li yếu.
Câu 5: Đáp án C Phương pháp giải:
– Đặt số oxi hóa của X khi tác dụng với HNO3 là +n
– Viết các quá trình cho – nhận e. Áp dụng định luật bảo toàn electron để lập biểu thức mối liên hệ giữa M và n.
– Biện luận để tìm giá trị M, n thỏa mãn. Giải chi tiết: nN2 = 0,01 mol
Đặt số oxi hóa của X khi tác dụng với HNO3 là +n QT cho e: X0 → X+n + n e QT nhận e: 2N+5 + 10e → N2 Trang 4
Đề thi học kì I Hóa lớp 11 trường THPT Lương Ngọc Quyến - Thái Nguyên
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ 29 Đề thi học kì 1 Hóa học năm 2023 - 2024 chọn lọc từ các trường bản word có lời giải chi tiết:
+ Đề thi học kì 1 Hóa học năm 2023 trường THPT Trần Hưng Đạo - Hà Nội;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Tenlơman - TP. Hồ Chí Minh;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Bình Chánh - TP. Hồ Chí Minh;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Quang Trung;
+Đề thi học kì 1 Hóa học năm 2023 Sở GD_ĐT tỉnh Quảng Nam.
…..……………………
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(438 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất