SỞ GIÁO DỤC VÀ ĐÀO
KỲ THI CHỌN HỌC SINH GIỎI CÁC MÔN VĂN HÓA CẤP TỈNH TẠO NĂM HỌC: 2023 - 2024
MÔN THI: HÓA HỌC – KHỐI 11 NGÀY THI: ĐỀ THI CHÍNH THỨC
Thời gian làm 90 phút (không kể thời gian phát đề)
(Đề thi có 3 phần, 18 trang)
Họ và tên: ............................................................................ Số báo danh: ....... Mã đề 101
Cho biết nguyên tử khối: H=1; C=12; N=14; O=16; Cl=35,5; Na=23; K=39; Mg=24; Ba=137;
P=31; S=32; Ca=40; Fe=56; Cu=64; Br=80, Mn=55 ; F=19; I=127; Al=27
Thể tích khí ở đkc (25oC, 1 bar) được tính theo công thức: V = n 24,79
PHẦN 1. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 50.
Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Sulfur dạng kem bôi được sử dụng để điều trị mụn trứng cá. Nguyên tử sulfur có phân
lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây về nguyên tử sulfur sai?
A. Lớp ngoài cùng của sulfur có 6 electron.
B. Hạt nhân nguyên tử sulfur có 16 electron.
C. Trong bảng tuần hoàn sulfur nằm ở chu kì 3.
D. Sulfur nằm ở nhóm VIA.
Câu 2: So sánh nhiệt độ sôi và nhiệt độ nóng chảy nào sau đây về 2 chất sau là đúng ?
A. Chất (1) có nhiệt độ sôi và nhiệt độ nóng chảy thấp hơn chất (2).
B. Chất (1) có nhiệt độ sôi cao hơn chất (2) nhưng chất (2) có nhiệt độ nóng chảy cao hơn chất (1).
C. Chất (1) có nhiệt độ sôi thấp hơn chất (2) và chất (2) có nhiệt độ nóng chảy cao hơn chất (1).
D. Chất (1) có nhiệt độ sôi cao và nhiệt độ nóng chảy cao hơn chất (2)
Câu 3: Phản ứng đốt cháy butane diễn ra như sau:
Một bình gas chứa 12 kg butane có thể đun sôi bao nhiêu ấm nước? (Giả thiết mỗi ấm nước
chứa 1,5 L nước ở 25oC, nhiệt dung của nước là 4,2 J/g.K, có 40% nhiệt đốt cháy butane bị thất
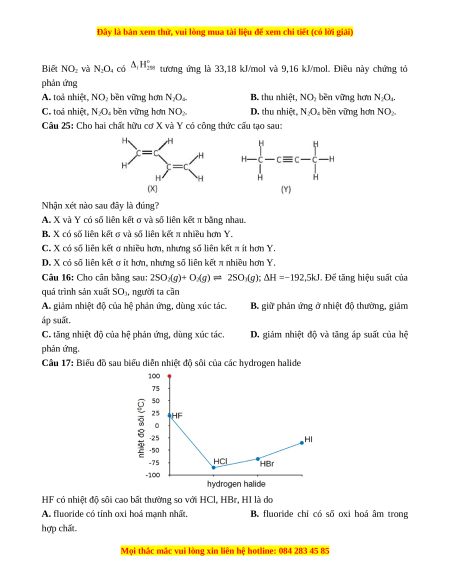
thoát ra ngoài môi trường). A. 517,5. B. 918. C. 690. D. 691.
Câu 4: Glucose là một loại monosaccarit với công thức phân tử C6H12O6 được tạo ra bởi thực vật
và hầu hết các loại tảo trong quá trình quang hợp từ nước và CO2, sử dụng năng lượng từ ánh
sáng mặt trời. Dung dịch glucose 5% (D = 1,1 g/mL) là dung dịch đường tiêm tĩnh mạch, là loại
thuốc thiết yếu, quan trọng của Tổ chức Y tế Thế giới (WHO) và hệ thống y tế cơ bản. Phương
trình nhiệt hoá học của phản ứng oxi hoá glucose:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l); = − 2 803,0 kJ
Năng lượng tối đa khi một người bệnh được truyền 1 chai 500 mL dung dịch glucose 5%. A. 428,23 kJ. B. 842,23 kJ. C. 284,23 kJ. D. 482,23 kJ.
Câu 5: Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20. Phát biểu nào sau đây sai?
A. Các nguyên tố này đều là các kim loại mạnh nhất trong chu kì.
B. Các nguyên tố này không cùng thuộc một chu kì.
C. Thứ tự tăng dần tính base là: X(OH)2, Y(OH)2, Z(OH)2.
D. Thứ tự tăng dần độ âm điện là: Z, Y, X.
Câu 6: Cho phản ứng sau: S (s) + O2 (g) SO2 (g); = −296,8 kJ/mol.
Khẳng định nào sau đây sai? A.
= −296,8 kJ/mol là lượng nhiệt tỏa ra khi tạo ra 1 mol SO2(g) từ đơn chất S(s) và
O2(g), đây là các đơn chất bền nhất ở điều kiện chuẩn. B. Ở điều kiện chuẩn (O2, g) = 0. C. Ở điều kiện chuẩn (S, s)= 0.
D. Hợp chất SO2 (g) kém bền hơn về mặt năng lượng so với các hợp chất bền S(s) và O2(g).
Câu 7: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: N2 (g) + O2 (g) → 2NO (g); = +180 kJ
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
B. Phản ứng tỏa nhiệt.
C. Phản ứng xảy ra thuận lợi hơn ở điều kiện thường.
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Câu 8: Cho sơ đồ phản ứng. Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O. Sau khi cân bằng, tỉ lệ
giữa số phân tử bị oxi hoá và số phân tử bị khử là A. 3:1. B. 28:3. C. 3:28. D. 1:3.
Câu 9: Hòa tan hoàn toàn x mol CuFeS2 bằng dung dịch HNO3 đặc, nóng (dư) sinh ra y mol
NO2 (sản phẩm khử duy nhất của N+5). Biểu thức liên hệ giữa x và y là A. y = 17x. B. x = 15y. C. x = 17y. D. y = 15x.
Câu 10: Cho các phát biểu sau
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(b) Trong phân tử NH4NO3 có hai liên kết cộng hóa trị cho nhận.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Trong phân tử C4H10 có 14 liên kết xích ma.
(e) Nước đá và nước lỏng có khối lượng riêng bằng nhau. Số phát biểu đúng là A. 3. B. 1. C. 2. D. 4.
Câu 11: Cho các phát biểu sau
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(b) Trong phân tử NH4NO3 có hai liên kết cộng hóa trị cho nhận.
(c) Tương tác Van der Waals yếu hơn liên kết hydrogen.
(d) Trong phân tử C4H10 có 14 liên kết xích ma.
(e) Nước đá và nước lỏng có khối lượng riêng bằng nhau. Số phát biểu đúng là A. 3. B. 1. C. 2. D. 4.
Câu 12: Cho 3 hydrocarbon X, Y, Z đều có 2 nguyên tử C trong phân tử. Số nguyên tử H trong
các phân tử tăng dần theo thứ tự X, Y, Z. Cho bảng enthalpy tạo thành chuẩn của các chất sau: Chất X (g) Y (g) Z (g) CO2 (g) H2O (g) (kJ/mol) +227,0 +52,47 −84,67 −393,5 −241,82 Cho các phát biểu sau:
(a) Công thức cấu tạo của X, Y, Z lần lượt là HC CH, H2C=CH2, H3C−CH3.
(b) Biến thiên enthalpy của phản ứng đốt cháy 1 mol X là −2855,58 kJ.
(c) Ở điều kiện chuẩn, đốt cháy 1 mol Z (g) bằng O2 (g) sinh ra CO2 (g) và H2O (g) và tỏa ra 1323,11 kJ nhiệt.
(d) Các chất X, Y, Z đều được sử dụng làm nhiên liệu.
(e) Chất X được dùng để hàn, cắt kim loại. Số phát biểu đúng là A. 1. B. 2. C. 3. D. 4.
Câu 13: Hàm lượng cho phép của tạp chất sulfur trong nhiên liệu là 0,30%. Người ta đốt cháy
hoàn toàn 100,0 gam một loại nhiên liệu và dẫn sản phẩm cháy (giả thiết chỉ có CO2, SO2 và
hơi nước) qua dung dịch KMnO4 5,0.10-3M trong H2SO4 thì thấy thể tích dung dịch KMnO4 đã
phản ứng vừa hết với lượng sản phẩm cháy trên là 625 mL. Cho các phát biểu sau:
(a) KMnO4 đã bị oxi hóa thành MnSO4.
(b) KMnO4 đã oxi hóa S+4 thành S+6.
(c) Phần trăm khối lượng của nguyên tố S trong nhiên liệu là 0,50%.
(d) Nhiên liệu trên được phép sử dụng.
(e) Mỗi phân tử SO2 nhường đi 2 electron. Số phát biểu đúng là A. 1. B. 2. C. 3. D. 4.
Câu 14: Ion calcium (Ca2+) cần thiết cho máu người hoạt động bình thường. Nồng độ Ca2+
không bình thường là dấu hiệu của bệnh. Để xác định nồng độ Ca2+ người ta lấy mẫu máu, cho
kết tủa Ca2+ dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate phản ứng với dung
dịch KMnO4 trong môi trường acid theo phản ứng sau:
KMnO4 + CaC2O4 + H2SO4 → MnSO4 + CaSO4 + K2SO4 + CO2 + H2O
Giả sử calcium oxalate kết tủa từ 1 mL máu người phản ứng vừa hết với 2,05 L
(a) Số oxi hóa của carbon trong calcium oxalate là +6.
(b) Một phân tử calcium oxalate nhường 2 electron.
(c) Tỉ lệ mol KMnO4 và CaC2O4 tương ứng là 5 : 2.
(d) Trong phản ứng, calcium oxalate bị khử thành CO2.
(e) Khối lượng ion calcium trong 100 mL máu là 10 mg. Số phát biểu đúng là A. 5. B. 2. C. 3. D. 4.
Câu 15: Cho phản ứng hoá học xảy ra ở điều kiện chuẩn sau: 2NO2(g) (đỏ nâu) N2O4(g) (không màu)
Đề thi HSG Hóa 11 năm 2023-2024 (Đề 13) có lời giải
775
388 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Bộ 20 đề thi Học sinh giỏi Hóa 11 năm 2023 - 2024 chương trình sách mới và tặng kèm 12 đề HSG Hóa 11 năm 2022-2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo Hóa học 11.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(775 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)