TRƯỜNG THPT CHUYÊN HÀ NỘI –
HỌC SINH GIỎI DUYÊN HẢI BẮC BỘ AMSTERDAM
NĂM HỌC 2023 – 2024 ĐỀ THI ĐỀ XUẤT
Môn: HÓA HỌC – LỚP 11
Thời gian: 180 phút
Cho: h = 6,62610-34 J/s; c = 3108 m/s2; 1eV = 1,602.10-19 J; 1Ci = 3,71010 Bq
Câu 1. (2,5 điểm) Động học phản ứng
Dinitrogen pentaoxide ở điều kiện nhiệt độ và áp suất thường tồn tại ở thể rắn; nhưng nó rất dễ thăng
hoa và phân hủy theo phản ứng: N2O5(k) 2NO2(k) + ½ O2(k)
Với các kết quả thực nghiệm tại một nhiệt độ xác định như sau: Thí nghiệm 1 Thí nghiệm 2 Thí nghiệm 3 Nồng độ N2O5 (mol.l-1) 0,170 0,340 0,680
Tốc độ phân huỷ (mol.l-1.s-1) 1,39.10-3 2,78.10-3 5,55.10-3
1. Hãy viết biểu thức tốc độ phản ứng và xác định bậc phản ứng.
2. Cơ chế phản ứng được công nhận như sau: N k 2O5 1 k NO3 + NO2 (1) NO3 + NO2 1 N2O5 (-1) NO 3 + NO2 2 k NO2 + O2 + NO (2) NO + N2O5 3 k 3NO2 (3)
a) Chứng minh rằng cơ chế phản ứng nói trên có phù hợp với quy luật động học thu được từ thực nghiệm.
b) Cho năng lượng hoạt hóa của quá trình (1) và (2) tương ứng là Ea1 = 88 kJ/mol; Ea2 = 21 kJ/mol; xác
định năng lượng hoạt hóa của toàn bộ phản ứng; vẽ giản đồ đường phản ứng.
Câu 2. (2,5 điểm) Cân bằng và phản ứng trong dung dịch. Pin điện – Điện phân.
1. PbCrO4 được sử dụng rộng rãi làm chất tạo màu nhưng cả hai ion tạo thành chất này đều có độc tính đối với con người.
a) Một mẫu nước ngầm có pH = 6,00 được bão hòa PbCrO4. Tính nồng độ của các ion Pb2+; CrO42-;
HCrO4- và Cr2O72- trong mẫu nước.
b) Trong dạ dày của một người bị nhiễm độc chromium có nồng độ cân bằng của HCrO4- và Cr2O72-
bằng nhau. Giả thiết dịch dạ dày có pH = 3,0; hãy tính nồng độ tổng cộng của chromium hòa tan có
trong dạ dày của người này. Cho: Ka (HCrO4-) = 3,34.10-7; Ksp (PbCrO4) = 2,82.10-13; *β (PbOH+) = 1,585.10-8 2CrO42- + 2H+ Cr2O72- + H2O K = 3,13.1014
2. Người ta nghiên cứu khả năng sản xuất formic acid bằng cách điện phân dung dịch nước carbon dioxide.
a) Viết các phản ứng xảy ra trên các điện cực và phản ứng điện phân tổng cộng để sản xuất formic acid?
b) Chứng minh rằng nếu các phản ứng điện hóa xảy ra trong điều kiện thuận nghịch thì không thể điều chế được formic acid.
c) Làm thế nào nào để có thể sản xuất được formic acid theo phương pháp điện phân dung dịch nước carbon dioxide này? Cho các dữ kiện ở 250C: CO2(g) H2O(l) HCOOH(l) O2(g) H2(g) H0 (kJ.mol-1) -393,7 -286,0 -409,4 0 0 S0 (J.K.mol- 213,7 70,0 129,0 205,1 130,6 1)
Câu 3. (2,5 điểm) Nhiệt động học và cân bằng hóa học
Nước bị phân li theo phản ứng: 2H2O(g) 2H2(g) + O2(g)
a) Xác định biểu thức của G0 của phản ứng và biểu thức của lnK phụ thuộc T. Từ đó tính G0 và hằng
số cân bằng K của phản ứng ở 2000K.
b) Thiết lập biểu thức liên hệ giữa hằng số cân bằng K và hệ số phân ly ; từ đó tính hệ số phân ly của
nước ở 2000K dưới áp suất 1 bar.
Cho các giá trị chuẩn ở 298K H2(g) O2(g) H2O(g) H0f (kJ.mol-1) 0 0 -241,8 S0 (J.K-1.mol-1) 130,5 204,8 188,5 C0P (J.K-1.mol-1) 28,6 + 1,2.10-3T 36,1 + 0,8.10-3T 30,1 + 11,3.10-3T
Câu 4. (2,5 điểm) Hóa nguyên tố. Phức chất
1. Một dãy các phức chất bát diện của cobalt được tổng hợp trong dung dịch nước, có cực đại hấp thụ
max được thống kê trong bảng dưới đây: STT Phức chất max (nm) 1 Co(CO3)(NO3)(NH3)5 510 2 CoBr3(NH3)5 552 3 CoCl3(NH3)5 534 4 CoCl3(NH3)6 475 5 CoF(NO3)2(NH3)5 515 6 Co(NO3)3(NH3)5 495 Hãy:
a) Lập luận để viết công thức cấu tạo thu gọn của các phức chất trên.
b) Sắp xếp theo thứ tự giảm dần độ mạnh của trường tạo bởi các phối tử trong các phức chất trên.
2. Cho sơ đồ phản ứng: t0 t0 K + H2SO4đ A + B X F Y D H + L + G + CH3I + J + E + C Z L
X, Y, Z, L đều là các hợp chất được tạo thành từ 2 nguyên tố, trong đó có chung 1 thành phần nguyên tố.
X và Y khá kém bền, bị phân hủy ở nhiệt độ trên 900C.
Hợp chất X (trong đó nguyên tố có nguyên tử khối lớn hơn chiếm 98,45% về khối lượng); là kết tủa
được tạo thành khi trộn dung dịch màu xanh lam của muối A với dung dịch acid B là acid 1 nấc của phosphorus.
L được tạo thành khi khử nitride G (chứa 40,20% nitrogen). L và các dẫn xuất của nó được sử dụng
rộng rãi trong tổng hợp hữu cơ như là các tác nhân khử mạnh.
Chất bột màu trắng Y thu được khi cho hợp chất L phản ứng với muối iodide C; hoặc với chất lỏng D (M = 95,4g/mol).
Dễ dàng thu được Z khi cho E và F phản ứng trực tiếp với nhau theo tỉ lệ mol 1 : 1 trong điều kiện áp
suất cao. E có mặt trong các khoáng chất như dolomite, carnallite.
K và H là các kim loại đứng kế tiếp nhau trong bảng tuần hoàn.
J là acid trong phân tử có chứa chlorine.
a) Xác định các chất A, B, C, D … X, Y, Z nói trên và hoàn thành sơ đồ phản ứng.
b) Vì sao X và Y bền trong nước; Z thủy phân chậm trong nước; trong khi L phản ứng với mạnh với
nước và phản ứng tỏa nhiều nhiệt.
Câu 5. (2,5 điểm) Đại cương hữu cơ
1. Các cyclohexane thường tồn tại ở cấu dạng bền nhất là cấu dạng ghế; tuy nhiên có một số trường hợp
không như vậy. Hãy vẽ cấu dạng bền nhất của trans-1-tert-butyl-2-methylcyclohexane và trans-1,3-
ditert-butylcyclohexane.
2. Khi cho trans- và cis-methyl 2-bromocyclohexane-1-carboxylate lần lượt tác dụng với base mạnh đều
thu được cùng một sản phẩm nhưng có một chất phản ứng nhanh hơn hẳn chất còn lại. Giải thích sự tạo
thành sản phẩm trong mỗi trường hợp và cho biết đồng phân trans- hay cis- phản ứng nhanh hơn?
3. Squaric acid có công thức phân tử C4H2O4. Ở điều kiện thường squaric acid ở trạng thái tinh thể màu
trắng, tan tốt trong nước. Squaric acid là acid tương đối mạnh so với các acid hữu cơ thường gặp
(CH3COOH có pKa = 4,76). Hằng số phân ly acid của squaric là pKa1 = 1,5 và pKa2 = 3,4. Trong ion
squarate C4O42- độ dài các liên kết CC bằng nhau (1,47 Ao), các liên kết CO bằng nhau (1,26 Ao).
Đề xuất công thức cấu tạo của squaric acid. Biểu diễn cấu trúc của ion squarate. Giải thích tại sao acid
squaric có tính acid tương đối mạnh.
Câu 6. (2,5 điểm) Sơ đồ tổng hợp hữu cơ. Cơ chế phản ứng hữu cơ.
1. Đề xuất cơ chế cho các chuyển hóa sau: a) b)
2. Trikentrin A (C15H19N) là hợp chất thiên nhiên có hoạt tính kháng khuẩn được phân lập từ một loại
bọt biển. Trikentrin A có chứa dị vòng indole với nhóm thế mạch vòng ở nhân benzene, đây là kiểu cấu
trúc rất không phổ biến trong tự nhiên. Vì thế tổng hợp trikentin A là một mục tiêu hấp dẫn đối với các
nhà khoa học. Buszek và cộng sự đã tiến hành tổng hợp thành công cis-trikentin A theo sơ đồ sau:
a) Vẽ cấu tạo các chất từ 1 đến 5 và cấu trúc của 6, 7, cis-trikentin A trong sơ đồ tổng hợp trên.
b) Đề xuất cơ chế giải thích sự chuyển hóa từ 2 thành 3.
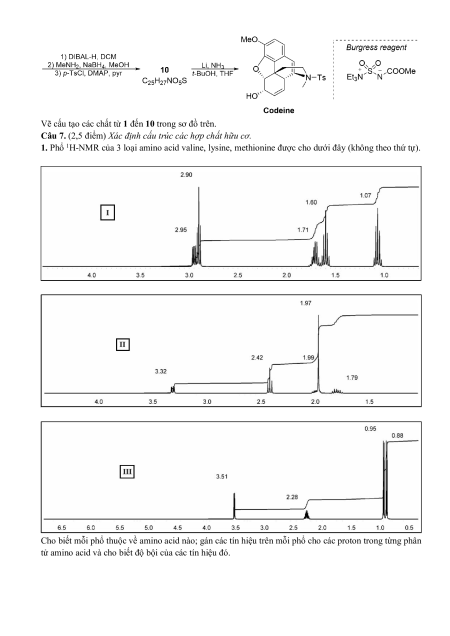
3. Codeine là một alkaloid có trong cây hoa thuốc phiện; được sử dụng với hàm lượng nhỏ để giảm đau,
trị ho, viêm họng… Từ trước đến nay đã có rất nhiều phương pháp tổng hợp codeine. Dưới đây là một
chuỗi tổng hợp Codeine được tiến hành và công bố bởi các nhà khoa học Trung Quốc vào năm 2015.
Vẽ cấu tạo các chất từ 1 đến 10 trong sơ đồ trên.
Câu 7. (2,5 điểm) Xác định cấu trúc các hợp chất hữu cơ.
1. Phổ 1H-NMR của 3 loại amino acid valine, lysine, methionine được cho dưới đây (không theo thứ tự).
Cho biết mỗi phổ thuộc về amino acid nào; gán các tín hiệu trên mỗi phổ cho các proton trong từng phân
tử amino acid và cho biết độ bội của các tín hiệu đó.
Đề thi HSG Hóa học 11 Trường THPT Chuyên Amsterdam - Hà Nội
785
393 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(785 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)