SỞ GD&ĐT TỈNH HÒA BÌNH
KỲ THI HỌC SINH GIỎI CÁC TRƯỜNG KHU TRƯỜNG THPT CHUYÊN
VỰC DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ HOÀNG VĂN THỤ NĂM HỌC 2023-2024
ĐỀ THI MÔN HÓA HỌC LỚP 11
(Đề thi đề xuất)
Thời gian làm bài: 180 phút
(Đề thi gồm có 09 trang, 08 câu)
Câu 1(2,5 điểm): Tốc độ phản ứng có cơ chế
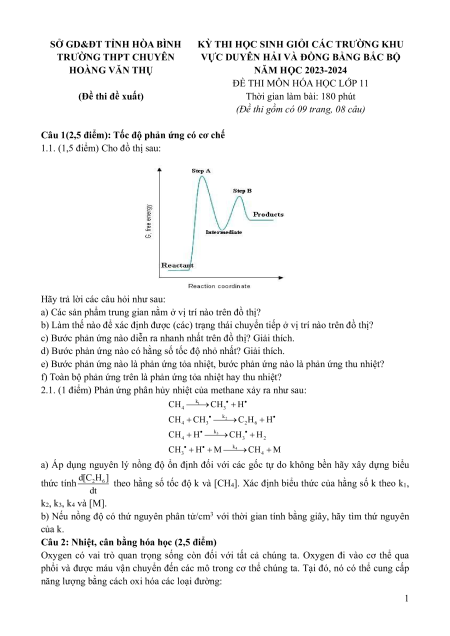
1.1. (1,5 điểm) Cho đồ thị sau:
Hãy trả lời các câu hỏi như sau:
a) Các sản phẩm trung gian nằm ở vị trí nào trên đồ thị?
b) Làm thế nào để xác định được (các) trạng thái chuyển tiếp ở vị trí nào trên đồ thị?
c) Bước phản ứng nào diễn ra nhanh nhất trên đồ thị? Giải thích.
d) Bước phản ứng nào có hằng số tốc độ nhỏ nhất? Giải thích.
e) Bước phản ứng nào là phản ứng tỏa nhiệt, bước phản ứng nào là phản ứng thu nhiệt?
f) Toàn bộ phản ứng trên là phản ứng tỏa nhiệt hay thu nhiệt?
2.1. (1 điểm) Phản ứng phân hủy nhiệt của methane xảy ra như sau: 1 k CH CH H 4 3 k2
CH CH C H H 4 3 2 6 k3 CH H CH H 4 3 2 k4
CH H M CH M 3 4
a) Áp dụng nguyên lý nồng độ ổn định đối với các gốc tự do không bền hãy xây dựng biểu thức tính d[C H ] 2 6
theo hằng số tốc độ k và [CH dt
4]. Xác định biểu thức của hằng số k theo k1, k2, k3, k4 và [M].
b) Nếu nồng độ có thứ nguyên phân tử/cm3 với thời gian tính bằng giây, hãy tìm thứ nguyên của k.
Câu 2: Nhiệt, cân bằng hóa học (2,5 điểm)
Oxygen có vai trò quan trọng sống còn đối với tất cả chúng ta. Oxygen đi vào cơ thể qua
phổi và được máu vận chuyển đến các mô trong cơ thể chúng ta. Tại đó, nó có thể cung cấp
năng lượng bằng cách oxi hóa các loại đường: 1 C6H12O6 + 6O2 → 6CO2 + 6H2O
Phản ứng này giải phóng 400 kJ năng lượng trên mỗi mol oxygen. Sự hấp thu O2 của máu
diễn ra ở bốn nhóm home (Hm) trong protein hemoglobin (Hb).
Hm tự do chứa một ion Fe2+ gắn với bốn nguyên tử N của một phối tử porphyrin. Oxygen có
thể liên kết ở tâm phối trí của Fe2+, tạo thành một phức chất Hm-O2. Carbon monoxide có thể
tạo phức tương tự, tạo thành Hm-CO. CO là một chất độc bởi nó liên kết với Hm mạnh hơn
O2. Hằng số cân bằng K1 của phản ứng: Hm + CO Hm.CO (1)
lớn hơn 10000 lần hằng số cân bằng K2 của phản ứng: Hm + O2 Hm.O2 (2)
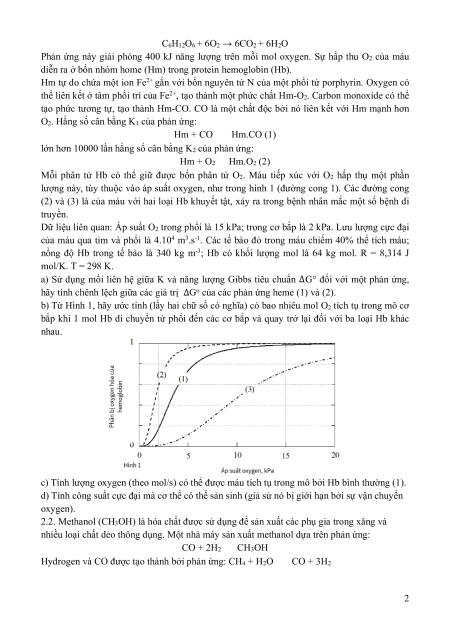
Mỗi phân tử Hb có thể giữ được bốn phân tử O2. Máu tiếp xúc với O2 hấp thụ một phần
lượng này, tùy thuộc vào áp suất oxygen, như trong hình 1 (đường cong 1). Các đường cong
(2) và (3) là của máu với hai loại Hb khuyết tật, xảy ra trong bệnh nhân mắc một số bệnh di truyền.
Dữ liệu liên quan: Áp suất O2 trong phổi là 15 kPa; trong cơ bắp là 2 kPa. Lưu lượng cực đại
của máu qua tim và phổi là 4.104 m3.s-1. Các tế bào đỏ trong máu chiếm 40% thể tích máu;
nồng độ Hb trong tế bào là 340 kg m-3; Hb có khối lượng mol là 64 kg mol. R = 8,314 J mol/K. T = 298 K.
a) Sử dụng mối liên hệ giữa K và năng lượng Gibbs tiêu chuẩn ∆G° đối với một phản ứng,
hãy tính chênh lệch giữa các giá trị ∆Go của các phản ứng heme (1) và (2).
b) Từ Hình 1, hãy ước tính (lấy hai chữ số có nghĩa) có bao nhiêu mol O2 tích tụ trong mô cơ
bắp khi 1 mol Hb di chuyển từ phổi đến các cơ bắp và quay trở lại đối với ba loại Hb khác nhau.
c) Tính lượng oxygen (theo mol/s) có thể được máu tích tụ trong mô bởi Hb bình thường (1).
d) Tính công suất cực đại mà cơ thể có thể sản sinh (giả sử nó bị giới hạn bởi sự vận chuyển oxygen).
2.2. Methanol (CH3OH) là hóa chất được sử dụng để sản xuất các phụ gia trong xăng và
nhiều loại chất dẻo thông dụng. Một nhà máy sản xuất methanol dựa trên phản ứng: CO + 2H2 CH3OH
Hydrogen và CO được tạo thành bởi phản ứng: CH4 + H2O CO + 3H2 2
Ba đơn vị [xưởng] của nhà máy này, cụ thể là, “reformer” để sản xuất hydrogen/carbon
monoxide, “methanol reactor” (lò phản ứng methanol) và “separator” (lò tách) để tách
methanol từ CO và H2, được sơ đồ hóa như trong Hình 1. Có bốn vị trí được chỉ ra bởi kí hiệu , , va .
Lưu lượng methanol ở vị trí là n[CH3OH, ] = 1000 mol s-1. Nhà máy được thiết kế sao
cho 2/3 CO được chuyển hóa thành methanol. H2 và CO dư ở vị trí được sử dụng để gia
nhiệt cho lò phản ứng thứ nhất. Giả sử rằng phản ứng reformer diễn ra hoàn toàn.
a) Tính lưu lượng CO và H2 ở vị trí .
b) Tính lưu lượng CO ở vị trí .
c) Tính lưu lượng CH4 và H2O cần ở vị trí .
d) Ở vị trí , tất cả các tiểu phân đều là chất khí. Tính áp suất riêng phần theo MPa đối với CO, H n
2, CH3OH ở vị trí , sử dụng biểu thức: i p p trong đó n i n
i là lưu lượng và pi là áp tong
suất riêng phần của hợp chất i, ntong là lưu lượng tổng ở vị trí được xét đến và p là áp suất tổng trong hệ (p = 10MPa).
Khi lò phản ứng methanol đủ lớn, phản ứng sẽ đi tới cân bằng. Áp suất riêng phần ở vị trí 2 p P thỏa mãn biểu thức: CH3OH o K trong đó p p 2 P P
o là một hằng số (0,1 MPa) và Kp là hàm của CO H2
nhiệt độ như được cho trong hình sau (thang của trục tung là logarithm)
e) Tính Kp và chỉ ra phản ứng phải được thực hiệnở nhiệt độ T nào để đạt được cân bằng này.
Câu 3: Dung dịch điện ly – Phản ứng oxi hóa – khử - Pin điện, điện phân. Phương án
thực hành (3 điểm)
3.1. Xe điện chạy bằng bình pin sạc lắc quyl (Electric Vehicles, viết tắt là EV) sẽ ngày càng
phổ biến hơn trong 50 năm tới vì những quan ngại không ngừng gia tăng về sự ô nhiễm bởi3
xe cộ dùng động cơ đốt gây ra. Nguyên do của sự thành công còn khiêm tốn hiện nay của EV
là các tiêu chuẩn của pin sạc phải có hiệu quả cao hơn và giá thành thấp hơn so với xe thông
thường. Pin sạc chì-acid được sử dụng rộng rãi như nguồn năng lượng di động cho xe cộ và
máy kéo. Một pin sạc chì-acid với khả năng nạp điện hữu hiệu có mật độ năng lượng 45 Wh/kg.
Trong tiến trình phát triển hiện nay của pin sạc cho EV, cách giải quyết lâu dài có triển vọng
nhất là pin lithium-ion nhẹ và nạp điện được. Chúng chỉ nặng bằng 1/3 pin sạc chì- acid.
Lithium được dùng làm điện cực âm. Nó có dung lượng riêng và thế điện cực cao. Một vật
liệu làm điện cực dương thông dụng và thân thiện với môi trường là LiMn2O4 kiểu spinel.
Cấu trúc spinel bao gồm một ma trận các ion oxide lập phương đặc khít, được bền hóa nhờ
các ion lithium ở vị trí tứ diện và các ion manganese ở vị trí bát diện. Trong LiMn2O4 một
nửa số ion manganese có số oxi hóa +3 và một nửa có số oxi hóa +4.
Một pin chì-acid được biểu diễn bởi:
Pb(s) | PbSO4(s) | H2SO4(aq) | PbSO4(s) | PbO2(s) | (Pb(s))
Một pin lithium được biểu diễn bởi:
Li(s) | chất điện phân dẫn Li+ (s) | LiMn2O4(s)
Khi phóng điện, sản phẩm chèn vào [xen lớp] Li2Mn2O4 được tạo thành. Khi sạc pin tạo
thành các sản phẩm Li(s) và LiMn2O4.
a) Viết các phương trình điện hóa tại các điện cực của pin chì-acid khi phóng điện.
b) Viết các phương trình điện hóa tại các điện cực của pin lithium-ion khi phóng điện.
c) Xác định số phối trí của các ion lithium và ion manganese trong cấu trúc spinel của LiMn2O4.
Một xe hơi gia đình điển hình nặng 1000 kg cần ít nhất năng lượng 5 kWh để di chuyển 50
km, tương ứng với mức tiêu thụ khoảng 5,0 L hay 3,78 kg xăng.
Ôtô thông dụng có thùng xăng thể tích 50 L. Khối lượng thùng là 10 kg. Mức tiêu thụ nhiên liệu bằng 10 km L-1.
d) Tính khối lượng dôi ra nếu thay thùng xăng bằng pin tương đương trong
EV dựa vào (1) pin chì-acid và (2) pin lithium. Giả sử rằng trong mọi trường hợp động cơ
đều có hiệu quả như nhau.
3.2. (a) Cho các cân bằng: AgSCN + IO 3 AgIO3 + SCN KI = 10-4,49 Ag 2CrO4 + 2 IO3 2 AgIO3 + CrO42 KII = 103,04 2 AgCl + CrO42 Ag2CrO4 + 2 Cl KIII = 10-8
Hãy tính hằng số cân bằng của phản ứng: AgSCN + Cl AgCl + SCN (b) Cho: E0 ; pK 8 , 0 V 0 a (NH4+) = 9,24 Ag / Ag Ag+ + NH3 AgNH3+ 1 =103,4
Dung dịch A thu được khi trộn 10,00 mL NH3 0,200 M với 10,00 mL hỗn hợp AgNO3 0,010 M và HNO3 0,200 M.
Dung dịch B thu được khi trộn 10,00 mL AgNO3 0,010 M, 10,00 mL HNO3 0,200 M với
20,00 mL NH3. pH của dung dịch B bằng 9,00.
i. Tính pH của dung dịch A. 4
Đề thi HSG Hóa học 11 Trường THPT Chuyên Hoàng Văn Thụ - Hòa Bình
567
284 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(567 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)