SỞ GD&ĐT HƯNG YÊN
ĐỀ THI CHỌN HỌC SINH GIỎI
TRƯỜNG THPT CHUYÊN HƯNG YÊN
KHU VỰC DH&ĐB BẮC BỘ NĂM 2024
ĐỀ THI MÔN HÓA HỌC LỚP 11 (Đề thi đề xuất)
Thời gian làm bài 180 phút
(Đề thi gồm có 07 trang, gồm 8 câu)
Câu 1. (2,5 điểm). Tốc độ phản ứng và cân bằng hóa học
1. Trong môi trường axit, I bị oxi hóa bởi BrO theo phản ứng: 3 + 9I + BrO + 6H 3I + Br + 3H O (I) 3 3 2
Thực nghiệm cho biết, ở một nhiệt độ xác định, biểu thức tốc độ của phản ứng có dạng: d[BrO] 3 + 2 v k[H ] [BrO][I ] (II) 3 dt
với k là hằng số tốc độ của phản ứng.
a. Cho biết bậc của phản ứng (I). Bậc của phản ứng bằng bao nhiêu nếu phản ứng được
thực hiện trong dung dịch đệm có pH = 3?
b. Nếu thực hiện phản ứng trong dung dịch đệm có pH < 7 thì năng lượng hoạt hóa của
phản ứng có thay đổi không? Tại sao?
2. Cho cân bằng: Me3DBMe3 (k) ⇆Me3D (k) + BMe3 (k), trong đó B là nguyên tố bo, Me
là nhóm CH3. Ở 100 oC, thực nghiệm thu được kết quả như sau:
Với hợp chất Me3NBMe3 (D là nitơ): Kp1 = 4,720.104 Pa; 0 S = 191,3 JK–1mol–1. 1
Me3PBMe3 (D là photpho): Kp2 = 1,280.104 Pa; 0 S = 167,6 JK–1mol–1. 2
a. Cho biết hợp chất nào khó phân li hơn? Vì sao?
b. Trong hai liên kết N–B và P–B, liên kết nào bền hơn?
Câu 2 (2,5 điểm). Cân bằng và phản ứng trong dung dịch. Pin điện- điện phân 1. Cho pin điện hóa:
(-)Zn | Zn(NO3)2 0,2M | AgNO3 0,1 M | Ag (+)
Các dung dịch Zn(NO3)2 và AgNO3 trong pin đều có thể tích 1,00L và ở 25oC.
a) Viết phương trình phản ứng ở mỗi điện cực và phương trình phản ứng xảy ra trong pin
khi pin phóng điện. Tính sức điện động (sđđ) của pin.
b) Tính tổng lượng điện có thể giải phóng tới khi pin phóng điện hoàn toàn và hằng số cân
bằng của phản ứng xảy ra trong pin.
Trong một thí nghiệm khác, khi cho KCl(r) vào dung dịch AgNO3 của pin ban đầu
xảy ra sự kết tủa AgCl(r) và thay đổi sđđ. Sau khi thêm KCl(r), sđđ của pin bằng 1,04V và
nồng độ ion K+ bằng 0,300M.
a) Tính nồng độ mol của ion Ag+ tại cân bằng.
b) Tính nồng độ mol của ion Cl- và tích số tan của AgCl.
Cho biết: Eo (Zn2+/Zn) = -0,76V; Eo(Ag+/Ag) = +0,80V
Trong các tính toán, dùng nồng độ thay cho hoạt độ.
2. Trộn hai thể tích bằng nhau của hai dung dịch NaNO2 0,1M và I2 5.10-4M tạo thành dung dịch A.
a) Sau đó thêm hết 1 mL dung dịch NaOH 0,02M cùng một vài giọt hồ tinh bột (coi
thể tích hồ tinh bột thêm vào không đáng kể) vào 1 mL dung dịch A thì hồ tinh bột
có màu không? Giải thích trên cơ sở tính toán cụ thể.
b) Nếu thêm tiếp 2 mL dung dịch HCl 0,1M vào dung dịch thu được ở a) thì có biến
đổi gì nữa không? Giải thích trên cơ sở tính toán cụ thể.
Cho biết Eo (I2/2I-) = 0,536V ; Eo (NO3-/NO2-, OH-) = 0,01V ; Eo (NO2-/NO, H+) = 0,99V, Ka(HNO2) = 5,1.10-4
Câu 3 (2,5 điểm): Nhiệt hoá học – Cân bằng hoá học
1. Để xác định phân tử CaCl có bền vững về mặt nhiệt động hay không, người ta dựa trên
năng lượng mạng lưới hoặc nhiệt hình thành ΔfHo. Dựa vào các dữ liệu sau, tính ΔfHo của
CaCl theo chu trình Born – Haber:
Nhiệt nóng chảy (ΔfusHo) của Ca: 9,3 kJ mol-1
Năng lượng ion hóa thứ nhất (I1) của Ca: 589,7 kJ mol-1
Năng lượng ion hóa thứ hai (I2) của Ca: 1145,0 kJ mol-1
Nhiệt hóa hơi (ΔvHo) của Ca: 150,0 kJ mol-1
Năng lượng phân cắt liên kết (D0) của Cl2: 240,0 kJ mol-1
Nhiệt hình thành (ΔfHo) của CaCl2: -796,0 kJ mol-1
Ái lực electron (EA) của Cl: -349,0 kJ mol-1
Năng lượng mạng lưới (ΔLHo) của CaCl: -751,9 kJ mol-1
2. Để biết liệu CaCl có tự oxi hóa – khử tạo thành Ca và CaCl2 không, người ta cần tính
nhiệt của phản ứng này (biến đổi entropy ΔS rất nhỏ, có thể bỏ qua). Sự tự oxi hoá - khử
của CaCl có thể xảy ra về mặt nhiệt động hay không? Dùng kết quả tính toán để chứng minh.
3. Cho cân bằng hóa học:
N2 (k) + 3H2 (k) → 2NH3 (k) ; = - 46 kJ.mol-1 .
Nếu xuất phát từ hỗn hợp chứa N2 và H2 theo tỉ lệ số mol đúng bằng hệ số tỉ lượng 1: 3 thì
khi đạt tới trạng thái cân bằng (450oC, 300 atm) NH3 chiếm 36% thể tích.
a) Tính hằng số cân bằng KP (ghi rõ đơn vị nếu có).
b) Giữ áp suất không đổi (300 atm), cần tiến hành ở nhiệt độ nào để khi đạt tới trạng thái
cân bằng NH3 chiếm 50% thể tích? Giả sử
không thay đổi trong khoảng nhiệt độ nghiên cứu.
Câu 4 (2,5 điểm) Hóa nguyên tố (Kim loại, phi kim nhóm IVA, VA). Phức chất.
4.1. Chất A1 là chất khí ở điều kiện thường, có màu đỏ nâu. Khi làm lạnh A1 màu đỏ nâu
nhạt dần, sau một thời gian thu được khí A2 không màu. Khi cho A2 phản ứng với Na ở
điều kiện thích hợp thu được khí A3. Cho A3 tác dụng với H2, xúc tác Pd/C trong môi
trường HCl thu được hợp chất ion A4. Trung hòa A4 bằng dung dịch EtONa, ta thu được
A5. Khi cho A5 tác dụng với dung dịch NaClO thu được khí A6 (có tỉ khối so với H2 là
22). Mặt khác, khi oxi hóa A1 trong điều kiện thích hợp, thu được acid A7. Hỗn hợp của
một thể tích A7 và 3 thể tích HCl đặc có khả năng hòa tan Au. Trong phòng thí nghiệm,
A8 có thể được điều chế bằng cách dùng P2O5 làm mất nước A7. Cho A8 tác dụng với
H2O2 khan ở khoảng -80 °C, thu được A9.
Cho biết: - A1, A2, A3, A6,A8 là các oxide của nitrogen
- A5 và A9 chứa 3 nguyên tố, cả hai đều chứa 1 nguyên tử nitrogen phân
tử, %mN (A5) = 42,42% và %mN (A9) = 17,72%.
a. Xác định công thức hóa học của các chất từ A1 đến A9. Viết PTHH của các phản ứng xảy ra.
b. Vẽ công thức cấu tạo của A2, A7, A8, A9.
4.2. a. Vẽ các đồng phân có thể có cho các phức: [Ni(CN)2Br2]2- và [Co(H2O)2(ox)BrCl]−, với ox là −O2CCO2−.
b. Trong dung dịch OH- 1,0M của [Co(NH3)5Cl]2+ tồn tại cân bằng: [Co(NH3)5Cl]2+ + OH- [Co(NH3)4(NH2)Cl]+ + H2O.
Ở 25oC, tại thời điểm cân bằng xác định được rằng ít nhất 95% phức chất tồn tại ở dạng
axit [Co(NH3)5Cl]2+ Chứng minh [Co(NH3)5Cl]2+ là một axit rất yếu có Ka ≤ 5,26.10-16.
Câu 5. Đại cương hữu cơ(2.5đ)
1. Cho các dữ liệu pKa của một số axit cacboxylic như sau: Axit pKa1 pKa2 Axit oxalic 1,27 4,27 Axit malonic 2,86 5,70 Axit sucxinic 4,21 5,64 Axit glutaric 4,34 5,27
a) Tại sao các axit này mạnh hơn so với các axit monoankylcacboxylic tương ứng?
b) Giải thích chiều biến đổi pKa1; pKa2 khi số nguyên tử cacbon tăng.
2. Dạng proton hóa cao nhất của naphthalene-1,8-diamine có 2 giá trị pKa chênh lệch cực
lớn là -9 và 12. Hãy giải thích sự chênh lệch đáng kể này
3. Giải thích tại sao quá trình đóng vòng này mang lại ưu thế (3:1) của oxetan, mặc dù
tetrahydrofuran bền hơn nhiều.
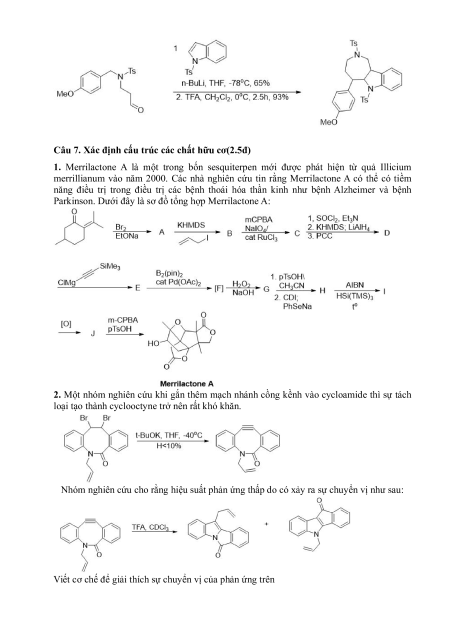
4. Các phản ứng được nêu trong giản đồ dưới đây là giai đoạn đầu trong quá trình tổng
hợp thuốc kháng vi-rút của công ty Parke-Davis. Hoàn thành quá trình tổng hợp sau và
trình bày cơ chế từ C ra D
Câu 6. Sơ đồ tổng hợp hữu cơ. Cơ chế phản ứng hữu cơ(2.5đ) a) b) c) d)
Đề thi HSG Hóa học 11 Trường THPT Chuyên Hưng Yên
547
274 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(547 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)