TRƯỜNG THPT CHUYÊN
ÐỀ THI ÐỀ XUẤT CHỌN HỌC SINH GIỎI HÙNG VƯƠNG -
CÁC TRƯỜNG THPT CHUYÊN KHU VỰC BÌNH DƯƠNG
DUYÊN HẢI VÀ ÐỒNG BẰNG BẮC BỘ NĂM 2024 ĐỀ THI ĐỀ XUẤT
ÐỀ THI MÔN: HÓA HỌC LỚP 11
Thời gian: 180 phút (Không kể thời gian giao ðề)
Câu 1: (2,5điểm). Động học phản ứng
1.1. Cho phản ứng: SO2Cl2(k) SO2(k) + Cl2(k)
Một bình kín thể tích không đổi chứa SO2Cl2(k) được giữ ở nhiệt độ 375K. Quá trình phân hủy SO2Cl2(k)
được theo dõi bằng sự thay đổi áp suất trong bình. Kết quả thu được như sau: Thời gian, t(s) 0 2500 5000 7500 10000 Áp suất, P(atm) 1,000 1,053 1,105 1,152 1,197
a. Chứng tỏ rằng phản ứng phân hủy SO2Cl2 là phản ứng bậc 1. Tính hằng số tốc độ của phản ứng ở 375K.
b. Nếu phản ứng trên được tiến hành ở 385K, áp suất của bình sau 1 giờ là 1,55 atm. Tính năng lượng hoạt
hóa của phản ứng phân hủy trên.
1.2. Một cơ chế phản ứng kiểu ion - phân tử trong quá trình tổng hợp amoniac ở vùng trong các đám mây
giữa các vì sao được cho dưới đây: N+ + H2 NH+ + H k1 NH+ + H2 NH2+ + H k2 NH2+ + H2 NH3+ + H k3 NH3+ + H2 NH4+ + H k4 NH4+ + e– NH3 + H k5 NH4+ + e– NH2 + 2H k6
a. Viết phương trình nguyên lý nồng độ dừng cho các tiểu phân trung gian NH+, NH2+, NH3+ và NH4+ phụ
thuộc vào nồng độ của [N+], [H2] và [e–]. Xem electron xử sự như một chất phản ứng bình thường.
b. Chứng minh rằng biểu thức tốc độ phản ứng tổng quát của sự hình thành amoniac có dạng như sau: [ d NH3] k2nd[N ][H2] dt
Với k2nd là hằng số vận tốc của phản ứng bậc hai. Viết biểu thức k2nd phụ thuộc vào các hằng số tốc độ
phản ứng của các bước sơ cấp từ k1 đến k6.
c. Tốc độ phản ứng của các ion-phân tử hoàn toàn độc lập với nhiệt độ, hãy cho biết năng lượng hoạt hóa
của phản ứng và điều kiện về nhiệt độ giữa các vì sao trong trường hợp này có gì đặc biệt. Câu 2: (2,5điểm)
2.1. Một dung dịch đệm phosphate có pH=6,50. Các hằng số phân li của H3PO4 là: pKa1=2,23, pKa2=7,21
và pKa3=12,32. Đầu tiên, hàm lượng photphat tổng cộng được xác định bằng phương pháp chuẩn độ
permanganate. Dung dịch đệm được acid hóa nhẹ bằng acetic acid, thêm tiếp amonium chloride. Tiếp đó
ion phosphate được kết tủa định lượng bằng dung dịch uranyl(VI)-acetate dưới dạng uranyl amonium
phosphate (NH4UO2PO4). Kết tủa được khử bằng Al trong môi trường H2SO4 thành U4+. Trong bước cuối
cùng U4+ được chuẩn độ bằng dung dịch KMnO4 thu được UO22+.
a)Trong phép chuẩn độ này, 10,00 mL dung dịch đệm cần dùng 13,34 mL dung dịch KMnO4 0,0200M để
đạt tới điểm tương đương. Tính tổng nồng độ các dạng phosphate có trong dung dịch đệm. 1
b)Xác định nồng độ mol/L của các cấu tử chứa phosphorus trong dung dịch đệm.
c) Nhược điểm chính của dung dịch đệm này là dễ dàng kết tủa với ion Ca2+ dưới dạng Ca3(PO4)2 (có pKs
= 26). Xác định nồng độ ion Ca2+ tối đa có trong dung dịch đệm này để không xuất hiện kết tủa.
2.2. Tính % khối lượng MgNH4PO4 bị mất đi khi rửa 1,37 gam hợp chất này bằng:
a. Cách 1: dùng 200ml nước cất.
b. Cách 2: dùng 150ml dung dịch NH4Cl 0,1M rồi bằng 50ml nước cất.
c. Hãy đưa ra đề xuất rửa tủa magnesium ammonium phosphate (Biết KsMgNH4PO4=2,5.10-13)
2.3. Xét pin điện hóa:
(-) Pt| I- 0,1M; I3- 0,02M║ MnO4- 0,05M, Mn2+ 0,01M, HSO4- CM| Pt(+) Trong đó 0 E = 1,51V; 0 E = 0,5355V; K 2 MnO a(HSO4-) = 10-2. 4 /Mn 3 I /3I
a. Viết nửa phản ứng tại anode và cathode.
b. Tính nồng độ ban đầu của HSO4-, biết rằng khi đo suất điện động của pin ở 25oC được giá trị là 0,824V.
Câu 3: (2,5điểm). Nhiệt hóa học và cân bằng hóa học
Trong bài này, tất cả các dữ kiện cho sẵn và được hỏi đều xét tại điều kiện tiêu chuẩn.
Nghiên cứu về hai hydrocarbon lỏng, là đồng phân của nhau, có cùng công thức phân tử C8H8:
cycloocta-1,3,5,7-tetraene và styrene (hay vinylbenzene). Đốt cháy hai hydrocarbon này trong bình nhiệt
lượng kế với oxygen dư, thu được hỗn hợp H2O lỏng và CO2 khí. Trong cả hai trường hợp, phản ứng cháy
được thực hiên bởi một sợi dây có nhiệt lượng cháy Qdây = -30.0 J.
Một trợ lý phòng nghiên cứu đã thực hiện thí nghiệm với hai mẫu chất trên(đánh dấu là A, B) và tiến hành
đo lường, viết kết quả rồi bỏ đi ăn trưa. Tuy nhiên, thật đáng tiếc là khi quay lại anh đã quên mất đâu là
chất A, đâu là chất B. Nhật kí thí nghiệm có lưu lại các kết quả sau: Hợp chất Khối lượng đầu m/g
Nhiệt lượng đo được Q/J A 0.7834 -34181 B 0.6548 -27623
Cho biết thêm: ΔfH° (H2O(l)) = - 285.8 kJ mol-1 và ΔfH° (CO2(g)) = - 393.5 kJ mol-1
a. Tính enthalpy cháy tiêu chuẩn ΔcHo của A, B.
b. Tính enthalpy tạo thành chuẩn ΔfHo của A, B. Trong trường hợp bạn không tính ra kết quả ở ý a, hãy sử
dụng các giá trị ΔcH°A = -4581 kJ.mol-1 và ΔcH°B= -4431 kJ.mol-1.
c. So sánh độ bền của A và B từ đó hãy gọi tên A và B.
Có thể ước lượng enthalpy cháy khi sử dụng phương pháp gia tăng. Như vậy nếu cho rằng một liên kết hay
một nhóm nguyên tử nhất định ở phase khí luôn đóng góp một đại lượng nhất định (ΔcHI°) vào nhiệt cháy
chung của chất đó không phụ thuộc vào môi trường hóa học xung quanh liên kết hay nhóm nguyên tử đó.
Đối với mỗi chất thì nhiệt hóa hơi hay thăng hoa bằng tổng các thành phần gia tăng ấy.
Giải thích rõ nghĩa hơn: chẳng hạn nhiệt cháy của nhóm methylen là 157,4 kJ. Tức nhóm methylen trong
propane hay trong ethanol đều góp 157,4 kJ vào nhiệt cháy, không phụ thuộc cấu trúc phân tử.
Ví dụ như tính toán cho hệ cycloctatetraene: 2
ΔcH° = 8·ΔcHI°(C-H) + 4 · ΔcHI°(C-C) + 4 · ΔcHI°(C=C) + ΔcHI°(Ring) + ΔvapH° =
= 8 · (-226.1) - 4 · (206.4) - 4 · (491.5) – 4.2 + 43.1 = = -4561.5 kJ Liên kết ΔcHI° / kJ mol-1 Liên kết ΔcHI° / kJ mol-1 C-H -226.1 C-C -206.4 -491.5 -484.4 C=C / C=C / Vòng -4.2
Nhiệt hóa hơi: ΔvapH°(styrene) = 43.5 kJ mol-1
d. Tính nhiệt cháy chuẩn của styrene dựa vào phương pháp gia tăng.
e. Với mỗi hydrocarbon, hãy tính năng lượng bền hóa dựa trên việc so sánh nhiệt cháy tính được và giá trị
đo được từ thực nghiệm. So sánh và giải thích về năng lượng bền hóa của cycloocta-1,3,5,7-tetraene và styrene.
Câu 4: (2,5 điểm). Hóa vô cơ, phức chất
4.1. Muối Zeise K[PtCl3(C2H4)] là hợp chất cơ kim, khi đo phổ người ta xác định được cấu trúc anion có trong muối này như sau:
Hãy vẽ cấu trúc của các phức sau: [PtCl2(C2H4)2], [Pt2Cl4(C2H4)2], biết các phối tử được sắp xếp theo chiều
giảm dần hiệu ứng trans là: C2H4 > Cl
4.2. Các chất lưỡng nguyên tố X, Y, W - chứa nguyên tố Z có đơn chất là chất khí nhẹ nhất ở điều kiện
chuẩn. Hàm lượng của nguyên tố nặng hơn trong X, Y, W lần lượt là 82.35%, 78.28% và 91.18%. X, Y,
W có công thức thực nghiệm tương tự nhau.
W và X không phản ứng trong điều kiện thường, nhưng khi X phản ứng với chất C thì thu được muối của
B - cũng có cation như trong muối của X1, được tạo thành từ phản ứng của X với hydrochloric acid. Muối
B là sản phẩm cộng của X, W, Y theo tỉ lệ mol 1:1:1. X và Y phản ứng với nhau tạo thành hợp chất D chứa một liên kết cho-nhận.
Chlor hóa Y tạo thành khí Y1 chứa cùng số nguyên tử như W. Phản ứng của Y với sodium hydride tạo
thành muối Y2 chứa cùng anion như muối A. Trong trường hợp này, từ 131 mL Y (ở 320 K và 1491,06
mm Hg) tạo ra 370 mg muối Y2. Muối này có thể được sử dụng để tạo thành chất D màu trắng bởi phản
ứng với X1 trong ether. Từ 1,31 g Y2 và một lượng đẳng mol X1 thu được sodium chloride và đơn chất
khí của Z nặng 0.069 g và D. Khi đun nóng, D mất khoảng 20% khối lượng, tạo thành chất lưỡng nguyên tố F. 3
Phản ứng của X và Y tạo thành hợp chất ion A, chứa một cation phức đơn điện tích, có cấu trúc tương tự
như anion của muối B. A phản ứng với X1 trong ether, tương tự Y2, tạo thành D và muối E - là chloride
của cation chứa trong A. Hàm lượng hydrogen và chlorine trong E lần lượt là 9.72% và 43.13%.
Chất W dễ bị oxi hóa bởi nhiều tác chất khác nhau. Khi W bị chlor hóa và fluor hóa, sẽ lần lượt tạo thành
các chloride W1 và fluoride W2 của cùng nguyên tố ở số oxi hóa cao hơn. Trong đó, hàm lượng của
nguyên tố này trong fluoride cao hơn 1.65 lần so với trong chloride. W1 kết hợp với Y1 tạo thành muối H,
với cation và anion có hình dạng giống nhau.
Khi fluor hóa X trên xúc tác đồng, được khí X2 cũng chứa số nguyên tử như trong W. Khi fluor hóa hỗn
hợp X2 và W2 theo tỉ lệ 1:1, thu được muối kì lạ K chứa 80.85% fluorine. Cation của muối K có 6 mặt
phẳng đối xứng và anion có 9 mặt phẳng đối xứng và có tâm đối xứng.
a. Xác định công thức các hợp chất X, Y, W, Z, X1, X2, Y1, Y2, W1, W2, A – K. Cho biết tỉ khối hơi của
X2 với không khí lớn hơn 2.
b. So sánh độ phân cực của các phân tử X, Y, W theo chiều tăng dần độ phân cực.
Câu 5 (2,5 đ). Đại cương hữu cơ
5.1 (0,5đ) a. Hợp chất 1 và 2 có sự khác biệt về nhiệt thu được khi cháy là 17,2 kJ/mol.
Xác định hợp chất nào có nhiệt cháy │ΔHcháy│cao hơn. Giải thích.
b. So sánh nhiệt hiđro hóa của các hợp chất A1, A2, A3, A4, A5 (sắp xếp theo giá trị │ΔHcháy│tăng
dần) và giải thích ngắn gọn.
5.2. Nguyên tử nitơ trong phân tử amin có thể đóng vai trò như một trung tâm bất đối (ví dụ phân tử C).
Tuy nhiên trên thực tế, hợp chất C không quang hoạt do 2 dạng đối quang của C luôn tồn tại cân bằng
chuyển hóa giữa hai dạng. Sự chuyển hóa giữa 2 dạng đối quang có hàng rào năng lượng là Go > 0.
a) Sử dụng hình ảnh orbital nguyên tử mô tả cơ chế sự chuyển hóa giữa hai dạng đối quang của C.
b) So sánh hàng rào năng lượng (Ea) sự chuyển hóa giữa hai dạng (tương tự như chất C) của các cặp chất:
5.3. Sắp xếp theo chiều tăng dần tính bazơ của các hợp chất sau và giải thích ngắn gọn:
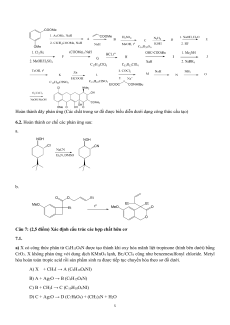
Câu 6 (2,5đ). Sơ đồ tổng hợp hữu cơ. Cơ chế phản ứng
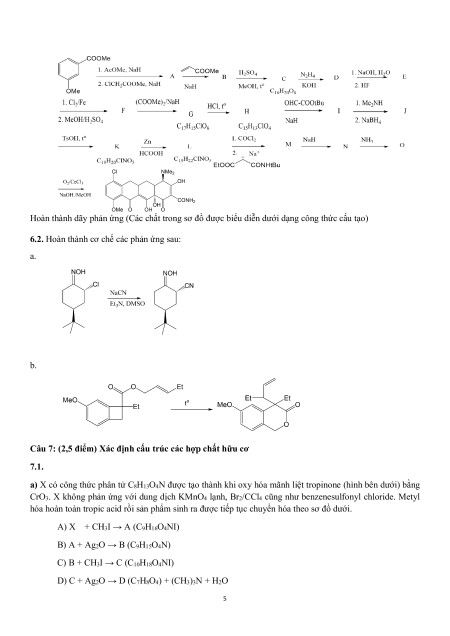
6.1. Sơ đồ cho dưới đây được dùng để tổng hợp một loại thuốc kháng sinh trong nhóm tetracycline. 4
Đề thi HSG Hóa học 11 Trường THPT Chuyên HV - Bình Dương
776
388 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(776 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)