HỘI CÁC TRƯỜNG CHUYÊN HƯỚNG DẪN CHẤM
VÙNG DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ
ĐỀ THI MÔN HÓA HỌC - KHỐI 11
TRƯỜNG THPT CHUYÊN LÊ THÁNH TÔNG NĂM 2024 QUANG NAM Thời gian: 180 phút
HDC ĐỀ THI ĐỀ XUẤT Câu 1. (2,5 điểm)
1.1. Xét động học của một quá trình sau đây:
Giả sử rằng nguyên lý nồng độ ổn định có thể áp dụng được cho hệ thống trên. Hãy xác định
nồng độ của ba tiểu phân K, L, M tại trạng thái cân bằng. Biết rằng k1 = 0,20s-1; k2 = 0,5s-1 và k3
= 1s-1. Tổng nồng độ ba chất là 3M.
1.2. Dưới đây là cơ chế được đề xuất cho phản ứng bromo hóa acetone:
Có thể ngăn chặn sản phẩm polybromide bằng cách sử dụng lượng thừa acetone. Do bromine có
màu nên tốc độ phản ứng có thể được xác định dựa vào phương pháp trắc quang. Tiến hành thí
nghiệm 1 bằng cách trộn lẫn 0,15 mol acetone, 20cm3 HCl 1M và 50cm3 nước, sau đó thêm vào
1cm3 dung dịch bromine bão hòa (0,2 M) và đo độ hấp thụ quang ở 20oC tại bước sóng 450 nm
trong những khoảng thời gian xác định. Thí nghiệm 2 cũng được tiến hành với lượng tương tự,
chỉ thay acetone bằng hexadeuteroacetone (0,15mol). Biết trong cả hai thí nghiệm độ dày cuvette
đo là 1cm. Kết quả của hai thí nghiệm được cho ở trong bảng.
a) Xác định bậc của bromine trong phản ứng trên. Tính giá trị các hằng số tốc độ kH và kD. Cho
rằng nồng độ bromine tuân theo định luật Lambert – Beer và hệ số hấp thụ mol của dung dịch
nước bromine là ε = 100 M-1.cm-1.
b) Xác định giá trị của tỉ số đồng vị kH/kD và tính sự chênh lệch năng lượng hoạt hóa giữa hai
phản ứng. Cho rằng đối với cả hai phản ứng thừa số trước mũ là như nhau.
c) Giai đoạn nào quyết định tốc độ phản ứng? Giải thích ngắn gọn.
d) Tiến hành phản ứng monobromo hóa pentadeuteroacetone trong cùng điều kiện. Hãy tính phần
mol của tất cả các sản phẩm monobrom hóa có thể có trong hỗn hợp sau phản ứng.
e) Thay vì sử dụng cặp đồng vị D/H thì các nhà nghiên cứu quyết định sử dụng đồng vị 13C thay
cho 12C để khảo sát hiệu ứng đồng vị động học. Liệu có thể quan sát thấy hiệu ứng đồng vị
động học trong trường hợp này hay không? Biết rằng tỉ số k13C/ k12C tương ứng với tỉ lệ khối
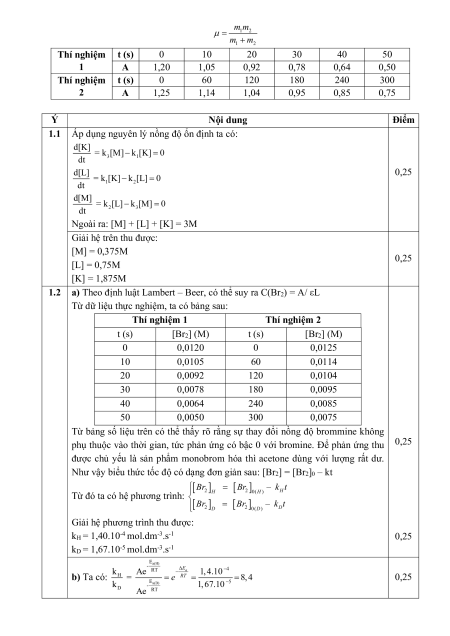
lượng rút gọn của liên kết đang xét. Khối lượng rút gọn được tính theo công thức: m m 1 2 m m 1 2 Thí nghiệm t (s) 0 10 20 30 40 50 1 A 1,20 1,05 0,92 0,78 0,64 0,50 Thí nghiệm t (s) 0 60 120 180 240 300 2 A 1,25 1,14 1,04 0,95 0,85 0,75 Ý Nội dung Điểm
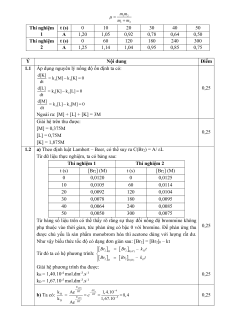
1.1 Áp dụng nguyên lý nồng độ ổn định ta có: d[K] = k [M]k [K] 0 3 1 dt d[L] 0,25 = k [K] k [L] 0 1 2 dt d[M] = k [L]k [M] 0 2 3 dt
Ngoài ra: [M] + [L] + [K] = 3M
Giải hệ trên thu được: [M] = 0,375M 0,25 [L] = 0,75M [K] = 1,875M
1.2 a) Theo định luật Lambert – Beer, có thể suy ra C(Br2) = A/ εL
Từ dữ liệu thực nghiệm, ta có bảng sau: Thí nghiệm 1 Thí nghiệm 2 t (s) [Br2] (M) t (s) [Br2] (M) 0 0,0120 0 0,0125 10 0,0105 60 0,0114 20 0,0092 120 0,0104 30 0,0078 180 0,0095 40 0,0064 240 0,0085 50 0,0050 300 0,0075
Từ bảng số liệu trên có thể thấy rõ rằng sự thay đổi nồng độ brommine không
phụ thuộc vào thời gian, tức phản ứng có bậc 0 với bromine. Để phản ứng thu 0,25
được chủ yếu là sản phẩm monobrom hóa thì acetone dùng với lượng rất dư.
Như vậy biểu thức tốc độ có dạng đơn giản sau: [Br2] = [Br2]0 – kt Br Br – k t 2 H 2
Từ đó ta có hệ phương trình: 0(H ) H Br Br – k t 2 D 2 0(D) D
Giải hệ phương trình thu được: kH = 1,40.10-4 mol.dm-3.s-1 0,25 kD = 1,67.10-5 mol.dm-3.s-1 Ea(H) - RT a E 4 b) Ta có: k Ae 1,4.10 H = RT e 8,4 0,25 Ea(D) 5 k - 1,67.10 D RT Ae kH ΔE = E E RTln 5,2kJ/mol 0,25 a a(H) a(D) kD
c) Do có sự chênh lệch lớn về tỉ số đồng vị có nghĩa giai đoạn cắt đứt liên kết
C-H (hay C-D) quyết định tốc độ phản ứng, tức giai đoạn 2. Cũng có thể giải 0,25
thích bằng nguyên lí nồng độ ổn định cho trung gian enol, sau đó đưa về biểu
thức động học bậc 0 với giả định giai đoạn 3 xảy ra rất nhanh hơn so với giai đoạn 2.
d) Khi monobrom hóa pentadeuteroacetone có thể thu được một số chất sau:
CD3COCD2Br, CD3COCDHBr (hỗn hợp RS), BrCD2COCD2H. Khi tính lượng
mỗi thành phần phải chú ý đến số nguyên tử D. Như vậy cứ mỗi một phân tử
CD3COCD2Br được hình thành thì số phân tử của hai chất còn lại sẽ là:
N(CD3COCDHBr) = (2 . 1)/8,4 = 0,24 0,25
N(BrCD2COCD2H) = (3 . 1)/8,4 = 0,36
Có nghĩa rằng hàm lượng của mỗi chất theo phần mol sẽ là:
CD3COCD2Br = 0,625; CD3COCDHBr = 0,150 và BrCD2COCD2H = 0,225. 0,25
e) Theo cơ chế phản ứng, giai đoạn quyết định tốc độ là giai đoạn 2, ở đó có sự
cắt đứt liên kết C-H. Áp dụng biểu thức tính khối lượng rút gọn cho liên kết này thì: 121 12 131 13 k C CH 14 ; 13 13 1,17 12 13 CH 12 1 13 CH 131 14 k 12 12 12 C CH
Như vậy tốc độ của hai phản ứng lúc này xấp xỉ nhau nên không thể quan sát 0,25
được hiệu ứng đồng vị động học Câu 2. (2,5 điểm)
2.1. Để xác định độ dinh dưỡng của một mẫu phân bón amophos gồm NH4H2PO4, (NH4)2HPO4
và có lẫn tạp chất trơ (gọi là mẫu X), người ta hòa tan hoàn toán 1,764 gam mẫu X vào nước cất.
Lọc bỏ tạp chất, định mức thành 100,0mL thu được dung dịch Y.
Tiến hành 2 thí nghiệm sau:
+ Thí nghiệm 1: Chuẩn độ 10,0mL dung dịch Y bằng dung dịch HCl 0,100M đến khi đổi màu chỉ thị thị hết 6,00mL.
+ Thí nghiệm 2: Thêm chính xác 20,0mL dung dịch KOH 0,2M (dư) vào 10,00mL dung dịch Y,
thu được dung dịch Z. Đun sôi dung dịch Z để đuổi hết khí NH3 rồi để nguội thu được dung dịch
T. Chuẩn độ dung dịch T bằng dung dịch HCl 0,100M đến khi đổi màu chỉ thị thymolphtalein (pT = 9,4) thì hết 14,0mL.
a) Cho một số dụng cụ chính sử dụng cho phép chuẩn độ bao gồm bình tam giác (bình chuẩn
độ), pipet và burret đều mới chỉ được tráng rửa bằng nước máy. Trước khi sử dụng cần
tráng rửa lại các dụng cụ này. Hãy trình bày ngắn gọn cách tráng rửa các dụng cụ đó (chỉ
cần nêu tráng rửa bằng gì và thứ tự tráng rửa của từng dụng cụ).
b) Trình bày ngắn gọn cách thực hiện pha dung dịch Y.
c) Chất nào trong bảng sau đây phù hợp nhất để làm chỉ thị trong thí nghiệm 1? Cho biết sự
đổi màu tại điểm kết thúc chuẩn độ tương ứng với việc sử dụng chỉ thị đó. Chất chỉ thị pH đổi màu (pT) Màu dạng acid Màu dạng base Methyl da cam 4,0 Đỏ Vàng Methyl đỏ 5,0 Đỏ Vàng Bromthymol xanh 6,0 Vàng Xanh Phenolphtalein 8,0 Không màu Hồng Alizarin vàng 10,2 Vàng Đỏ
d) Chấp nhận bỏ qua sai số chuẩn độ, hãy tính độ dinh dưỡng của mẫu phân bón amophos nói trên.
e) Trong thí nghiệm 2, tại sao không thể chuẩn độ trực tiếp dung dịch Z bằng dung dịch HCl
với chỉ thị thymolphtalein?
Cho biết H3PO4 có pKa1, pKa2, pKa3 lần lượt là 2,15; 7,21; 12,32; NH4+ có pKa = 9,24.
2.2. Gần đây, nghiên cứu về một loại acquy thuận nghịch mới đã được công bố. Điện cực âm của
loại pin này là kim loại nhôm, còn điện cực dương là Cn[AlCl4], trong đó Cn là graphite, dung
dịch điện li là chất lỏng ion tạo thành từ imidazolium cation thế alkyl (R+) và AlCl4- anion. Khi
pin xả điện, có sự tạo thành một phức hai nhân ở gần cực âm. Trong quá trình nạp điện và xả điện,
cation trong chất lỏng ion luôn không thay đổi.
a) Viết phương trình phản ứng xảy ra ở cực dương, cực âm và trong cả acquy khi xả điện.
b) Graphite (than chì) được tạo thành theo phương pháp sau: methane bị nhiệt phân khi có mặt
một lượng lớn hydrogen, tạo thành carbon bám trên bề mặt nickel bọt. Viết phương trình
phản ứng nhiệt phân methane. Mục đích của việc sử dụng nickel bọt là gì? Giải thích ngắn gọn.
c) Viết phương trình phản ứng của nickel sau khi graphite được tạo thành.
d) Dung dịch điện li của acquy được điều chế bằng cách hòa tan aluminum trichloride khan
vào hydrocarbon trong chất lỏng ion imidazole chloride. Viết phương trình phản ứng. Ý Nội dung Điểm
2.1 a) Bình tam giác (bình chuẩn độ): tráng rửa bằng nước cất. 0,125
Pipette: tráng rửa bằng nước cất rồi tráng lại bằng chính dung dịch được hút 0,125 bằng pipette
Burette: tráng rửa bằng nước cất rồi tráng bằng chính dung dịch được đựng 0,125 trong burette
b) + Lấy một cốc thủy tinh có mỏ đã được rửa sạch và sấy khô. Cân cốc thủy 0,125
tinh bằng cân điện tử, hiệu chỉnh cân về 0,000 gam. Thêm từ từ mẫu chất X
vào cốc thủy tinh đến khối lượng mong muốn (1,764 gam). Chờ cân ổn định,
ghi lại khối lượng chất X.
+ Thêm lượng nước cất vào cốc thủy tinh để hòa tan chất X. Chuyển chất lỏng 0,125
trong cốc thủy tinh vào bình định mức có dung tích 100mL. Dùng nước cất
trong bình tia tráng lại cốc thủy tinh ít nhất 4 lần. Thêm nước cất đến gần vạch
định mức rồi dùng công tơ hút nhỏ từng giọt nước cất đến vạch định mức.
+ Đậy nắp, lắc để trộn đều. 0,125
c) Thành phần tại điểm tương đương trong thí nghiệm 1 là: H2PO4- và NH4+.
pH tương đương ~(pKa1 + pKa2)/2 = 4,68
Chỉ thị phù hợp nhất là methyl đỏ. 0,125
Sự đổi màu tại điểm kết thúc chuẩn độ là từ màu da cam sang màu đỏ. 0,125
(Nếu HS nêu đổi từ màu vàng sang màu đỏ thì vẫn cho đủ điểm)
Đề thi HSG Hóa học 11 Trường THPT Chuyên Lê Thánh Tông - Quảng Nam
590
295 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(590 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)