SỞ GIÁO DỤC – ĐÀO TẠO THÁI BÌNH
ĐỀ ĐÓNG GÓP CHO KỲ THI C10
TRƯỜNG THPT CHUYÊN THÁI BÌNH
Môn Hoá học lớp 11 *****
Năm học : 2023-2024
Thời gian làm bài: 180 phút (Đề gồm trang)
Bài 1: (2.5 điểm) Động học
Cơ chế phản ứng xà phòng hóa methyl acetate được mô tả như sau:
Phản ứng có bậc động học bằng 2: Trong đó:
c(OH-): Nồng độ của ion hydroxide tại thời điểm 𝑡
c(E): Nồng độ ester tại thời điểm
𝑡 c(AcO-): Nồng độ acetate ion tại thời điểm 𝑡
k: Hằng số tốc độ tổng của phản ứng.
1. Chứng minh biểu thức định luật tốc độ phản ứng (sử dụng phương pháp gần đúng trạng thái
dừng). Cho biết với điều kiện nào thì k trở thành k1.
2. Giải thích tại sao phản ứng thủy phân trong môi trường acid không có bậc 2 giống như phản ứng xà phòng hóa.
Để theo dõi tiến trình của phản ứng xà phòng hóa, người ta theo dõi độ dẫn điện κ của dung
dịch phản ứng theo thời gian. Chuẩn bị 6 dung dịch chứa NaOH và NaOAc có nồng độ khác
nhau. Độ dẫn điện của các dung dịch đo được cho ở bảng sau: Dung c(NaOAc), c(NaOH), κ, mS.cm-1 dịch M M 1 0 0,125 2,180 2 0,025 0,100 1,861 3 0,050 0,075 1,574 4 0,075 0,050 1,271 5 0,100 0,025 0,976 6 0,125 0 0,689
3. Tại sao tổng nồng độ hai cấu tử trong các thí nghiệm phải là hằng số và giải thích dung dịch 1
có độ dẫn điện cao hơn đáng kể so với dung dịch 6.
4. Xây dựng mối quan hệ giữa nồng độ ion OH- và độ dẫn điện κ.
Xét 20 ml dung dịch methyl acetate 0,25M được thêm vào 20 ml dung dịch NaOH 0,25M. Cứ
sau khoảng thời gian 30s, tiến hành đo độ dẫn điện của dung dịch phản ứng. Kết quả đo độ dẫn điện cho ở bảng sau: t(s) 0 30 60 90 120 15 18 210 24 0 0 0 κ, 2, 2,1 2,0 1,97 1,90 1,8 1,8 1,7 1,7 mS.cm-1 17 1 3 5 1 6 2
5. Tính hằng số tốc độ k của phản ứng xà phòng hóa.
6. Nếu thực hiện phản ứng xà phòng hóa với ester propyl acetate thì hằng số tốc độ phản ứng cao
hơn hay thấp hơn trường hợp xà phòng hóa ester methyl acetate. Giải thích.
Bài 2: (2.5 điểm) Cân bằng dung dịch điện li - Pin - Điện phân
Lithium cobalt oxide và carbon (graphite) là các thành phần hoạt động tương ứng với
điện cực dương và điện cực âm của pin lithium có thể sạc lại được. Trong chu trình phóng
điện/nạp điện, lithium được đan xen vào mạng lưới tinh thể của vật liệu tạo thành cả hai điện cực.
Các bán phản ứng thuận nghịch diễn ra như sau: (1) C6 + Li+ + e ⇌ LiC6
(2) 2Li0,5CoO2 + Li+ + e ⇌ 2LiCoO2
a) Khi pin phóng điện, viết phương trình phản ứng tại các điện cực và chỉ rõ quá trình oxi hóa,
khử xảy ra ở các điện cực. Tính sức điện động của pin.
b) Năng lượng của pin có thể dự trữ (dung lượng pin) được đánh giá theo đơn vị mAh. Một pin có
dung lượng 1500 mAh có thể cung cấp cho 1 thiết bị điện với dòng điện 100 mA trong 15 giờ.
Lithium đan xen vào các hốc của graphite, ở giữa các lớp của graphite. Giả sử tỉ lệ carbon và
lithium đan xen tối đa là 6:1. Tính dung lượng lí thuyết (theo mAh.g1) của 1,00 g graphite.
c) Một nhà sản xuất cung cấp các pin trong đó chứa 1,00 cm3 graphite (ρ = 2,25 g.cm3) và 1,30
cm3 LiCoO2 (ρ =4,8 g.cm3). Cho: Li = 6,941; Co = 58,933; O = 16; C = 12.
Tính tổng năng lượng (theo kJ) mà pin này có thể cung cấp theo lí thuyết.
d) Để giảm khối lượng và kích cỡ của pin, một khả năng được nghiên cứu là thay thế graphit
bằng kim loại lithium. Trong một thí nghiệm, người ta sử dụng một miếng lithium 0,5 cm3 (ρ =
0,5 g.cm3) và 1,3 cm3 LiCoO2 tối đa có thể được hình thành khi pin phóng điện hoàn toàn.
Tính tổng năng lượng theo (theo kJ) mà pin này có thể cung cấp theo lí thuyết.
Bài 3: (2.5 điểm) Nhiệt hóa học và cân bằng pha khí
Các chất hoạt động bề mặt bao gồm các phân tử có một đầu ưa nước và một đầu kị nước. Trong
nước, chúng có thể tạo thành các mixen (mixen là một khối hình cầu do nhiều phân tử chất hoạt
động bề mặt tập hợp thành, trong đó các đuôi kị nước của các phân tử hướng vào lõi hình cầu
còn đầu ưa nước hướng ra ngoài. Một phân tử hoạt động bề mặt nhìn chung có thể được mô hình
hoá như hình vẽ ở bên. Trong đó, vòng tròn biểu thị đầu phân
cực (K) và hình chữ nhật biểu thị đuôi không phân cực (S) của phân tử
(ví dụ: C12H25(OCH2CH2)5OH là một chất hoạt động bề mặt).
Các phân tử chất hoạt động bề mặt có thể kết tụ lại với nhau dưới dạng mixen nếu nồng độ của
chúng vượt qua nồng độ mixen tới hạn (CK). Ở nồng độ nhỏ hơn nồng độ tới hạn CK, chỉ có dạng
monomer tồn tại. Ngay khi đạt tới giá trị CK, các chất hoạt động bề mặt được thêm vào sau đó tạo
thành mixen. Nồng độ của monomer là độc lập với CK bất kể bao nhiêu chất hoạt động bề mặt được thêm vào.
Dung dịch chuẩn của chất hoạt động bề mặt C12H25(OCH2CH2)5OH (A) 0,500 mol L‒1. Nồng độ
này lớn hơn giá trị CK. Lấy 8,00⋅10‒3 cm3 dung dịch chuẩn A vào một nhiệt lượng kế chứa 100
cm3 nước, thì nhiệt độ trong bình nhiệt lượng kế tăng 1,25⋅10‒4 K. Nhiệt dung của nhiệt lượng kế
bao gồm 100 cm3 nước là 452 J K‒1, nhiệt độ ban đầu trong bình là 298 K.
a) Tính lượng nhiệt giải phóng ra trong bình nhiệt lượng kế.
Tiếp tục lấy 8,00⋅10‒3 cm3 dung dịch A thêm vào nhiệt lượng kế. Nhiệt độ lúc này chỉ tăng thêm
0,74⋅10‒4 K. Phần thứ ba được thêm vào không làm tăng nhiệt độ.
b) Giải thích nguyên nhân cho hiện tượng thay đổi nhiệt độ khác nhau ở ba lần trên khi thêm
cùng một thể tích (ở mỗi lần) của dung dịch chuẩn.
c) Tính giá trị CK của chất hoạt động bề mặt. Giá trị
được tính theo công thức:
với C0 = 1,00 mol L‒1.
d) Tính giá trị ΔG0 và ΔS0 của quá trình chuyển hoá A(monomer) thành A(mixen).
Trong quá trình tính toán chấp nhận thể tích nước không thay đổi đáng kể khi thêm A vào nhiệt lượng kế.
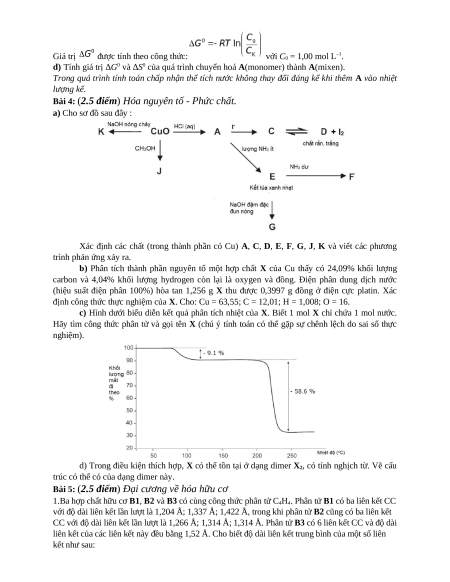
Bài 4: (2.5 điểm) Hóa nguyên tố - Phức chất.
a) Cho sơ đồ sau đây :
Xác định các chất (trong thành phần có Cu) A, C, D, E, F, G, J, K và viết các phương trình phản ứng xảy ra.
b) Phân tích thành phần nguyên tố một hợp chất X của Cu thấy có 24,09% khối lượng
carbon và 4,04% khối lượng hydrogen còn lại là oxygen và đồng. Điện phân dung dịch nước
(hiệu suất điện phân 100%) hòa tan 1,256 g X thu được 0,3997 g đồng ở điện cực platin. Xác
định công thức thực nghiệm của X. Cho: Cu = 63,55; C = 12,01; H = 1,008; O = 16.
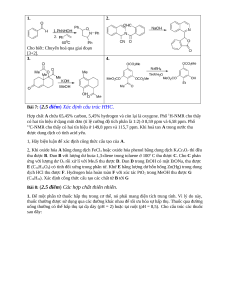
c) Hình dưới biểu diễn kết quả phân tích nhiệt của X. Biết 1 mol X chỉ chứa 1 mol nước.
Hãy tìm công thức phân tử và gọi tên X (chú ý tính toán có thể gặp sự chênh lệch do sai số thực nghiệm).
d) Trong điều kiện thích hợp, X có thể tồn tại ở dạng dimer X2, có tính nghịch từ. Vẽ cấu
trúc có thể có của dạng dimer này.
Bài 5: (2.5 điểm) Đại cương về hóa hữu cơ
1.Ba hợp chất hữu cơ B1, B2 và B3 có cùng công thức phân tử C4H4. Phân tử B1 có ba liên kết CC
với độ dài liên kết lần lượt là 1,204 Å; 1,337 Å; 1,422 Å, trong khi phân tử B2 cũng có ba liên kết
CC với độ dài liên kết lần lượt là 1,266 Å; 1,314 Å; 1,314 Å. Phân tử B3 có 6 liên kết CC và độ dài
liên kết của các liên kết này đều bằng 1,52 Å. Cho biết độ dài liên kết trung bình của một số liên kết như sau: Loại liên kết C- C= C≡ C C C Độ dài liên kết (Å) 1, 1,3 1,2 54 3 0
a. Hãy đề xuất công thức cấu tạo của B1, B2 và B3 phù hợp với các dữ kiện thực nghiệm trên
và chỉ ra các giá trị độ dài liên kết tương ứng với liên kết nào (không cần giải thích)?
b. Nêu nguyên nhân sự khác nhau về độ dài liên kết CC trong phân tử B2.
2.So sánh tính acid của nguyên tử hydrogen (được in đậm) ở các chất trong mỗi nhóm sau và giải thích:
a. Nhóm 1: C1, C2 và C3;
b. Nhóm 2: D1, D2 và D3.
3.Cho các hợp chất sau:
a. So sánh tính base của cặp chất E1, E2 và giải thích.
b. So sánh khả năng tham gia phản ứng với KOH/EtOH theo cơ chế E2 của các chất F1, F2, F3 và giải thích.
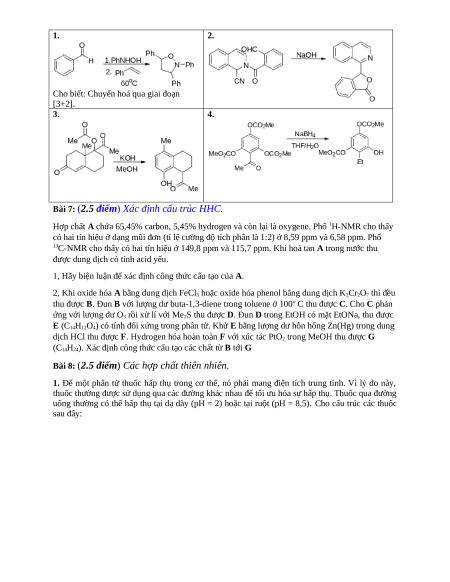
Bài 6: (2.5 điểm) Sơ đồ hóa hữu cơ – Cơ chế phản ứng
1. Calothrixin A, lần đầu tiên được phân lập từ vi khuẩn lam thuộc chi Calothrix vào năm 1999,
được đặc trưng bởi lõi indolo[3,2-j]phenanthridine độc đáo, mang các gốc indole, quinoline và
quinon. Hợp chất này ức chế chủng sốt rét kháng chloroquinone ký sinh trùng Plasmodium
falciparumand cho thấy khả năng chống tăng sinh đặc tính chống lại một số dòng tế bào ung thư
cũng như con người. Calothrixin A được tổng hợp như sau:
Hoàn thành cấu trúc các chất chưa biết.
2. Đề xuất cơ chế cho các chuyển hóa sau:
Đề thi HSG Hóa học 11 Trường THPT Chuyên Thái Bình
656
328 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(656 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)