TRƯỜNG THPT CHUYÊN
KỲ THI HỌC SINH GIỎI CÁC TRƯỜNG THPT THÁI NGUYÊN
CHUYÊN KHU VỰC DUYÊN HẢI VÀ ĐỒNG BẰNG -------------------
BẮC BỘ LẦN THỨ XV
Môn thi: HÓA HỌC - LỚP 11
ĐÁP ÁN ĐỀ ĐỀ NGHỊ NĂM HỌC 2023 - 2024
Thời gian: 180 phút (không kể thời gian giao đề)
Câu 1. Động hóa học (2,5 điểm)
Azomethane có công thức phân tử C2H6N2. Trong một phân tử azomethane, có hai
nguyên tử nitrogen liên kết với nhau và mỗi nguyên tử nitrogen liên kết với một nhóm methyl.
1) Vẽ cấu trúc Lewis của phân tử azomethane. Kí hiệu các nhóm methyl là CH3.
2) Cho biết các đồng phân lập thể khả dĩ của azomethane.
Azomethane dễ bị phân huỷ tạo thành ethane và nitrogen: C2H6N2 (g) → C2H6(g) + N2(g)
Để khảo cứu về động học phản ứng trên, cho một lượng azomethane vào bình phản
ứng có thể tích không đổi và đo áp suất buồng theo thời gian. t (phút) 10,0 21,0 35,0 ∞ P 5 5 5 5 tổng (Pa) 0,656 ⅹ 10 0,732 ⅹ 10 0,813 ⅹ 10 1,144 ⅹ 10
Tại t = ∞, azomethane đã phân huỷ hoàn toàn.
3) Chứng minh rằng quá trình phân huỷ của azomethane tuân theo quy luật động học
bậc một. Tính hằng số tốc độ k của phản ứng tại nhiệt độ này.
4) Cần có thêm dữ kiện nào để có thể tính năng lượng hoạt hoá phản ứng? Hướng dẫn chấm Nội dung Điể m 1) 4/8
2) Nguyên tử nitrogen có dạng hình học tam giác phẳng. 4/8
Các liên kết đôi làm cho các nguyên tử N không thể quay tự do quanh trục/ các nối
đâu có cấu trúc cứng nhắc, nên hợp chất này sẽ tồn tại ở dạng đồng phân cis- trans, lần lượt là:
3) Giả sử phản ứng tuân theo động học bậc một, ta có: 1
Với chất khí nồng độ trong biểu thức trên sẽ ứng với áp suất riêng phần, ta có: 1/8
Từ 1 mol khí tạo thành 2 mol khí, do đó: 1/8
Tại thời điểm t trong phản ứng, áp suất riêng phần của C2H6N2 giảm x Pa thì áp
suất riêng phần của C2H6 và N2 tăng x Pa, và khi đó áp suất tổng là (0,572 × 105 + x) Pa, do đó: 2/8 Sau 10,0 phút, p tổng = P 5 5
tổng = 0,656 ⅹ 10 Pa, do đó x = 0,656 ⅹ 10 – 0,572 ⅹ 105 = 0,084 ⅹ 105 Pa và 2/8 2/8 2/8
4) Cần phải có giá trị hằng số tốc độ ở một nhiệt độ khác để có thể áp dụng 2/8 phương trình Arrhenius. 2
Câu 2. Cân bằng trong dung dịch. Pin điện – điện phân (2,5 điểm)
1) Copper bisglycinate (hay copper(II) glycinate) được sử dụng làm chất bổ sung
đồng trong chế độ ăn uống. Đây là một trong rất nhiều phức chất của kim loại với
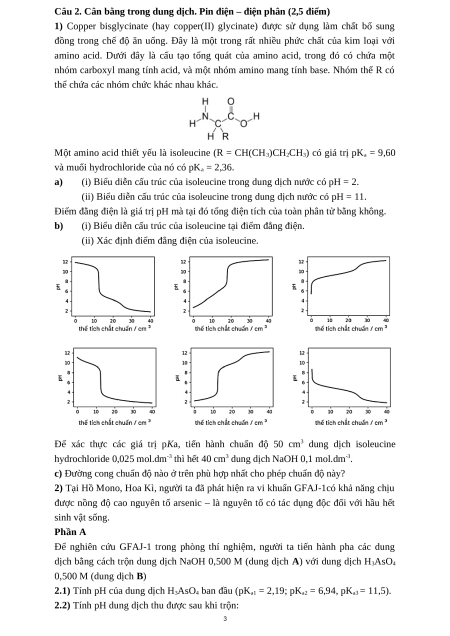
amino acid. Dưới đây là cấu tạo tổng quát của amino acid, trong đó có chứa một
nhóm carboxyl mang tính acid, và một nhóm amino mang tính base. Nhóm thế R có
thể chứa các nhóm chức khác nhau khác.
Một amino acid thiết yếu là isoleucine (R = CH(CH3)CH2CH3) có giá trị pKa = 9,60
và muối hydrochloride của nó có pKa = 2,36. a)
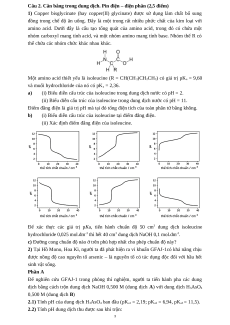
(i) Biểu diễn cấu trúc của isoleucine trong dung dịch nước có pH = 2.
(ii) Biểu diễn cấu trúc của isoleucine trong dung dịch nước có pH = 11.
Điểm đằng điện là giá trị pH mà tại đó tổng điện tích của toàn phân tử bằng không. b)
(i) Biểu diễn cấu trúc của isoleucine tại điểm đẳng điện.
(ii) Xác định điểm đẳng điện của isoleucine.
Để xác thực các giá trị pKa, tiến hành chuẩn độ 50 cm3 dung dịch isoleucine
hydrochloride 0,025 mol.dm-3 thì hết 40 cm3 dung dịch NaOH 0,1 mol.dm-3.
c) Đường cong chuẩn độ nào ở trên phù hợp nhất cho phép chuẩn độ này?
2) Tại Hồ Mono, Hoa Kì, người ta đã phát hiện ra vi khuẩn GFAJ-1có khả năng chịu
được nồng độ cao nguyên tố arsenic – là nguyên tố có tác dụng độc đối với hầu hết sinh vật sống. Phần A
Để nghiên cứu GFAJ-1 trong phòng thí nghiệm, người ta tiến hành pha các dung
dịch bằng cách trộn dung dịch NaOH 0,500 M (dung dịch A) với dung dịch H3AsO4 0,500 M (dung dịch B)
2.1) Tính pH của dung dịch H3AsO4 ban đầu (pKa1 = 2,19; pKa2 = 6,94, pKa3 = 11,5).
2.2) Tính pH dung dịch thu được sau khi trộn: 3
a) 10,00 mL dung dịch A và 10,00 mL dung dịch B;
b) 15,00 mL dung dịch A và 10,00 mL dung dịch B;
c) 30,00 mL dung dịch A và 10,00 mL dung dịch B.
Thêm một lượng thể tích xác định dung dịch A và B vào trong bình định mức với thể
tích 100,00 mL. Sau đó thêm vào nước cất đến vạch và trộn kĩ. Kết quả thu được
dung dịch C với pH = 10,4 và tổng nồng độ As(V) là 0,040 M.
2.3) Tính nồng độ cân bằng [AsO43-], [HAsO 2- -
4 ], [H2AsO4 ] trong dung dịch C.
2.4) Tính thể tích (mL) dung dịch A và B đã được dùng để pha dung dịch C. Phần B
Một trong những phương pháp mà các doanh nghiệp luyện kim sử dụng để loại bỏ
arsenic khỏi nước thải là kết tủa chúng dưới dạng Ca3(AsO4)2 (Ksp = 7,24.1022).
Nhược điểm của việc dùng phương pháp này là độ tan của Ca3(AsO4)2 còn phụ thuộc
đáng kể vào pH, do đó mà khi điều kiện bên ngoài thay đổi cũng có thể khiến
Ca3(AsO4)2 trở thành nguồn arsenic gây ô nhiễm môi trường.
2.5) Đưa ra biểu thức tính độ tan của Ca3(AsO4)2 theo tích số tan của nó, hằng số
phân li của H3AsO4 và pH dung dịch.
Cho 100 mL dung dịch đệm có pH = 5,6 không chứa arsenic và calcium vào một
mẫu Ca3(AsO4)2 có khối lượng 10,00 g.
2.6) Tính độ tan (g/L) của Ca3(AsO4)2 trong dung dịch đệm. Giả sử rằng thành phần
của dung dịch đệm không tham gia vào các cân bằng cạnh tranh.
2.7) Tính tổng nồng độ (mol/L) As(V) trong dung dịch đệm trên.
Biểu thức thu được từ ý 5 chưa kể đến cân bằng polyprotic với sự tham gia của ion Ca2+.
2.8) Chỉ ra môi trường nào sau đây thì phương trình trong ý 5 sẽ có sai số lớn nhất:
a) Thêm NaOH vào dung dịch; b) Thêm HCl vào dung dịch;
c) Thêm CaCl2 vào dung dịch;
d) Thêm NaH2AsO4 vào dung dịch;
e) Thêm 100 mL dung dịch đệm như trên vào dung dịch.
3) Thế điện cực và nhiệt động lực học trong dung môi khác nước (phi thủy).
Với sự phát triển của hoá học về các hợp chất cơ kim và ứng dụng của pin lithiumion,
hướng nghiên cứu về điện hoá học của các hệ phi thuỷ ngày càng trở nên chuyên sâu
hơn. Trong dung dịch nước, thế điện cực hydrogen tiêu chuẩn (SHE) được lấy giá trị
bằng 0. Trong các hệ phi thuỷ, cặp ferrocene Fe (C H 5
5 )2 (kí hiệu Fc) và dạng oxid hoá
của nó (kí hiệu Fc+¿¿) thường được sử dụng làm chất nội chuẩn (kí hiệu là
Fc+¿ 0) , E∘( Fc+¿0)=0,400 V (so với SHE). Việc sử dụng cặp Fc+¿0 sẽ giải quyết hiệu quả
vấn đề về việc xác định thế điện cực, hằng số phân li acid-base và các thông số khác
của các chất trong dung môi hữu cơ. Các dữ kiện dưới đây được cho ở 25∘ C đối với
dung dịch nước (aq) và dung môi acetonitrile (MeCN): 4
Đề thi HSG Hóa học 11 Trường THPT Chuyên Thái Nguyên
572
286 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(572 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)