SỞ GIÁO DỤC & ĐÀO TẠO
KỲ THI TUYỂN SINH VÀO LỚP 10 HẢI PHÒNG
THPT CHUYÊN – HẢI PHÒNG NĂM HỌC 2023 ĐỀ CHÍNH THỨC
Môn: Hóa học (Chuyên)
Thời gian làm bài: 150 phút (không kể thời gian giao đề)
Cho nguyên tử khối của các nguyên tố: H = 1; C = 12; O = 16; Cl = 35,5; S = 32;
Br = 80; Al = 27; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108.
Thể tích các khí trong đề đo ở điều kiện tiêu chuẩn.
Câu 1. (1,0 điểm)
Tổng số hạt p, n, e của hai nguyên tử các nguyên tố A và B là 177; trong đó: tổng số
hạt mang điện nhiều hơn tổng số hạt không mang điện là 47. Số hạt mang điện của B nhiều hơn A là 8.
1.1. Xác định các nguyên tố A và B.
1.2. Cho 18,6 gam hỗn hợp gồm A và B tác dụng với dung dịch axit HCl vừa đủ thu
được dung dịch X. Cô cạn dung dịch X thu được 39,9 gam hỗn hợp muối khan. Nếu
cho X tác dụng với dung dịch AgNO3 dư thu được m gam kết tủa. Viết phương trình
hóa học xảy ra và tính giá trị của m.
Câu 2. (1,0 điểm)
Tiến hành các thí nghiệm sau:
2.1. Sục từ từ 0,075 mol khí CO2 vào 225 ml dung dịch NaOH 0,5M.
2.2. Sục khí Cl2 dư vào dung dịch FeSO4.
2.3. Hoà tan hỗn hợp KHSO4 và NaHCO3 (tỉ lệ mol 1:1) vào nước dư.
2.4. Cho hỗn hợp Cu và Fe2O3 (ti lệ mol 1:1) vào dung dịch HCl dư.
Viết phương trình hoá học cho phản ứng xảy ra trong các thí nghiệm trên.
Câu 3. (1,0 điểm)
3.1. Canxi hidroxit là một bazơ có nhiều ứng dụng trong đời sống. Nước vôi trong là
dung dịch loãng của canxi hidroxit. Viết phương trình hoá học giải thích các ứng
dụng sau của canxi hidroxit:
a. Dùng nước vôi trong bôi lên phần da vừa bị ong, kiến đốt cho đỡ đau buốt. Biết
thành phần chính của nọc ong, kiến là axit fomic (HCOOH).
b. Khử độc các chất thải công nghiệp chứa SO2, H2S,...
3.2. Dùng phương pháp hoá học, hãy nhận biết các chất riêng biệt sau: CuO, Al2O3,
FeO, MgO, BaO bằng 2 hoá chất (không tính không khí) khi đồ dùng, thiết bị cơ bản có đủ.
Câu 4. (1,0 điểm)
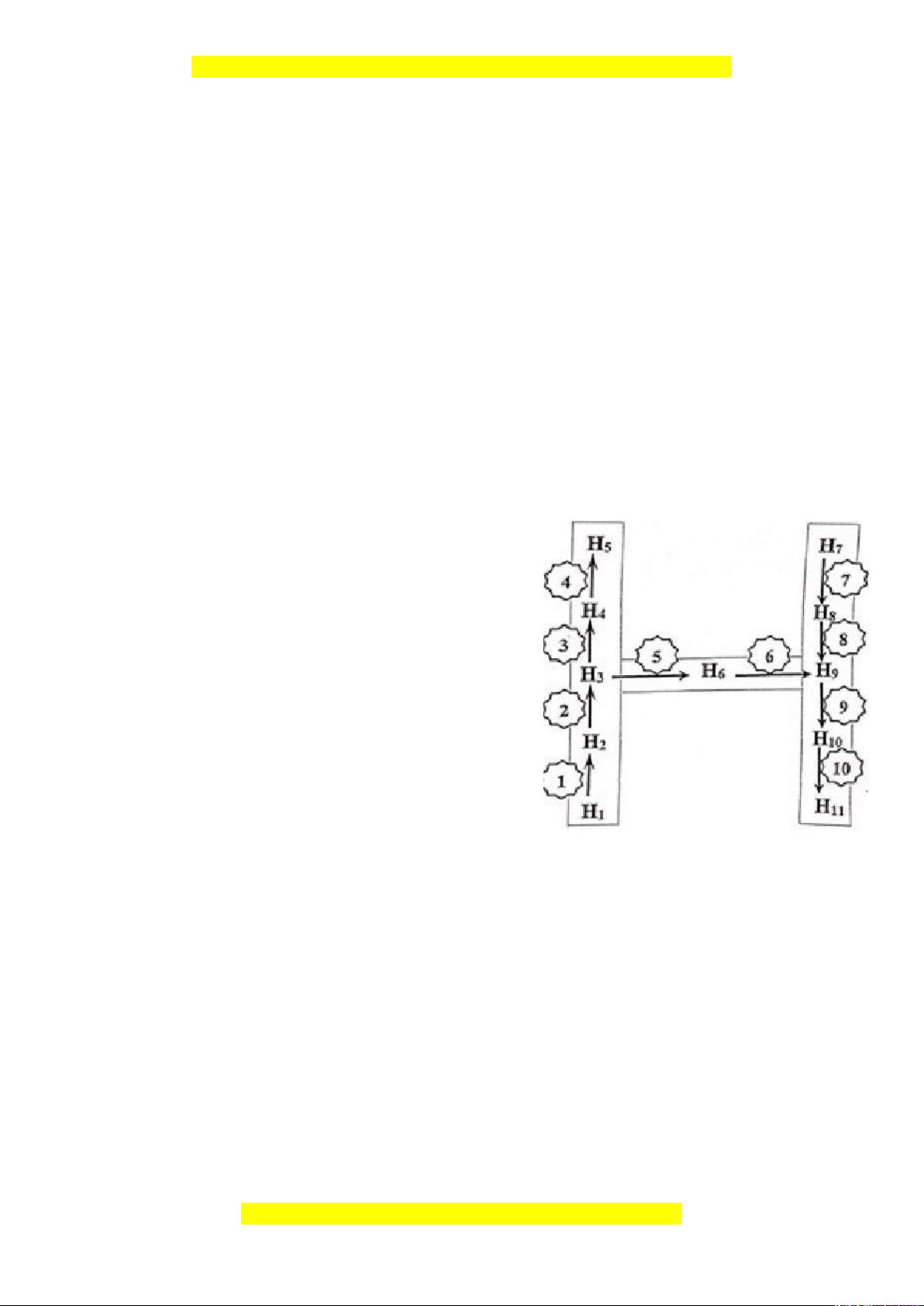
Viết phương trình hoá học hoàn thành sơ đồ chuyển hoá bên, biết:
- Các chất trong sơ đồ từ H1 đến H11 là chất hữu cơ khác nhau;
- H6 là chất khí thuộc loại hidrocabon sinh ra khi hoa quả chín;
- H7 là polime thiên nhiên, thành phần chính trong nhiều loại ngũ cốc;
- H11 là polime có tính đàn hồi cao.
Câu 5. (1,0 điểm)
5.1. Hòa tan hoàn toàn 28,8 gam FeO bằng một lượng vừa đủ dung dịch H2SO4
22,4% được dung dịch X. Làm lạnh dung dịch X đến nhiệt độ thích hợp thu được
dung dịch Y và 41,7 gam tinh thể FeSO4.7H2O tách ra khỏi dung dịch. Xác định nồng
độ chất tan trong dung dịch Y.
5.2. Hòa tan hoàn toàn 34,7 gam hỗn hợp A gồm CaCO3 và một muối cacbonat của
kim loại R vào dung dịch HCl 25% vừa đủ, thu được 5,6 lít CO2 và dung dịch B chứa
hai chất tan trong đó nồng độ của CaCl2 là 17,218%. Xác định kim loại R. Biết các
phản ứng xảy ra hoàn toàn.
Câu 6. (1,0 điểm)
Công thức thực nghiệm (hay công thức đơn giản là công thức hoá học có số nguyên
tử các nguyên tố dạng số nguyên tối giản. Ba chất hữu cơ mạch hở A, B, D có cùng
công thức thực nghiệm. Đốt cháy hoàn toàn 3,0 gam mỗi chất A, B, D đều thu được
hỗn hợp sản phẩm chỉ chứa CO2 và H2O. Hấp thụ hoàn toàn sản phẩm cháy thu được
bằng 750 ml dung dịch Ca(OH)2 0,1M thấy tạo thành 5,0 gam kết tủa trắng, đồng thời
khối lượng dung dịch thu được sau khi tách lọc kết tủa tăng 1,2 gam so với dung dịch ban đầu.
6.1. Xác định công thức thực nghiệm của A, B, D.
6.2. Xác định công thức phân tử và gọi tên của A, B, D dựa theo các dữ kiện sau đây:
- Khối lượng phân tử: MA < MB < MD;
- A là hợp chất đơn chức, không làm quỳ tím hóa đỏ, tan trong nước tạo dung dịch
được dùng để ngâm tiêu bản phục vụ nghiên cứu trong y học;
- B có chứa 1 nhóm chức giống axit axetic, đồng thời tác dụng với Na cho tỉ lệ
. B là một chất có trong thành phần của sữa chua;
- D có nhiều trong các loại quả chín.
6.3. Một trong những ứng dụng của D là tráng gương. Cho 100 gam dung dịch chứa
D với nồng độ 4,5% tác dụng hoàn toàn với Ag2O dư trong NH3 thu được m gam Ag. Tính m.
Câu 7. (1,0 điểm)
Rót từ từ dung dịch HCl cho đến dư vào dung dịch hỗn hợp chứa a mol Na2CO3 và b
mol NaHCO3. Từ kết quả số liệu thực nghiệm ta có 2 đồ thị theo hình vẽ sau:
Xác định khối lượng chất tan trong dung dịch thu được khi lượng HCl rót vào dung dịch là 1,8a mol.
Câu 8. (1,0 điểm)
Nung hỗn hợp X gồm CH4, CH2=CH2; CH3-C≡CH; CH2=CH-C≡CH và a (mol) H2
có Ni xúc tác (để xảy ra phản ứng cộng H2 vào liên kết đôi, liên kết ba) thu được 0,2
mol hỗn hợp Y chỉ gồm các hidrocacbon và có tỉ khối so với H2 là 17,9. Biết 0,1 mol
Y phản ứng tối đa với 0,06 mol Br2 trong dung dịch. Tìm giá trị của a.
Câu 9. (1,0 điểm)
9.1. Thí nghiệm điều chế và chứng minh tính khử của khí Z được thực hiện như hình
3. Khi mở khoá K, chất lỏng X chảy xuống. Sau một thời gian, bình đựng dung dịch KMnO4 nhạt dần.
a. Xác định công thức phân tử của X, Y, Z phù hợp với sơ đồ; biết khí Z có khả năng
làm mất màu cánh hoa hồng.
Đề thi vào 10 môn Hóa học năm 2023 - Trường THPT Chuyên Hải Phòng
2.1 K
1 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ 29 đề thi vào 10 chuyên Hóa học có lời giải chi tiết, mới nhất năm 2022 - 2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi môn Hóa học ôn vào 10.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(2091 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Ôn vào 10
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
SỞ GIÁO DỤC & ĐÀO TẠO
HẢI PHÒNG
KỲ THI TUYỂN SINH VÀO LỚP 10
THPT CHUYÊN – HẢI PHÒNG
NĂM HỌC 2023
Môn: Hóa học (Chuyên)
Thời gian làm bài: 150 phút (không kể thời gian giao đề)
Cho nguyên tử khối của các nguyên tố: H = 1; C = 12; O = 16; Cl = 35,5; S = 32;
Br = 80; Al = 27; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108.
Thể tích các khí trong đề đo ở điều kiện tiêu chuẩn.
Câu 1. (1,0 điểm)
Tổng số hạt p, n, e của hai nguyên tử các nguyên tố A và B là 177; trong đó: tổng số
hạt mang điện nhiều hơn tổng số hạt không mang điện là 47. Số hạt mang điện của B
nhiều hơn A là 8.
1.1. Xác định các nguyên tố A và B.
1.2. Cho 18,6 gam hỗn hợp gồm A và B tác dụng với dung dịch axit HCl vừa đủ thu
được dung dịch X. Cô cạn dung dịch X thu được 39,9 gam hỗn hợp muối khan. Nếu
cho X tác dụng với dung dịch AgNO
3
dư thu được m gam kết tủa. Viết phương trình
hóa học xảy ra và tính giá trị của m.
Câu 2. (1,0 điểm)
Tiến hành các thí nghiệm sau:
2.1. Sục từ từ 0,075 mol khí CO
2
vào 225 ml dung dịch NaOH 0,5M.
2.2. Sục khí Cl
2
dư vào dung dịch FeSO
4
.
2.3. Hoà tan hỗn hợp KHSO
4
và NaHCO
3
(tỉ lệ mol 1:1) vào nước dư.
2.4. Cho hỗn hợp Cu và Fe
2
O
3
(ti lệ mol 1:1) vào dung dịch HCl dư.
Viết phương trình hoá học cho phản ứng xảy ra trong các thí nghiệm trên.
Câu 3. (1,0 điểm)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
ĐỀ CHÍNH THỨC
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
3.1. Canxi hidroxit là một bazơ có nhiều ứng dụng trong đời sống. Nước vôi trong là
dung dịch loãng của canxi hidroxit. Viết phương trình hoá học giải thích các ứng
dụng sau của canxi hidroxit:
a. Dùng nước vôi trong bôi lên phần da vừa bị ong, kiến đốt cho đỡ đau buốt. Biết
thành phần chính của nọc ong, kiến là axit fomic (HCOOH).
b. Khử độc các chất thải công nghiệp chứa SO
2
, H
2
S,...
3.2. Dùng phương pháp hoá học, hãy nhận biết các chất riêng biệt sau: CuO, Al
2
O
3
,
FeO, MgO, BaO bằng 2 hoá chất (không tính không khí) khi đồ dùng, thiết bị cơ bản
có đủ.
Câu 4. (1,0 điểm)
Viết phương trình hoá học hoàn thành sơ đồ chuyển hoá bên, biết:
- Các chất trong sơ đồ từ H
1
đến H
11
là chất hữu cơ
khác nhau;
- H
6
là chất khí thuộc loại hidrocabon sinh ra khi
hoa quả chín;
- H
7
là polime thiên nhiên, thành phần chính trong
nhiều loại ngũ cốc;
- H
11
là polime có tính đàn hồi cao.
Câu 5. (1,0 điểm)
5.1. Hòa tan hoàn toàn 28,8 gam FeO bằng một lượng vừa đủ dung dịch H
2
SO
4
22,4% được dung dịch X. Làm lạnh dung dịch X đến nhiệt độ thích hợp thu được
dung dịch Y và 41,7 gam tinh thể FeSO
4.
7H
2
O tách ra khỏi dung dịch. Xác định nồng
độ chất tan trong dung dịch Y.
5.2. Hòa tan hoàn toàn 34,7 gam hỗn hợp A gồm CaCO
3
và một muối cacbonat của
kim loại R vào dung dịch HCl 25% vừa đủ, thu được 5,6 lít CO
2
và dung dịch B chứa
hai chất tan trong đó nồng độ của CaCl
2
là 17,218%. Xác định kim loại R. Biết các
phản ứng xảy ra hoàn toàn.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Câu 6. (1,0 điểm)
Công thức thực nghiệm (hay công thức đơn giản là công thức hoá học có số nguyên
tử các nguyên tố dạng số nguyên tối giản. Ba chất hữu cơ mạch hở A, B, D có cùng
công thức thực nghiệm. Đốt cháy hoàn toàn 3,0 gam mỗi chất A, B, D đều thu được
hỗn hợp sản phẩm chỉ chứa CO
2
và H
2
O. Hấp thụ hoàn toàn sản phẩm cháy thu được
bằng 750 ml dung dịch Ca(OH)
2
0,1M thấy tạo thành 5,0 gam kết tủa trắng, đồng thời
khối lượng dung dịch thu được sau khi tách lọc kết tủa tăng 1,2 gam so với dung dịch
ban đầu.
6.1. Xác định công thức thực nghiệm của A, B, D.
6.2. Xác định công thức phân tử và gọi tên của A, B, D dựa theo các dữ kiện sau đây:
- Khối lượng phân tử: M
A
< M
B
< M
D
;
- A là hợp chất đơn chức, không làm quỳ tím hóa đỏ, tan trong nước tạo dung dịch
được dùng để ngâm tiêu bản phục vụ nghiên cứu trong y học;
- B có chứa 1 nhóm chức giống axit axetic, đồng thời tác dụng với Na cho tỉ lệ
. B là một chất có trong thành phần của sữa chua;
- D có nhiều trong các loại quả chín.
6.3. Một trong những ứng dụng của D là tráng gương. Cho 100 gam dung dịch chứa
D với nồng độ 4,5% tác dụng hoàn toàn với Ag
2
O dư trong NH
3
thu được m gam Ag.
Tính m.
Câu 7. (1,0 điểm)
Rót từ từ dung dịch HCl cho đến dư vào dung dịch hỗn hợp chứa a mol Na
2
CO
3
và b
mol NaHCO
3
. Từ kết quả số liệu thực nghiệm ta có 2 đồ thị theo hình vẽ sau:
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Xác định khối lượng chất tan trong dung dịch thu được khi lượng HCl rót vào dung
dịch là 1,8a mol.
Câu 8. (1,0 điểm)
Nung hỗn hợp X gồm CH
4
, CH
2
=CH
2
; CH
3
-C≡CH; CH
2
=CH-C≡CH và a (mol) H
2
có Ni xúc tác (để xảy ra phản ứng cộng H
2
vào liên kết đôi, liên kết ba) thu được 0,2
mol hỗn hợp Y chỉ gồm các hidrocacbon và có tỉ khối so với H
2
là 17,9. Biết 0,1 mol
Y phản ứng tối đa với 0,06 mol Br
2
trong dung dịch. Tìm giá trị của a.
Câu 9. (1,0 điểm)
9.1. Thí nghiệm điều chế và chứng minh tính khử của khí Z được thực hiện như hình
3. Khi mở khoá K, chất lỏng X chảy xuống. Sau một thời gian, bình đựng dung dịch
KMnO
4
nhạt dần.
a. Xác định công thức phân tử của X, Y, Z phù hợp với sơ đồ; biết khí Z có khả năng
làm mất màu cánh hoa hồng.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
b. Viết phương trình hoá học cho phản ứng xảy ra trong thí nghiệm.
9.2. Nêu hiện tượng và viết phương trình hoá học cho phản ứng xảy ra khi tiến hành
thí nghiệm theo hình 4.
Câu 10. (1,0 điểm)
Hàng năm, trên thế giới sản xuất hàng trăm triệu tấn axit sunfuric do các ứng dụng
quan trọng của nó đối với nền kinh tế quốc dân.
Trong công nghiệp, axit sunfuric được sản xuất bằng phương pháp tiếp xúc. Nguyên
liệu là lưu huỳnh (hoặc quặng pirit sắt), không khí và nước. Thông thường sản xuất
axit sunfuric có 3 giai đoạn.
- Giai đoạn 1: Oxi hoá lưu huỳnh (hoặc quặng pirit sắt) bằng không khí giàu oxi;
- Giai đoạn 2: Oxi hoá sản phẩm chứa lưu huỳnh thu được ở giai đoạn 1 bằng xúc tác
phù hợp;
- Giai đoạn 3: Hấp thụ sản phẩm chứa lưu huỳnh thu được giai đoạn 2 để tạo axit
sunfuric.
Trên thực tế, hiệu suất của quá trình sản xuất axit sunfuric phụ thuộc nhiều vào giai
đoạn 3 do hiệu suất của 2 giai đoạn đầu có thể đạt tới 100%. Nếu dùng nước để hấp
thụ SO
3
thì hiệu suất phản ứng có thể chỉ đạt dưới 5% do phản ứng toả nhiệt nên sản
phẩm sinh ra tạo lớp sương mù, vừa khó thu hồi, vừa hạn chế sự tiếp xúc giữa các
chất tham gia phản ứng. Thực tế trong sản xuất người ta dùng dung dịch H
2
SO
4
đặc
làm chất hấp thụ trong giai đoạn 3. Sản phẩm của phản ứng thu được là oleum có
công thức dạng H
2
SO
4
.nSO
3
. Oleum dễ vận chuyển an toàn hơn axit sunfuric. Khi
biết công thức của oleum có thể tính toán lượng nước cần hoà tan để thu được axit
sunfuric tinh khiết.
10.1. Viết phương trình hoá học cho các phản ứng xảy ra trong quá trình sản xuất axit
sunfuric thực tế.
10.2. Xác định công thức một loại oleum, biết dung dịch thu được khi hoà tan 9,87
gam oleum bằng nước được trung hoà bởi 240 ml dung dịch NaOH 1M.
Ghi chú:
- Học sinh được sử dụng bảng tuần hoàn hóa học do NXBGDVN phát hành.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85






















