Ngày soạn : / /201 Tiết 47 NHÔM(1/2) Số tiết: 02 TIẾT 1 A . M
ục tiêu bài học : 1.Kiến thức
Trình bày được: Vị trí , cấu hình lớp electron ngoài cùng, tính chất vật lí , trạng
thái tự nhiên, ứng dụng của nhôm. Giải thích được:
Nhôm là kim loại có tính khử khá mạnh: phản ứng với phi kim, dung dịch axit,
nước, dung dịch kiềm, oxit kim loại.
Nguyên tắc và sản xuất nhôm bằng phương pháp điện phân oxit nóng chảy Trọng tâm
Đặc điểm cấu tạo nguyên tử nhôm và các phản ứng đặc trưng của nhôm
Phương pháp điều chế nhôm 2.Kĩ năng
Quan sát mẫu vật, thí nghiệm, rút ra kết luận về tính chất hóa học và nhận biết ion nhôm
Viết các PTHH minh hoạ tính chất hóa học của nhôm
Dự đoán, kiểm tra bằng thí nghiệm và kết luận được tính chất hóa học của nhôm, nhận biết ion nhôm
3. Thái độ:Rèn thái độ học tập bộ môn, lòng say mê nghiên cứu khoa học
4. Định hướng năng lực đươc hình thành
- Năng lực phát hiện và giải quyết vấn đề.
- Năng lực sử dụng ngôn ngữ hóa học.
- Năng lực vận dụng kiến thức vào cuộc sống.
- Năng lực làm việc độc lập.
- Năng lực hợp tác, làm việc theo nhóm.
- Năng lực tính toán hóa học. B . Chuẩn bị: 1.Phương pháp
Dạy học nhóm ,thuyết trình,đàm thoại…
2.Phương tiện , thiết bị
Giáo viên : Al, Fe2O3, chén sứ, dây Mg…
Học sinh: Đọc bài ở nhà, C
. Tiến trình bài dạy: 1. Ổn định lớp: Tiết/ HS vắng Lớp Ngày dạy Sĩ số ngày Có phép Không phép 12A1 12A3
2.Kiểm tra bài cũ: kết hợp trong bài 3. Bài mới
Hoạt động 1( 2 phút) : Hoạt động khởi động
Mục tiêu: Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học
sinh tiếp nhận kiến thức chủ động, tích cực ,hiệu quả.
Hoạt động của GV Hoạt động của HS
* Chuyển giao nhiệm vụ học tập:
* Thưc hiện nhiệm vụ học tập
Nhôm là một trong những kim loại trước Tập trung, tái hiện kiến thức
kia rât khó điều chế. Người ta còn lầm * Báo cáo kết quả và thảo luận
tưởng đó là kim loại quý hiếm. Vậy thực HS trình bày, HS khác thảo luận, nhận
tế nhôm là kim loại như thế nào?có tính xét.
chất lý hóa ra sao ta vào bài học ngày hôm nay
* Đánh giá kết quả thực hiện nhiệm vụ học tập
Nhận xét về quá trình thực hiện nhiệm vụ học tập của học sinh; phân tích, nhận xét,
đánh giá kết quả; chốt kiến thức
Hoạt động 2(40 phút) : II. Hình thành kiến thức
Mục tiêu: Trình bày được: Vị trí , cấu hình lớp electron ngoài cùng, tính chất vật
lí , trạng thái tự nhiên, ứng dụng của nhôm. Giải thích được:
Nhôm là kim loại có tính khử khá mạnh: phản ứng với phi kim, dung dịch axit,
nước, dung dịch kiềm, oxit kim loại.
Nguyên tắc và sản xuất nhôm bằng phương pháp điện phân oxit nóng chảy
Hoạt động của GV Hoạt động của HS
GV:Chuyển giao nhiệm vụ học tập HS: Hình thành các nhóm theo quy luật :
Rồi nhận nhiệm vụ học tập và làm việc theo
bằng cách chia hs thành 6 nhóm nhóm
theo số thứ tự bàn học trong lớp
+ Nhóm 1,3 dựa vào SGK tìm
hiểu : Vị trí,cấu tạo và tính chất vật lý
HS: Thực hiện nhiệm vụ học tập thông qua
+ Nhóm 2,4 tìm hiểu: làm việc nhóm
Tính chất hóa học
+thỏa thuận quy tắc làm việc trong nhóm
. + Nhóm 5,6 tìm hiểu:
+Tiến hành giải quyết các nhiệm vụ
Ứng dụng và sản xuất
+ Sau khi hoàn thành nội dung các HS hình
GV: Quan sát quá trình thực hiện
thành nhóm mới theo sự phân công của GV
nhiệm vụ của HS có thể giúp đỡ HS khi cần thiết
HS:Báo cáo kết quả và thảo luận
HS cử đại diện báo cáo sản phẩm ,kết quả thực
hiện nhiệm vụ, Hs nhóm khác cùng tham gia thảo luận Nhóm 1,3 Báo cáo:
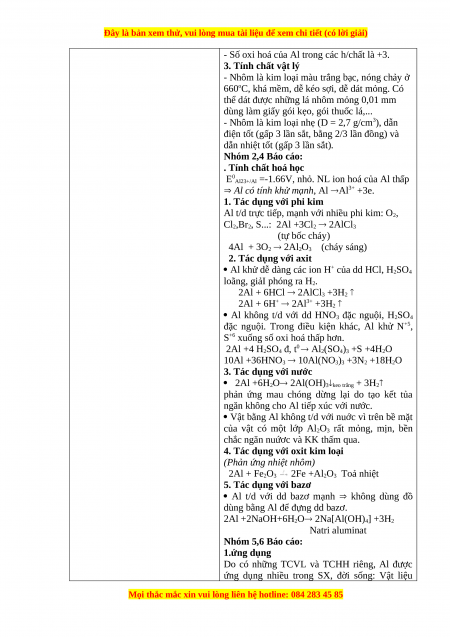
1. Vị trí của nhôm trong bảng tuần hoàn
Al ở ô 13, chu kì 3, nhóm IIIA của BTH. 2. Cấu tạo của nhôm
- Cấu hình electron ntử: 1s22s22p63s 2 3p 6
- Đơn chất Al được cấu tậo mạng tinh thể lập
phương tâm diện, bền vững.
- Năng lượng ion hoá I1, I2, I3 có giá trị gần
nhau nên có khả năng nhường 3 electron.
- Số oxi hoá của Al trong các h/chất là +3. 3. Tính chất vật lý
- Nhôm là kim loại màu trắng bạc, nóng chảy ở
660oC, khá mềm, dễ kéo sợi, dễ dát mỏng. Có
thể dát được những lá nhôm mỏng 0,01 mm
dùng làm giấy gói kẹo, gói thuốc lá,...
- Nhôm là kim loại nhẹ (D = 2,7 g/cm3), dẫn
điện tốt (gấp 3 lần sắt, bằng 2/3 lần đồng) và
dẫn nhiệt tốt (gấp 3 lần sắt). Nhóm 2,4 Báo cáo: . Tính chất hoá học
E0Al23+/Al =-1.66V, nhỏ. NL ion hoá của Al thấp
Al có tính khử mạnh, Al Al3+ +3e.
1. Tác dụng với phi kim
Al t/d trực tiếp, mạnh với nhiều phi kim: O2,
Cl2,Br2, S...: 2Al +3Cl2 2AlCl3 (tự bốc cháy)
4Al + 3O2 2Al2O3 (cháy sáng) 2. Tác dụng với axit
Al khử dễ dàng các ion H+ của dd HCl, H2SO4 loãng, giảI phóng ra H2.
2Al + 6HCl 2AlCl3 +3H2 2Al + 6H+ 2Al3+ +3H2
Al không t/d với dd HNO3 đặc nguội, H2SO4
đặc nguội. Trong điều kiện khác, Al khử N+5,
S+6 xuống số oxi hoá thấp hơn.
2Al +4 H2SO4 đ, t0 Al2(SO4)3 +S +4H2O
10Al +36HNO3 10Al(NO3)3 +3N2 +18H2O
3. Tác dụng với nước
2Al +6H2O 2Al(OH)3keo trắng + 3H2
phản ứng mau chóng dừng lại do tạo kết tủa
ngăn không cho Al tiếp xúc với nước.
Vật bằng Al không t/d với nuớc vì trên bề mặt
của vật có một lớp Al2O3 rất mỏng, mịn, bền
chắc ngăn nuứơc và KK thấm qua.
4. Tác dụng với oxit kim loại (Phản ứng nhiệt nhôm)
2Al + Fe2O3 2Fe +Al2O3 Toả nhiệt 5. Tác dụng với bazơ
Al t/d với dd bazơ mạnh không dùng đồ
dùng bằng Al để đựng dd bazơ.
2Al +2NaOH+6H2O 2Na[Al(OH)4] +3H2 Natri aluminat Nhóm 5,6 Báo cáo: 1.ứng dụng
Do có những TCVL và TCHH riêng, Al được
ứng dụng nhiều trong SX, đời sống: Vật liệu
Giáo án Hóa học 12 học kì 2 Tiết 47: Nhôm
564
282 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa 12 học kì 2 được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa 12 học kì 2 năm 2023 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa 12 học kì 2.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(564 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Ngày soạn : / /201
Tiết 47 NHÔM(1/2)
Số tiết: 02
TIẾT 1
A . Mục tiêu bài học :
1.Kiến thức
Trình bày được: Vị trí , cấu hình lớp electron ngoài cùng, tính chất vật lí , trạng
thái tự nhiên, ứng dụng của nhôm.
Giải thích được:
Nhôm là kim loại có tính khử khá mạnh: phản ứng với phi kim, dung dịch axit,
nước, dung dịch kiềm, oxit kim loại.
Nguyên tắc và sản xuất nhôm bằng phương pháp điện phân oxit nóng chảy
Trọng tâm
Đặc điểm cấu tạo nguyên tử nhôm và các phản ứng đặc trưng của nhôm
Phương pháp điều chế nhôm
2.Kĩ năng
Quan sát mẫu vật, thí nghiệm, rút ra kết luận về tính chất hóa học và nhận biết
ion nhôm
Viết các PTHH minh hoạ tính chất hóa học của nhôm
Dự đoán, kiểm tra bằng thí nghiệm và kết luận được tính chất hóa học của nhôm,
nhận biết ion nhôm
3. Thái độ:Rèn thái độ học tập bộ môn, lòng say mê nghiên cứu khoa học
4. Định hướng năng lực đươc hình thành
- Năng lực phát hiện và giải quyết vấn đề.
- Năng lực sử dụng ngôn ngữ hóa học.
- Năng lực vận dụng kiến thức vào cuộc sống.
- Năng lực làm việc độc lập.
- Năng lực hợp tác, làm việc theo nhóm.
- Năng lực tính toán hóa học.
B . Chuẩn bị:
1.Phương pháp
Dạy học nhóm ,thuyết trình,đàm thoại…
2.Phương tiện , thiết bị
Giáo viên : Al, Fe
2
O
3
, chén sứ, dây Mg…
Học sinh: Đọc bài ở nhà,
C. Tiến trình bài dạy:
1. Ổn định lớp:
Lớp Ngày dạy
Tiết/
ngày
Sĩ số
HS vắng
Có phép Không phép
12A1
12A3
2.Kiểm tra bài cũ: kết hợp trong bài
3. Bài mới
Hoạt động 1( 2 phút) : Hoạt động khởi động
Mục tiêu: Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học
sinh tiếp nhận kiến thức chủ động, tích cực ,hiệu quả.
Hoạt động của GV Hoạt động của HS
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
* Chuyển giao nhiệm vụ học tập:
Nhôm là một trong những kim loại trước
kia rât khó điều chế. Người ta còn lầm
tưởng đó là kim loại quý hiếm. Vậy thực
tế nhôm là kim loại như thế nào?có tính
chất lý hóa ra sao ta vào bài học ngày hôm
nay
* Thưc hiện nhiệm vụ học tập
Tập trung, tái hiện kiến thức
* Báo cáo kết quả và thảo luận
HS trình bày, HS khác thảo luận, nhận
xét.
* Đánh giá kết quả thực hiện nhiệm vụ học tập
Nhận xét về quá trình thực hiện nhiệm vụ học tập của học sinh; phân tích, nhận xét,
đánh giá kết quả; chốt kiến thức
Hoạt động 2(40 phút) : II. Hình thành kiến thức
Mục tiêu: Trình bày được: Vị trí , cấu hình lớp electron ngoài cùng, tính chất vật
lí , trạng thái tự nhiên, ứng dụng của nhôm.
Giải thích được:
Nhôm là kim loại có tính khử khá mạnh: phản ứng với phi kim, dung dịch axit,
nước, dung dịch kiềm, oxit kim loại.
Nguyên tắc và sản xuất nhôm bằng phương pháp điện phân oxit nóng chảy
Hoạt động của GV Hoạt động của HS
GV:Chuyển giao nhiệm vụ học tập
:
bằng cách chia hs thành 6 nhóm
theo số thứ tự bàn học trong lớp
+ Nhóm 1,3 dựa vào SGK tìm
hiểu : Vị trí,cấu tạo và tính chất vật
lý
+ Nhóm 2,4 tìm hiểu:
Tính chất hóa học
. + Nhóm 5,6 tìm hiểu:
Ứng dụng và sản xuất
GV: Quan sát quá trình thực hiện
nhiệm vụ của HS có thể giúp đỡ
HS khi cần thiết
HS: Hình thành các nhóm theo quy luật
Rồi nhận nhiệm vụ học tập và làm việc theo
nhóm
HS: Thực hiện nhiệm vụ học tập thông qua
làm việc nhóm
+thỏa thuận quy tắc làm việc trong nhóm
+Tiến hành giải quyết các nhiệm vụ
+ Sau khi hoàn thành nội dung các HS hình
thành nhóm mới theo sự phân công của GV
HS:Báo cáo kết quả và thảo luận
HS cử đại diện báo cáo sản phẩm ,kết quả thực
hiện nhiệm vụ, Hs nhóm khác cùng tham gia
thảo luận
Nhóm 1,3 Báo cáo:
1. Vị trí của nhôm trong bảng tuần hoàn
Al ở ô 13, chu kì 3, nhóm IIIA của BTH.
2. Cấu tạo của nhôm
- Cấu hình electron ntử: 1s
2
2s
2
2p
6
3s
2
3p
6
- Đơn chất Al được cấu tậo mạng tinh thể lập
phương tâm diện, bền vững.
- Năng lượng ion hoá I
1
, I
2
, I
3
có giá trị gần
nhau nên có khả năng nhường 3 electron.
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
- Số oxi hoá của Al trong các h/chất là +3.
3. Tính chất vật lý
- Nhôm là kim loại màu trắng bạc, nóng chảy ở
660
o
C, khá mềm, dễ kéo sợi, dễ dát mỏng. Có
thể dát được những lá nhôm mỏng 0,01 mm
dùng làm giấy gói kẹo, gói thuốc lá,...
- Nhôm là kim loại nhẹ (D = 2,7 g/cm
3
), dẫn
điện tốt (gấp 3 lần sắt, bằng 2/3 lần đồng) và
dẫn nhiệt tốt (gấp 3 lần sắt).
Nhóm 2,4 Báo cáo:
. Tính chất hoá học
E
0
Al23+/Al
=-1.66V, nhỏ. NL ion hoá của Al thấp
Al có tính khử mạnh, Al Al
3+
+3e.
1. Tác dụng với phi kim
Al t/d trực tiếp, mạnh với nhiều phi kim: O
2
,
Cl
2
,Br
2
, S...: 2Al +3Cl
2
2AlCl
3
(tự bốc cháy)
4Al + 3O
2
2Al
2
O
3
(cháy sáng)
2. Tác dụng với axit
Al khử dễ dàng các ion H
+
của dd HCl, H
2
SO
4
loãng, giảI phóng ra H
2
.
2Al + 6HCl 2AlCl
3
+3H
2
2Al + 6H
+
2Al
3+
+3H
2
Al không t/d với dd HNO
3
đặc nguội, H
2
SO
4
đặc nguội. Trong điều kiện khác, Al khử N
+5
,
S
+6
xuống số oxi hoá thấp hơn.
2Al +4 H
2
SO
4
đ, t
0
Al
2
(SO
4
)
3
+S +4H
2
O
10Al +36HNO
3
10Al(NO
3
)
3
+3N
2
+18H
2
O
3. Tác dụng với nước
2Al +6H
2
O 2Al(OH)
3
keo trắng
+ 3H
2
phản ứng mau chóng dừng lại do tạo kết tủa
ngăn không cho Al tiếp xúc với nước.
Vật bằng Al không t/d với nuớc vì trên bề mặt
của vật có một lớp Al
2
O
3
rất mỏng, mịn, bền
chắc ngăn nuứơc và KK thấm qua.
4. Tác dụng với oxit kim loại
(Phản ứng nhiệt nhôm)
2Al + Fe
2
O
3
2Fe +Al
2
O
3
Toả nhiệt
5. Tác dụng với bazơ
Al t/d với dd bazơ mạnh không dùng đồ
dùng bằng Al để đựng dd bazơ.
2Al +2NaOH+6H
2
O 2Na[Al(OH)
4
] +3H
2
Natri aluminat
Nhóm 5,6 Báo cáo:
1.ứng dụng
Do có những TCVL và TCHH riêng, Al được
ứng dụng nhiều trong SX, đời sống: Vật liệu
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85