Ngày soạn : / /201
Tiết 56: CROM VÀ HỢP CHẤT CỦA CROM A . M
ục tiêu bài học : 1.Kiến thức Trình bày được:
- Vị tri, cấu hinh electron hoa trị, tính chất vật lí (độ cứng, màu, khối lượng riêng)
của crom, số oxi hoá; tính chất hoá học của crom là tính khử (phản ứng với oxi, clo,
lưu huỳnh, dung dịch axit).
- Tính chất của hợp chất crom (III), Cr2O3, Cr(OH)3 (tính tan, tính oxi hoá và tính
khử, tính lưỡng tính); Tính chất của hợp chất crom (VI), K2CrO4, K2Cr2O7 (tính tan, màu sắc, tính oxi hoá). 2.Kĩ năng
- Dự đoán và kết luận được về tính chất của crom và một số hợp chất .
- Viết cỏc PTHH thể hiện tớnh chất của crom và hợp chất crom.
- Tính thể tích hoặc nồng độ dung dịch K2Cr2O7 tham gia phản ứng. . Trọng tâm
Đặc điểm cấu tạo nguyên tử crom và các phản ứng đặc trưng của crom
Tính chất hoá học cơ bản của các hợp chất Cr2O3, Cr(OH)3, CrO3; K2CrO4, K2Cr2O7 3.Thái đô
Rèn luyện tính cẩn thận, lòng yêu thích môn hóa và phương pháp nghiên cứu khoa học
4. Định hướng năng lực đươc hình thành
- Năng lực phát hiện và giải quyết vấn đề.
- Năng lực sử dụng ngôn ngữ hóa học.
- Năng lực vận dụng kiến thức vào cuộc sống.
- Năng lực làm việc độc lập.
- Năng lực hợp tác, làm việc theo nhóm.
- Năng lực tính toán hóa học. B . Chuẩn bị: 1.Phương pháp
Dạy học nhóm , thuyết trình, đàm thoại ….
2.Phương tiện , thiết bị
GV: Giáo án, hệ thống bài tập…
Học sinh : ôn tập ở nhà C
. Tiến trình bài dạy: 1. Ổn định lớp: Tiết/ HS vắng Lớp Ngày dạy Sĩ số ngày Có phép Không phép 12A1 12A3
2.Kiểm tra bài cũ: kết hợp trong bài 3. Bài mới
Hoạt động 1( 2 phút) : Hoạt động khởi động
Mục tiêu: Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học
sinh tiếp nhận kiến thức chủ động, tích cực ,hiệu quả.
Hoạt động của GV Hoạt động của HS
* Chuyển giao nhiệm vụ học tập:
* Thưc hiện nhiệm vụ học tập
Crom là một trong những kim loại cứng Tập trung, tái hiện kiến thức
nhất và có rất nhiều ứng dụng trong thực * Báo cáo kết quả và thảo luận
tế,muối crom mat đươc ứng dụng trong HS trình bày, HS khác thảo luận, nhận
nghành phân tích.Vậy crom và hợp chất xét.
crom có nhứng tính chất lý –hóa gì ta vào bài hôm nay.
* Đánh giá kết quả thực hiện nhiệm vụ học tập
Nhận xét về quá trình thực hiện nhiệm vụ học tập của học sinh; phân tích, nhận xét,
đánh giá kết quả; chốt kiến thức
Hoạt động 2(30 phút) : II. Hình thành kiến thức
Mục tiêu: Trình bày được:
- Vị tri, cấu hinh electron hoa trị, tính chất vật lí (độ cứng, màu, khối lượng riêng)
của crom, số oxi hoá; tính chất hoá học của crom là tính khử (phản ứng với oxi, clo,
lưu huỳnh, dung dịch axit).
- Tính chất của hợp chất crom (III), Cr2O3, Cr(OH)3 (tính tan, tính oxi hoá và tính
khử, tính lưỡng tính); Tính chất của hợp chất crom (VI), K2CrO4, K2Cr2O7 (tính tan, màu sắc, tính oxi hoá).
Hoạt động của GV Hoạt động của HS
GV:Chuyển giao nhiệm vụ học
HS: Hình thành các nhóm theo quy luật tập :
Rồi nhận nhiệm vụ học tập và làm việc theo
bằng cách chia hs thành 4 nhóm nhóm
theo số thứ tự bàn học trong lớp + Nhóm 1, :
Nghiên cứu vị trí – cấu hình – tính
chất vật lý của crom
HS: Thực hiện nhiệm vụ học tập thông qua + Nhóm 2: làm việc nhóm
Nghiên cứu tính chất hóa học của
+thỏa thuận quy tắc làm việc trong nhóm crom
+Tiến hành giải quyết các nhiệm vụ + Nhóm 3:
Nghiên cứu hợp chất crom (III)
+ Sau khi hoàn thành nội dung các HS hình + Nhóm 4:
thành nhóm mới theo sự phân công của GV
Nghiên cứu hợp chất crom (VI)
HS:Báo cáo kết quả và thảo luận
GV: bao quát chung cả lớp. Có thể
giúp đỡ các hs nếu găp khó khăn
HS cử đại diện báo cáo sản phẩm ,kết quả
thực hiện nhiệm vụ, Hs nhóm khác cùng tham gia thảo luận
GV giới thiệu về tính khử của kim
loại Cr so với Fe và các mức oxi hoá Nhóm 1 Báo cáo : hay gặp của crom
HS viết cấu hình electron nguyên tử của Cr.
Cr không tác dụng với dung dịch - Ô 24, nhóm VIB, chu kì 4.
HNO3 hoặc H2SO4 đặc, nguội.
- Cấu hình electron: 1s22s22p63s23p63d54s1 hay
[Ar]3d54s1.
GV ?: Vì sao hợp chất Cr3+ vừa Crom là kim loại màu trắng bạc, có khối
thể hiện tính khử, vừa thể hiện tính lượng riêng lớn (d = 7,2g/cm3), t0nc = 18900C. oxi hoá ?
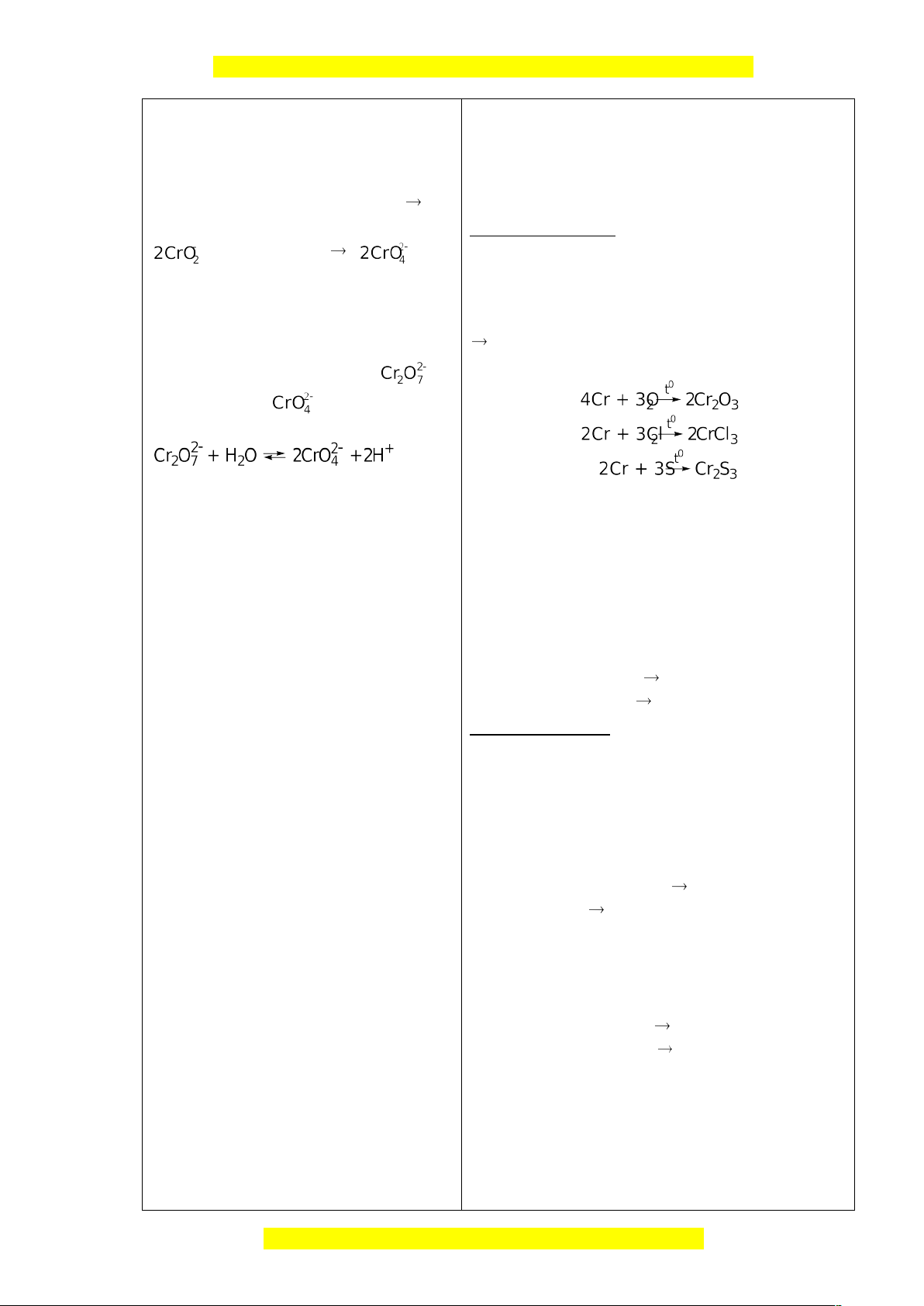
- Là kim loại cứng nhất, có thể rạch được thuỷ 2NaCrO2 + 3Br2 + 8NaOH tinh. 2Na2CrO4 + 6NaBr + 4H2O Nhóm 2, Báo cáo : + 3Br2 + 8OH- + 6Br- + 4H
II.TÍNH CHẤT HOÁ HỌC 2O
- Là kim loại có tính khử mạnh hơn sắt.
- Trong các hợp chất crom có số oxi hoá từ +1 +6 (hay gặp +2, +3 và +6).
1. Tác dụng với phi kim
Trong dung dịch của ion luôn có cả ion ở trạng thái cân bằng với nhau:
2. Tác dụng với nước
Cr bền với nước và không khí do có lớp màng
oxit rất mỏng, bền bảo vệ mạ crom lên sắt
để bảo vệ sắt và dùng Cr để chế tạo thép không gỉ. 3.Tác dụng với axit
HS viết PTHH của các phản ứng giữa kim
loại Cr với các axit HCl và H2SO4 loãng. Cr + 2HCl CrCl2 + H2 Cr + H2SO4 CrSO4 + H2 Nhóm 3 Báo cáo :
III – HỢP CHẤT CỦA CROM 1. Hợp chất crom (III)
a) Crom (III) oxit – Cr2O3
Cr2O3 là chất rắn, màu lục thẩm, không tan trong nước.
Cr2O3 là oxit lưỡng tính Cr2O3 + 2NaOH (đặc) 2NaCrO2 + H2O Cr2O3 + 6HCl 2CrCl3 + 3H2O
b) Crom (III) hiđroxit – Cr(OH)3
Cr(OH)3 là chất rắn, màu lục xám, không tan trong nước.
Cr(OH)3 là một hiđroxit lưỡng tính Cr(OH)3 + NaOH NaCrO2 + 2H2O Cr(OH)3+ 3HCl CrCl3 + 3H2O
HS dẫn ra các PTHH để minh hoạ cho tính
chất đó của hợp chất Cr3+.
Tính khử và tính oxi hoá: Do có số oxi hoá
trung gian nên trong dung dịch vừa có tính oxi
hoá (môi trường axit) vừa có tính khử (trong môi trường bazơ)
2CrCl3 + Zn 2CrCl2 + ZnCl2 2Cr3+ + Zn 2Cr2+ + Zn2+ Nhóm 4 Báo cáo : 2. Hợp chất crom (VI) a) Crom (VI) oxit – CrO3
CrO3 là chất rắn màu đỏ thẫm. Là một oxit axit CrO3 + H2O H2CrO4 (axit cromic) 2CrO3 + H2O H2Cr2O7 (axit đicromic)
Có tính oxi hoá mạnh: Một số chất hữu cơ
và vô cơ (S, P, C, C2H5OH) bốc cháy khi tiếp xúc với CrO3. b) Muối crom (VI)
Là những hợp chất bền.
- Na2CrO4 và K2CrO4 có màu vàng (màu của ion )
- Na2Cr2O7 và K2Cr2O7 có màu da cam (màu của ion )
Các muối cromat và đicromat có tính oxi hoá mạnh.
Đánh giá kết quả thực hiện nhiệm vụ học tập
Nhận xét về kết quả thực hiện nhiệm vụ học tập của HS Thông qua mức độ hoàn
thành yêu cầu nhiệm vụ học tập ;phân tích ,nhận xét ,đánh giá kết quả thực hiện và
những ý kiến thảo luận của HS rồi chốt kiến thức 4.Củng cố (5 phút) * Hoạt động luyện tập - Mục tiêu:
+ Rèn luyện kĩ năng giải bài tập
+ Phát triển năng lực tính toán hóa học Hoạt động của GV Hoạt động của HS
* Chuyển giao nhiệm vụ học tập
1. Trong các cấu hình electron của nguyên * Thực hiện nhiệm vụ học tập
tử và ion crom sau đây, cấu hình electron
+ Tiến hành giải quyết các nhiệm vụ nào không đúng + Chuẩn bị lên báo cáo A. 24Cr: (Ar)3d54s1. B. 24Cr: (Ar)3d44s2. C. 24Cr2+: (Ar)3d4. D. 24Cr3+: (Ar)3d3.
* Báo cáo kết quả và thảo luận
2. Trong các cấu hình electron của nguyên HS báo cáo sản phẩm ,kết quả thực hiện
tử và ion crom sau đây, cấu hình electron
nhiệm vụ, Hs khác cùng tham gia thảo nào đúng luận: A. 24Cr: (Ar)3d44s2. B. 24Cr2+: (Ar)3d34s1. C. 24Cr2+: (Ar)3d24s2.
Giáo án Hóa học 12 học kì 2 Tiết 56: Crom và hợp chất của Crom
1.1 K
536 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa 12 học kì 2 được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa 12 học kì 2 năm 2023 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa 12 học kì 2.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1072 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Ngày soạn : / /201
Tiết 56: CROM VÀ HỢP CHẤT CỦA CROM
A . Mục tiêu bài học :
1.Kiến thức
Trình bày được:
- Vị tri, cấu hinh electron hoa trị, tính chất vật lí (độ cứng, màu, khối lượng riêng)
của crom, số oxi hoá; tính chất hoá học của crom là tính khử (phản ứng với oxi, clo,
lưu huỳnh, dung dịch axit).
- Tính chất của hợp chất crom (III), Cr
2
O
3
, Cr(OH)
3
(tính tan, tính oxi hoá và tính
khử, tính lưỡng tính); Tính chất của hợp chất crom (VI), K
2
CrO
4
, K
2
Cr
2
O
7
(tính tan,
màu sắc, tính oxi hoá).
2.Kĩ năng
- Dự đoán và kết luận được về tính chất của crom và một số hợp chất .
- Viết cỏc PTHH thể hiện tớnh chất của crom và hợp chất crom.
- Tính thể tích hoặc nồng độ dung dịch K
2
Cr
2
O
7
tham gia phản ứng.
. Trọng tâm
Đặc điểm cấu tạo nguyên tử crom và các phản ứng đặc trưng của crom
Tính chất hoá học cơ bản của các hợp chất Cr
2
O
3
, Cr(OH)
3
, CrO
3
; K
2
CrO
4
,
K
2
Cr
2
O
7
3.Thái đô
Rèn luyện tính cẩn thận, lòng yêu thích môn hóa và phương pháp nghiên cứu khoa học
4. Định hướng năng lực đươc hình thành
- Năng lực phát hiện và giải quyết vấn đề.
- Năng lực sử dụng ngôn ngữ hóa học.
- Năng lực vận dụng kiến thức vào cuộc sống.
- Năng lực làm việc độc lập.
- Năng lực hợp tác, làm việc theo nhóm.
- Năng lực tính toán hóa học.
B . Chuẩn bị:
1.Phương pháp
Dạy học nhóm , thuyết trình, đàm thoại ….
2.Phương tiện , thiết bị
GV: Giáo án, hệ thống bài tập…
Học sinh : ôn tập ở nhà
C . Tiến trình bài dạy:
1. Ổn định lớp:
Lớp Ngày dạy
Tiết/
ngày
Sĩ số
HS vắng
Có phép Không phép
12A1
12A3
2.Kiểm tra bài cũ: kết hợp trong bài
3. Bài mới
Hoạt động 1( 2 phút) : Hoạt động khởi động
Mục tiêu: Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học
sinh tiếp nhận kiến thức chủ động, tích cực ,hiệu quả.
Hoạt động của GV Hoạt động của HS
* Chuyển giao nhiệm vụ học tập: * Thưc hiện nhiệm vụ học tập
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Crom là một trong những kim loại cứng
nhất và có rất nhiều ứng dụng trong thực
tế,muối crom mat đươc ứng dụng trong
nghành phân tích.Vậy crom và hợp chất
crom có nhứng tính chất lý –hóa gì ta vào
bài hôm nay.
Tập trung, tái hiện kiến thức
* Báo cáo kết quả và thảo luận
HS trình bày, HS khác thảo luận, nhận
xét.
* Đánh giá kết quả thực hiện nhiệm vụ học tập
Nhận xét về quá trình thực hiện nhiệm vụ học tập của học sinh; phân tích, nhận xét,
đánh giá kết quả; chốt kiến thức
Hoạt động 2(30 phút) : II. Hình thành kiến thức
Mục tiêu: Trình bày được:
- Vị tri, cấu hinh electron hoa trị, tính chất vật lí (độ cứng, màu, khối lượng riêng)
của crom, số oxi hoá; tính chất hoá học của crom là tính khử (phản ứng với oxi, clo,
lưu huỳnh, dung dịch axit).
- Tính chất của hợp chất crom (III), Cr
2
O
3
, Cr(OH)
3
(tính tan, tính oxi hoá và tính
khử, tính lưỡng tính); Tính chất của hợp chất crom (VI), K
2
CrO
4
, K
2
Cr
2
O
7
(tính tan,
màu sắc, tính oxi hoá).
Hoạt động của GV Hoạt động của HS
GV:Chuyển giao nhiệm vụ học
tập :
bằng cách chia hs thành 4 nhóm
theo số thứ tự bàn học trong lớp
+ Nhóm 1, :
Nghiên cứu vị trí – cấu hình – tính
chất vật lý của crom
+ Nhóm 2:
Nghiên cứu tính chất hóa học của
crom
+ Nhóm 3:
Nghiên cứu hợp chất crom (III)
+ Nhóm 4:
Nghiên cứu hợp chất crom (VI)
GV: bao quát chung cả lớp. Có thể
giúp đỡ các hs nếu găp khó khăn
GV giới thiệu về tính khử của kim
loại Cr so với Fe và các mức oxi hoá
hay gặp của crom
Cr không tác dụng với dung dịch
HNO
3
hoặc H
2
SO
4
đặc, nguội.
HS: Hình thành các nhóm theo quy luật
Rồi nhận nhiệm vụ học tập và làm việc theo
nhóm
HS: Thực hiện nhiệm vụ học tập thông qua
làm việc nhóm
+thỏa thuận quy tắc làm việc trong nhóm
+Tiến hành giải quyết các nhiệm vụ
+ Sau khi hoàn thành nội dung các HS hình
thành nhóm mới theo sự phân công của GV
HS:Báo cáo kết quả và thảo luận
HS cử đại diện báo cáo sản phẩm ,kết quả
thực hiện nhiệm vụ, Hs nhóm khác cùng tham
gia thảo luận
Nhóm 1 Báo cáo :
HS viết cấu hình electron nguyên tử của
Cr.
- Ô 24, nhóm VIB, chu kì 4.
- Cấu hình electron: 1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
1
hay
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
GV ?: Vì sao hợp chất Cr
3+
vừa
thể hiện tính khử, vừa thể hiện tính
oxi hoá ?
2NaCrO
2
+ 3Br
2
+ 8NaOH
2Na
2
CrO
4
+ 6NaBr + 4H
2
O
+ 3Br
2
+ 8OH
-
+
6Br
-
+ 4H
2
O
Trong dung dịch của ion
luôn có cả ion ở trạng thái cân
bằng với nhau:
[Ar]3d
5
4s
1
.
Crom là kim loại màu trắng bạc, có khối
lượng riêng lớn (d = 7,2g/cm
3
), t
0
nc
= 1890
0
C.
- Là kim loại cứng nhất, có thể rạch được thuỷ
tinh.
Nhóm 2, Báo cáo :
II.TÍNH CHẤT HOÁ HỌC
- Là kim loại có tính khử mạnh hơn sắt.
- Trong các hợp chất crom có số oxi hoá từ +1
+6 (hay gặp +2, +3 và +6).
1. Tác dụng với phi kim
2. Tác dụng với nước
Cr bền với nước và không khí do có lớp màng
oxit rất mỏng, bền bảo vệ mạ crom lên sắt
để bảo vệ sắt và dùng Cr để chế tạo thép
không gỉ.
3.Tác dụng với axit
HS viết PTHH của các phản ứng giữa kim
loại Cr với các axit HCl và H
2
SO
4
loãng.
Cr + 2HCl CrCl
2
+ H
2
Cr + H
2
SO
4
CrSO
4
+ H
2
Nhóm 3 Báo cáo :
III – HỢP CHẤT CỦA CROM
1. Hợp chất crom (III)
a) Crom (III) oxit – Cr
2
O
3
Cr
2
O
3
là chất rắn, màu lục thẩm, không tan
trong nước.
Cr
2
O
3
là oxit lưỡng tính
Cr
2
O
3
+ 2NaOH (đặc) 2NaCrO
2
+ H
2
O
Cr
2
O
3
+ 6HCl 2CrCl
3
+ 3H
2
O
b) Crom (III) hiđroxit – Cr(OH)
3
Cr(OH)
3
là chất rắn, màu lục xám, không
tan trong nước.
Cr(OH)
3
là một hiđroxit lưỡng tính
Cr(OH)
3
+ NaOH NaCrO
2
+ 2H
2
O
Cr(OH)
3
+ 3HCl CrCl
3
+ 3H
2
O
HS dẫn ra các PTHH để minh hoạ cho tính
chất đó của hợp chất Cr
3+
.
Tính khử và tính oxi hoá: Do có số oxi hoá
trung gian nên trong dung dịch vừa có tính oxi
hoá (môi trường axit) vừa có tính khử (trong
môi trường bazơ)
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
2CrCl
3
+ Zn 2CrCl
2
+ ZnCl
2
2Cr
3+
+ Zn 2Cr
2+
+ Zn
2+
Nhóm 4 Báo cáo :
2. Hợp chất crom (VI)
a) Crom (VI) oxit – CrO
3
CrO
3
là chất rắn màu đỏ thẫm.
Là một oxit axit
CrO
3
+ H
2
O H
2
CrO
4
(axit cromic)
2CrO
3
+ H
2
O H
2
Cr
2
O
7
(axit đicromic)
Có tính oxi hoá mạnh: Một số chất hữu cơ
và vô cơ (S, P, C, C
2
H
5
OH) bốc cháy khi tiếp
xúc với CrO
3
.
b) Muối crom (VI)
Là những hợp chất bền.
- Na
2
CrO
4
và K
2
CrO
4
có màu vàng (màu của
ion )
- Na
2
Cr
2
O
7
và K
2
Cr
2
O
7
có màu da cam (màu
của ion )
Các muối cromat và đicromat có tính oxi
hoá mạnh.
Đánh giá kết quả thực hiện nhiệm vụ học tập
Nhận xét về kết quả thực hiện nhiệm vụ học tập của HS Thông qua mức độ hoàn
thành yêu cầu nhiệm vụ học tập ;phân tích ,nhận xét ,đánh giá kết quả thực hiện và
những ý kiến thảo luận của HS rồi chốt kiến thức
4.Củng cố (5 phút)
* Hoạt động luyện tập
- Mục tiêu:
+ Rèn luyện kĩ năng giải bài tập
+ Phát triển năng lực tính toán hóa học
Hoạt động của GV Hoạt động của HS
* Chuyển giao nhiệm vụ học tập
1. Trong các cấu hình electron của nguyên
tử và ion crom sau đây, cấu hình electron
nào không đúng
A.
24
Cr: (Ar)3d
5
4s
1
.
B.
24
Cr: (Ar)3d
4
4s
2
.
C.
24
Cr
2+
: (Ar)3d
4
.
D.
24
Cr
3+
: (Ar)3d
3
.
2. Trong các cấu hình electron của nguyên
tử và ion crom sau đây, cấu hình electron
nào đúng
A.
24
Cr: (Ar)3d
4
4s
2
.
B.
24
Cr
2+
: (Ar)3d
3
4s
1
.
C.
24
Cr
2+
: (Ar)3d
2
4s
2
.
* Thực hiện nhiệm vụ học tập
+ Tiến hành giải quyết các nhiệm vụ
+ Chuẩn bị lên báo cáo
* Báo cáo kết quả và thảo luận
HS báo cáo sản phẩm ,kết quả thực hiện
nhiệm vụ, Hs khác cùng tham gia thảo
luận:
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
D.
24
Cr
3+
: (Ar)3d
3
.
- Bao quát, quan sát, giúp đỡ học sinh khi
gặp khó khăn.
- Gọi 1 học sinh bất kì của nhóm lên báo
cáo kết quả
Đánh giá kết quả thực hiện nhiệm vụ học tập
Nhận xét về kết quả thực hiện nhiệm vụ học tập của HS Thông qua mức độ hoàn
thành yêu cầu nhiệm vụ học tập ;phân tích ,nhận xét ,đánh giá kết quả thực hiện và
những ý kiến thảo luận của HS rồi chốt kiến thức
5. Hướng dẫn về nhà:
* Hoạt độngvận dụng tìm tòi, mở rộng:
- Mục tiêu:
+ Rèn luyện kĩ năng áp dụng kiến thức hóa học vào thực tiễn
+ Phát triển năng lực giải quyết vấn đề
Hoạt động của GV Hoạt động của HS
* Chuyển giao nhiệm vụ học tập
- Tìm hiểu trên internet, sách báo kết hợp
với kiến thức đã học cho biết tác hại của
crom với cơ thể
- Yêu cầu sp: trình bày bằng powpoin,
pano....
- Giúp đỡ học sinh khi gặp khó khăn.
* Thực hiện nhiệm vụ học tập
+ Tiến hành giải quyết các nhiệm vụ
+ Chuẩn bị lên báo cáo
* Báo cáo kết quả và thảo luận
HS báo cáo sản phẩm ,kết quả thực hiện
nhiệm vụ, Hs khác cùng tham gia thảo
luận:
Đánh giá kết quả thực hiện nhiệm vụ học tập
Nhận xét về kết quả thực hiện nhiệm vụ học tập của HS Thông qua mức độ hoàn
thành yêu cầu nhiệm vụ học tập ;phân tích ,nhận xét ,đánh giá kết quả thực hiện và
những ý kiến thảo luận của HS rồi chốt kiến thức
Ngày tháng năm 201
TỔ TRƯỞNG CM
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85
























