Chương 2: NITROGEN - SULFUR BÀI 4: NITROGEN I TRẠNG THÁI TỰ NHIÊN
II CẤU TẠO NGUYÊN TỬ VÀ PHÂN TỬ
III TÍNH CHẤT VẬT LÍ
IV TÍNH CHẤT HOÁ HỌC V ỨNG DỤNG
I. TRẠNG THÁI TỰ NHIÊN
- Trong khí quyển Trái Đất, nitrogen là nguyên tố phổ biến nhất, chiếm 75,5% khối lượng
(hoặc 78,1% thể tích) và tập trung chủ yếu ở tầng đối lưu.
- Trong vỏ Trái Đất, nguyên tố nitrogen tồn tại tập trung ở một số mỏ khoáng dưới dạng
sodium nitrate (thường goi là diêm tiêu Chile).
- Nguyên tố nitrogen có trong tất cả cơ thể động vật và thực vật, là thành phần cấu tạo
nên nucleic acid, protein,... Trong cơ thể người, nitrogen chiếm khoảng 3% khối lượng,
đứng thứ tư sau oxygen, carbon và hydrogen.
- Nguyên tố nitrogen tồn tại trong tự nhiên với hai đồng vị bền là 14N (99,63%) và 15N (0,37%). NaNO3 (sodium nitrate)
II. CẤU TẠO NGUYÊN TỬ VÀ PHÂN TỬ
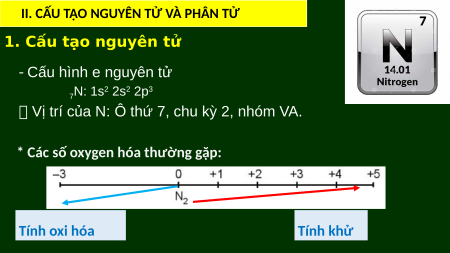
1. Cấu tạo nguyên tử
‐ Cấu hình e nguyên tử N: 1s2 2s2 2p3 7
Vị trí của N: Ô thứ 7, chu kỳ 2, nhóm VA.
* Các số oxygen hóa thường gặp: Tính oxi hóa Tính khử
Giáo án Powerpoint Nitrogen Hóa học 11 Kết nối tri thức
1 K
478 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ bài giảng điện tử Hóa học lớp 11 Kết nối tri thức được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ bài giảng powerpoint Hóa học 11 Kết nối tri thức bao gồm đầy đủ các bài giảng trong cả năm học, được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng phần học và bám sát chương trình sgk Hóa học 11 bộ Kết nối tri thức.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(956 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất

Chương 2: NITROGEN - SULFUR
BÀI 4: NITROGEN

I
II
III
IV
V

I. TRẠNG THÁI TỰ NHIÊN
NaNO
3
(sodium nitrate)
!"#$%&'( )*+,-. *-!/ 01 !&'2 -34#56*7 #,-.8#*79:;.;<"#3*0=> !
?#@8:A.B<-#(C8#DE1-F4-& !8#G'7&H-I !J3*0=&K
!EL)*+,-. !&'2 -3 *-!/ -M -N*-F4-& !H9O-P39L"#) !Q=R*QN !
PQ*&9 *-S-/?-#=T !!*01Q*29U2&#*0/DK
!&'2 -3 *-!/ 8V- !-,-8W8X-#(JO !EF-E1-#Y8EF-.01-#1 #4#I 8,&-N
2 &80/*8S8*Q.4-/* .KKK !8X-#( !=T*. *-!/ 8#*79"#W !Z<"#3*0=> !.
J[ !-#[-=PS&\'!/ .8S6 E1#'Q!/ K
!&'2 -3 *-!/ -M -N*- ! -Y #*2 ER* #S* JM ! E]6^ 01
B_
?``.aZ<D E1
B;
?b.Z:<DK
‐
Cấu hình e nguyên tử
7
N: 1s
2
2s
2
2p
3
Vị trí của N: Ô thứ 7, chu kỳ 2, nhóm VA.
II. CẤU TẠO NGUYÊN TỬ VÀ PHÂN TỬ
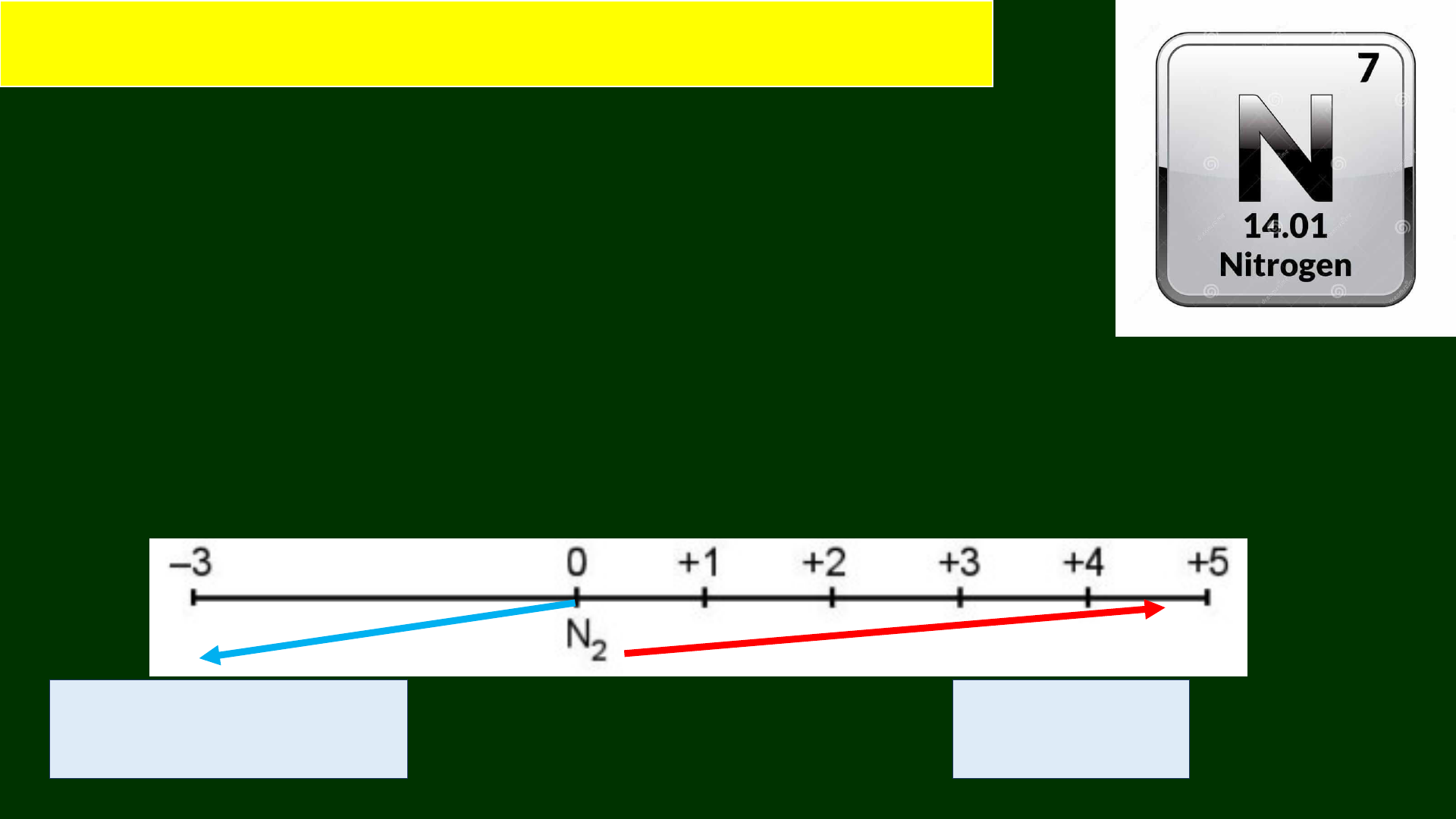
* Các số oxygen hóa thường gặp:
Tính oxi hóa Tính khử
1. Cấu tạo nguyên tử

bcd
*7-B%&)-e #\*#VSE1B%&)-e #"#f9* ##gSh
II. CẤU TẠO NGUYÊN TỬ VÀ PHÂN TỬ
1. Cấu tạo nguyên tử
N
2
→ 2N +
2.2e
b−3
N
2
+ 2.3e → 2N