TRƯỜNG THPT NGUYỄN
ĐỀ KIỂM TRA HỌC KÌ I ĐĂNG ĐẠO MÔN: Hóa – Lớp 11 TỔ: HÓA HỌC
Thời gian làm bài: 45 phút; không kể thời gian phát đề
I. TRẮC NGHIỆM KHÁCH QUAN
Câu 1 (NB): Chất nào sau đây khi tan trong nước không phân li ra ion? A. HCl B. NaOH C. NaCl D. C2H5OH (rượu)
Câu 2 (NB): Chất điện li mạnh có độ điện li (α) A. α = 0 B. α = 1 C. 0 < α <1 D. α > 1
Câu 3 (VD): Dung dịch X có [H+] = 5.10-4. Dung dịch X có môi trường A. axit B. bazơ C. trung tính D. lưỡng tính
Câu 4 (TH): Khí N2 tương đối trơ về mặt hóa học ở nhiệt độ thường do nguyên nhân chính là
A. nitơ có bán kính nguyên tử nhỏ.
B. phân tử N2 không phân cực.
C. nitơ có độ âm điện lớn nhất trong nhóm VIA.
D. liên kết trong phân tử N2 là liên kết 3, không phân cực, có năng lượng lớn.
Câu 5 (TH): Để nhận biết ion PO 3-
4 trong dung dịch muối, người ta dùng thuốc thử là
A. dung dịch AgNO3 B. dung dịch NaOH C. dung dịch HNO3 D. dung dịch Br2
Câu 6 (NB): Thành phần hóa học chính của phân lân supephotphat kép là A. Ca3(PO4)2. B. Ca(H2PO4)2. C. CaHPO4.
D. Ca(H2PO4)2 và CaSO4.
Câu 7 (TH): Phân bón nào dưới đây có hàm lượng N cao nhất? A. NH4Cl B. NH4NO3 C. Ca(NO3)2 D. (NH2)2CO
Câu 8 (TH): Khi cho 2 mol NaOH tác dụng hoàn toàn với 1 mol H3PO4 thì thu được muối là A. NaH2PO4 B. Na2HPO4 C. Na3PO4 D. Na2H2PO4
Câu 9 (TH): Dung dịch nào sau đây làm quì tím chuyển sang màu đỏ? A. NH4Cl B. NaOH C. NaCl D. Na2CO3
Câu 10 (TH): Nhiệt phân hoàn toàn AgNO3 thu được sản phẩm là A. Ag, NO2, O2 B. Ag2O, NO2, O2 C. AgNO2, O2 D. Ag, Ag2O, NO2 II. TỰ LUẬN
Câu 11 (VD): Trộn 500 ml dung dịch HNO3 0,02M với 500 ml dung dịch NaOH 0,04M thu được dung
dịch X. Tính pH của dung dịch X.
Câu 12 (VD): Hòa tan hoàn toàn 3,04 gam hỗn hợp X gồm (Fe, Cu) tác dụng hoàn toàn với dung dịch
HNO3 loãng dư, sau phản ứng thu được 0,896 lít khí NO (sản phẩm khử duy nhất, ở đktc). Tính khối
lượng mỗi kim loại trong hỗn hợp X?
Câu 13 (VD): Phản ứng của thuốc nổ đen: 2KNO3 + 3C + S 3CO2 + N2 + K2S; ΔH < 0 Trang 1
Tính phần trăm theo khối lượng các chất trong thuốc nổ đen, biết rằng thuốc nổ đen được trộn theo đúng
tỉ lệ phản ứng. Khi đốt 1 kg thuốc nổ đen có thể tạo thành khối khí có thể tích bao nhiêu (ở 273 0C và 1 atm). Đáp án 1-D 2-B 3-A 4-D 5-A 6-B 7-D 8-B 9-A 10-A LỜI GIẢI CHI TIẾT
Câu 1: Đáp án D
C2H5OH khi tan trong nước không phân li ra ion.
Câu 2: Đáp án B Phương pháp giải:
Dựa vào khái niệm chất điện li mạnh: Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion. Giải chi tiết:
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion (tức α=1).
Câu 3: Đáp án A Phương pháp giải:
Tính pH của dung dịch: pH = -log[H+]
+ pH < 7 => môi trường axit
+ pH = 7 => môi trường trung tính
+ pH > 7 => môi trường bazo
Chú ý: Không có môi trường lưỡng tính. Giải chi tiết:
pH = -log[H+] = -log(5.10-4) = 3,3
Ta thấy pH < 7 nên dung dịch X có môi trường axit
Câu 4: Đáp án D
Do phân tử N2 có chứa liên kết 3 rất bền vững, không phân cực và có năng lượng lớn nên N2 tương đối trơ
về mặt hóa học ở điều kiện thường.
Câu 5: Đáp án A Phương pháp giải:
Dựa vào phương pháp nhận biết ion PO 3-
4 bằng phương pháp hóa học. Giải chi tiết:
Ta dùng ion Ag+ để nhận biết ion PO 3-
4 do tạo kết tủa màu vàng: Ag+ + PO 3- 4 → Ag3PO4 ↓ vàng Trang 2
Câu 6: Đáp án B Phương pháp giải:
- Supephotphat đơn: Ca(H2PO4)2 và CaSO4
- Supephotphat kép: Ca(H2PO4)2 Giải chi tiết:
Thành phần hóa học chính của phân lân supephotphat kép là Ca(H2PO4)2.
Câu 7: Đáp án D
Ure (NH2)2CO là phân bón có thành phần N lớn nhất.
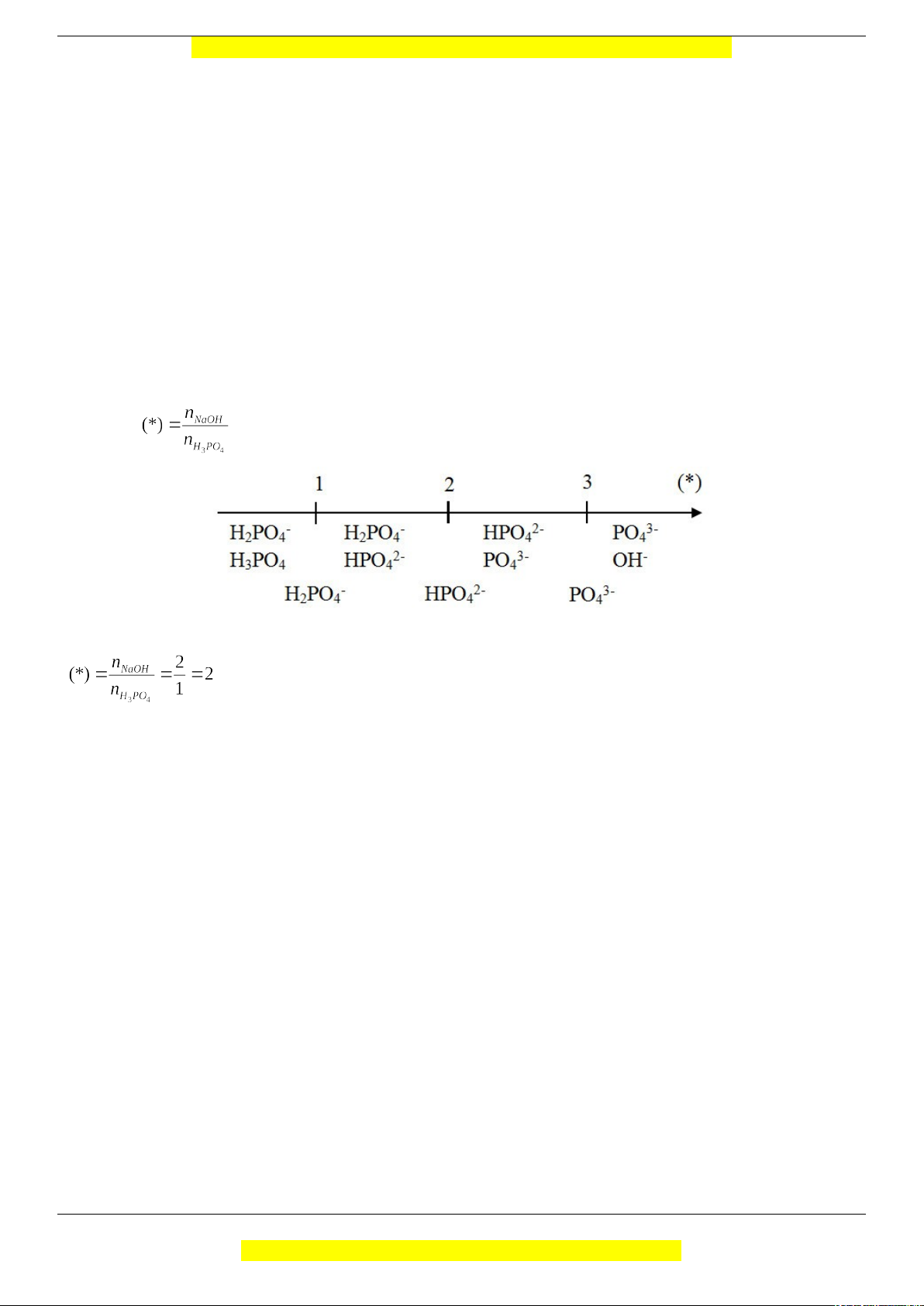
Câu 8: Đáp án B Phương pháp giải: Tính tỉ lệ Giải chi tiết: => Muối Na2HPO4
Câu 9: Đáp án A Phương pháp giải:
Dung dịch có môi trường axit làm quỳ tím chuyển đỏ.
Cách đánh giá môi trường của một dung dịch muối:
- Muối được tạo từ axit mạnh + bazo mạnh => Môi trường trung tính
- Muối được tạo bởi axit mạnh + bazo yếu => Môi trường axit
- Muối được tạo bởi axit yếu + bazo mạnh => Mối trường bazo
Chú ý: Không có môi trường lưỡng tính Giải chi tiết:
NH4Cl được tạo bởi bazo yếu (NH3) và axit mạnh HCl nên có môi trường axit => làm quỳ tím chuyển đỏ.
Câu 10: Đáp án A Phương pháp giải:
Nắm được phản ứng nhiệt phân các muối nitrat của KL:
- Muối của KL kiềm (K, Na, …), kiềm thổ (Ca, Ba, …) phân hủy thành muối nitrit + O2. Trang 3
- Muối của Mg, Zn, Fe, ..., Cu phân hủy thành oxit kim loại + NO2 + O2.
- Muối của các kim loại Ag, Au, Hg, … bị phân hủy thành các kim loại tương ứng + NO2 + O2. Giải chi tiết: 2AgNO3 2Ag + 2NO2 + O2
Câu 11: Đáp án Phương pháp giải: - Tính nH+; nOH-
- Viết PTHH dưới dạng ion - Tính toán theo PTHH
- Tính pH của dung dịch thu được sau phản ứng Giải chi tiết:
nH+ = nHNO3 = 0,02.0,5 = 0,01 mol
nOH- = nNaOH = 0,04.0,5 = 0,02 mol H+ + OH- → H2O Bđ: 0,01 0,02 (mol) Pư: 0,01→0,01 (mol) Sau: 0 0,01 (mol)
[OH-] = n/V = 0,01/(0,5 + 0,5) = 0,01M
=> pOH = -log[OH-] = -log(0,01) = 2
=> pH = 14 – pOH = 14 – 2 = 12
Vậy pH của dung dịch thu được sau phản ứng là 12.
Câu 12: Đáp án Phương pháp giải:
Cách 1: Viết và tính toán theo PTHH:
Đặt ẩn là số mol của Fe và Cu. Dựa vào dữ kiện đề bài để lập hệ phương trình.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cách 2: Sử dụng định luật bảo toàn electron:
Đặt ẩn là số mol của Fe và Cu. Dựa vào dữ kiện đề bài để lập hệ phương trình. Giải chi tiết: nNO = 0,896/22,4 = 0,04 mol
Cách 1: Viết và tính toán theo PTHH Trang 4
Đề thi học kì I Hóa lớp 11 trường THPT Nguyễn Đăng Đạo - Bắc Ninh
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ 29 Đề thi học kì 1 Hóa học năm 2023 - 2024 chọn lọc từ các trường bản word có lời giải chi tiết:
+ Đề thi học kì 1 Hóa học năm 2023 trường THPT Trần Hưng Đạo - Hà Nội;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Tenlơman - TP. Hồ Chí Minh;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Bình Chánh - TP. Hồ Chí Minh;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Quang Trung;
+Đề thi học kì 1 Hóa học năm 2023 Sở GD_ĐT tỉnh Quảng Nam.
…..……………………
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(689 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất