TRƯỜNG THPT NHỊ CHIỂU
ĐỀ KIỂM TRA HỌC KÌ I MÔN: Hóa – Lớp 11
Thời gian làm bài: 50 phút; không kể thời gian phát đề
Câu 1 (NB): Các nguyên tố nhóm halogen thuộc nhóm nào trong bảng tuần hoàn? A. VIA. B. VA. C. IVA. D. VIIA.
Câu 2 (TH): Số lượng đồng phân cấu tạo ứng với công thức phân tử C4H10 là A. 2. B. 5. C. 4. D. 3.
Câu 3 (NB): Chất nào dưới đây vừa tác dụng với dung dịch NaOH vừa tác dụng với dung dịch HCl ? A. Fe(OH)2. B. Al(OH)3. C. H2SO4. D. BaCl2.
Câu 4 (VD): Cho V lít khí CO2(đktc) hấp thụ hoàn toàn vào 4 lít dung dịch Ca(OH)2 0,01M, thu được 1
gam kết tủa và dung dịch X. Đun nóng dung dịch X lại thấy xuất hiện kết tủa.Giá trị của V là A. 1,568. B. 0,784. C. 0,224. D. 0,112.
Câu 5 (VD): Từ Ơgenol (trong tinh dầu hương nhu) điều chế được metylơgenol (M = 178 g/mol) là chất
dẫn dụ con trùng. Kết quả phân tích nguyên tố của metylơgenol cho thấy: %C = 74,16%; %H = 7,86%,
còn lại là oxi. Tổng số liên kết pi (π) và vòng (v) trong phân tử metylơgenol là (Công thức tính số liên kết
pi + số vòng của hợp chất CxHyOz là: π + v = (2x +2 -y)/2) A. 5. B. 4. C. 6. D. 3.
Câu 6 (TH): Photpho tác dụng với chất nào sau đây? A. Mg. B. NaCl. C. H2O. D. NaOH.
Câu 7 (TH): Cho các phát biểu sau:
a) Cho Cu vào HNO3 đặc sinh ra khí NO2 màu nâu đỏ.
b) Đưa than đỏ vào KNO3 nóng chảy sinh ra khí CO2 làm đục nước vôi trong
c) Cho dung dịch CaCl2 vào dung dịch Na2CO3 xuất hiện kết tủa trắng
d) Cho dung dịch NaOH vào dung dịch (NH4)2SO4, đun nhẹ có khí thoát ra làm quỳ tím ẩm hóa xanh.
Số phát biểu đúng là A. 3. B. 4. C. 2. D. 1.
Câu 8 (TH): Phương trình phản ứng nhiệt phân nào sau đây sai? A. (NH4)2CO3 2NH3 + CO2 + H2O. B. NH4NO3 NH3 + HNO3. C. NH4NO2 N2 + 2H2O. D. NH4Cl NH3 + HCl
Câu 9 (NB): Chất nào sau đây là chất điện li? A. Ancol etylic. B. Axit clohiđric. C. Saccarozơ. D. Benzen.
Câu 10 (TH): Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohi đric.
- Nhóm thứ nhất: Cân miếng kẽm 1 gam và thả vào cốc đựng 200 ml dung dịch axit HCl 2M. Trang 1
- Nhóm thứ hai: Cân 1 gam bột kẽm và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
A. nhóm thứ hai dùng axit nhiều hơn.
B. nồng độ kẽm bột lớn hơn.
C. diện tích bề mặt bột kẽm lớn hơn.
D. nhóm thứ hai dùng axit đặc hơn.
Câu 11 (VD): Cho phản ứng: N2 (k) + 3H2 (k) ⇄ 2NH3 (k). Nếu ở trạng thái cân bằng nồng độ NH3 là
0,30 mol/l, N2 là 0,05 mol/l và của H2 là 0,10 mol/l thì hằng số cân bằn của phản ứng là A. 18. B. 60. C. 3600. D. 1800.
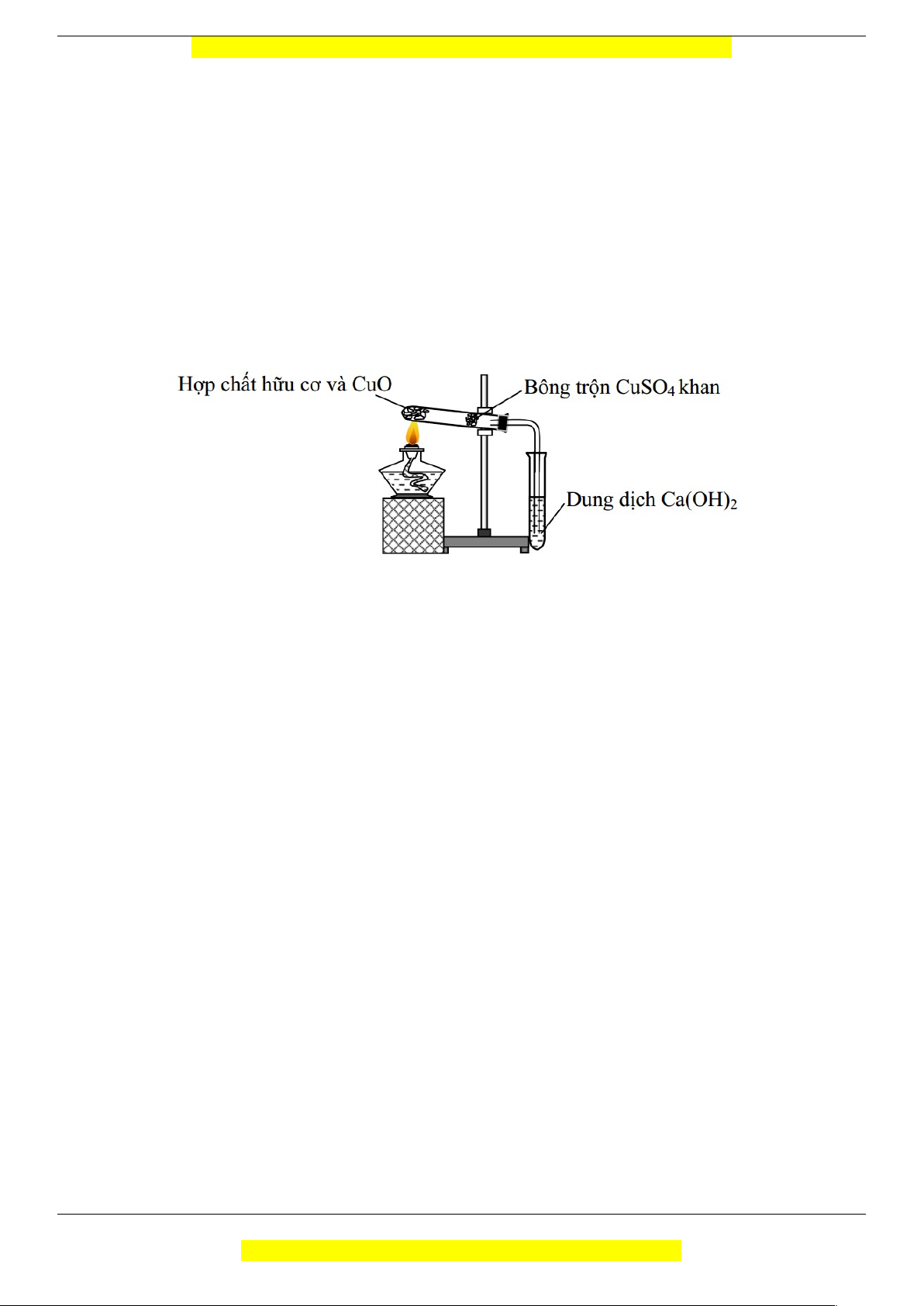
Câu 12 (TH): Cho hình vẽ mô tả quá trình định tính các nguyên tố C và H trong hợp chất hữu cơ. Vai trò
của CuSO4 (khan) và sự biến đổi màu của nó trong thí nghiệm là
A. định tính nguyên tố C và màu CuSO4 từ trắng sang màu xanh.
B. định tính nguyên tố C và màu CuSO4 từ màu xanh sang màu trắng.
C. định tính nguyên tố H và màu CuSO4 từ màu xanh sang màu trắng.
D. định tính nguyên tố H và màu CuSO4 từ màu trắng sang màu xanh.
Câu 13 (VD): Cho 31,84 gam hỗn hợp NaX và NaY (X,Y là 2 halogen ở 2 chu kì liên tiếp) vào dung
dịch AgNO3 dư thì thu được 57,34 gam hỗn hợp kết tủa.Công thức của 2 muối là A. NaF và NaBr. B. NaCl và NaBr. C. NaF và NaCl. D. NaBr và NaI.
Câu 14 (TH): Cho các dung dịch HNO3, CH3COOH, NaCl, NaOH có cùng nồng độ mol, dung dịch có pH nhỏ nhất là A. HNO3. B. NaOH. C. CH3COOH. D. NaCl.
Câu 15 (VD): Đốt cháy hoàn toàn 10,4 gam hợp chất hữu cơ Y (chứa C, H, O). Dẫn toàn bộ sản phẩm
cháy lần lượt qua bình (1) đựng H2SO4 đặc, bình (2) đựng nước vôi trong dư. Sau thí nghiệm, người ta
thấy khối lượng bình (1) tăng 3,6 gam và bình (2) thu được 30 gam kết tủa.Công thức phân tử của X là A. C4H6O4. B. C3H4O4. C. C3H6O2. D. C4H6O2.
Câu 16 (NB): Đốt cháy dây sắt trong khí clo dư, công thức muỗi thu được là A. Fe2Cl3. B. FeCl2. C. FeCl2, FeCl3. D. FeCl3.
Câu 17 (NB): Độ dinh dưỡng của phân kali được đánh giá bằng hàm lượng % của A. K. B. KOH.
C. phân kali đó so với tạp chất. D. K2O.
Câu 18 (TH): Trong phòng thí nghiệm, người ta điều chế CH4 bằng phản ứng Trang 2
A. nung natri axetat với vôi tôi - xút.
B. điện phân dung dịch natri axetat.
C. cracking n - butan. D. cacbon tác dụng với hiđro.
Câu 19 (VD): Hấp thụ hoàn toàn 12,8 gam SO2 vào 250 ml dung dịch NaOH 1M. Khối lượng các muối
tạo thành sau phản ứng là A. 18 gam và 6,3 gam.
B. 15,6 gam và 5,3 gam.
C. 15,6 gam và 6,3 gam. D. 18 gam và 5,3 gam.
Câu 20 (TH): Cấu hình electron nguyên tử của Si (Z=14) là A. 1s22s22p63s23p1 B. 1s22s22p63s23p2 C. 1s22s22p63s23p3 D. 1s22s22p63s23p4
Câu 21 (TH): Anion X3- có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của X trong bảng tuần hoàn là
A. ô thứ 16, chu kì 2, nhóm VA.
B. ô thứ 17, chu kì 3, nhóm VIIA.
C. ô thứ 15, chu kì 3, nhóm VA.
D. ô thứ 21, chu kì 4, nhóm IIIB.
Câu 22 (TH): Trong phản ứng: 2FeCl3 + H2S → 2FeCl2 + S + 2HCl. Vai trò của H2S là A. axit. B. chất khử.
C. vừa axit vừa khử. D. chất oxi hóa.
Câu 23 (TH): Tổng số liên kết xích ma (σ) trong công thức cấu tao CH2=CH2 là A. 6. B. 2. C. 5. D. 4.
Câu 24 (NB): Dãy chất nào sau đây là hợp chất hữu cơ?
A. C2H4, C6H12O6, C2H6.
B. CH3Cl, C6H5Br, NaHCO3. C. CO2, CO, CH4.
D. NaCN, SiO2, CH3COOH.
Câu 25 (TH): Phản ứng nào dưới đây NH3 không đóng vai trò chất khử? A. 4NH3 + 5O2 4NO + 6H2O
B. 2NH3 + 3Cl2 → N2 + 6HCl C. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4 D. NH3 + 3CuO 3Cu + N2 + 3H2O
Câu 26 (TH): Hai chất nào sau đây phản ứng trực tiếp được với nhau ở điều kiện thường? A. NH3, O2. B. N2, O2. C. N2, H2. D. NO, O2.
Câu 27 (TH): Hòa tan sắt (II) sunfua vào dung dịch HCl thu được khí X. Đốt hoàn toàn khí X thu được
khí Y có mùi hắc. Khí X, Y lần lượt là A. SO2, H2S. B. H2S, hơi S. C. H2S, SO2. D. SO2, hơi S.
Câu 28 (NB): Các số oxi hóa thường gặp của cacbon là A. -4, -2, 0, +2. B. -4, 0, +2, +4. C. -3, -1, 0, +4. D. -2, +2, 0, -3.
Câu 29 (TH): Số lượng đồng phân mạch hở ứng với công thức C3H6Cl2 là: A. 2. B. 4. C. 3. D. 5.
Câu 30 (TH): Cho luồng khí CO (dư) qua hỗn hợp các oxit CuO, Fe2O3, Al2O3, MgO nung ở nhiệt độ
cao. Sau phản ứng hỗn hợp rắn còn lại là: A. Cu, FeO, Al2O3, Mg. B. Cu, Fe, Al, Mg. C. Cu, Fe, Al2O3, MgO.
D. Cu, Fe2O3, Al2O3, MgO. Trang 3
Câu 31 (NB): Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. notron và electron. B. proton và notron.
C. electron và proton. D. electron, proton và notron.
Câu 32 (TH): Cho phản ứng : aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O. Hệ số a, b, c, d, e là các số
nguyên, tối giản. Tổng (a+b) bằng A. 4. B. 6. C. 7. D. 5.
Câu 33 (VD): Dung dịch X chứa các ion: Ca2+, Na+, HCO -3, Cl-. Trong đó, số mol của ion Cl- là 0,1 mol.
Chia X thành hai phần bằng nhau. Phần 1 cho phản ứng với dung dịch NaOH (dư), thu được 2 gam kết
tủa.Phần 2 cho phản ứng với dung dịch Ca(OH)2 (dư) thu được 3 gam kết tủa. Mặt khác, nếu đun sôi đến
cạn dung dịch X thì thu được m gam kết chất rắn khan. Giá trị của m là A. 9,21. B. 9,26. C. 8,79. D. 7,47.
Câu 34 (VDC): Hòa tan hết 2,72 gam hỗn hợp X gồm: FeS2, FeS, Fe, CuS và Cu trong 500 ml dung dịch
HNO3 1M, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,07 mol một chất khí. Cho Y tác dụng
với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Mặt khác, dung dịch Y có thể hòa tan tối đa m
gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 là NO. Giá trị của m là A. 5,92. B. 4,96. C. 9,76. D. B và C đúng.
Câu 35 (NB): Trong tự nhiên photpho có thể tồn tại dạng quặng A. Cacnanit. B. Photphorit. C. Apatit. D. B và C đúng
Câu 36 (TH): Trường hợp nào sau đây không dẫn điện được?
A. Dung dịch KCl trong nước.
B. Nước sông, hồ, ao. C. KCl rắn, khan. D. Nước biển.
Câu 37 (TH): Chọn cách phát biểu đúng nhất trong các câu sau đây?
Đồng phân là những chất
A. khác nhau nhưng có cùng công thức phân tử.
B. có cùng tính chất hóa học.
C. có cùng thành phần nguyên tố.
D. có khối lượng phân tử bằng nhau.
Câu 38 (TH): Tại sao dung dịch của axit, bazơ, muối dẫn điện được?
A. Do các ion hợp phần có khả năng dẫn điện.
B. Do có sự di chuyển của electron tạo thành dòng elctron.
C. Do phân tử của chúng dẫn điện được.
D. Do axit, bazơ, muối có khả năng phân li ra ion trong dung dịch.
Câu 39 (VDC): Cho 3,48 gam Mg tan hết trong dung dịch hỗn hợp gồm HCl (dư) và KNO3, thu được
dung dịch X chứa m gam muối và 0,56 lít (đktc) khí Y gồm N2 và H2. Khí Y có tỉ khối so với H2 bằng 11,4. Giá trị của m là A. 16,085. B. 14,485. C. 18,300. D. 18,035. Trang 4
Đề thi học kì I Hóa lớp 11 trường THPT Nhị Chiểu - Hải Dương
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ 29 Đề thi học kì 1 Hóa học năm 2023 - 2024 chọn lọc từ các trường bản word có lời giải chi tiết:
+ Đề thi học kì 1 Hóa học năm 2023 trường THPT Trần Hưng Đạo - Hà Nội;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Tenlơman - TP. Hồ Chí Minh;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Bình Chánh - TP. Hồ Chí Minh;
+Đề thi học kì 1 Hóa học năm 2023 trường THPT Quang Trung;
+Đề thi học kì 1 Hóa học năm 2023 Sở GD_ĐT tỉnh Quảng Nam.
…..……………………
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(558 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất