AMONIA Bài 4 & MUỐI AMMONIUM
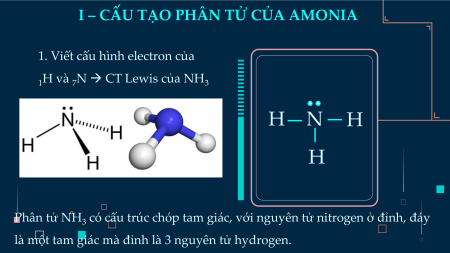
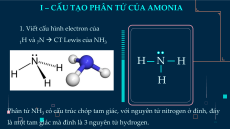
I – CẤU TẠO PHÂN TỬ CỦA AMONIA
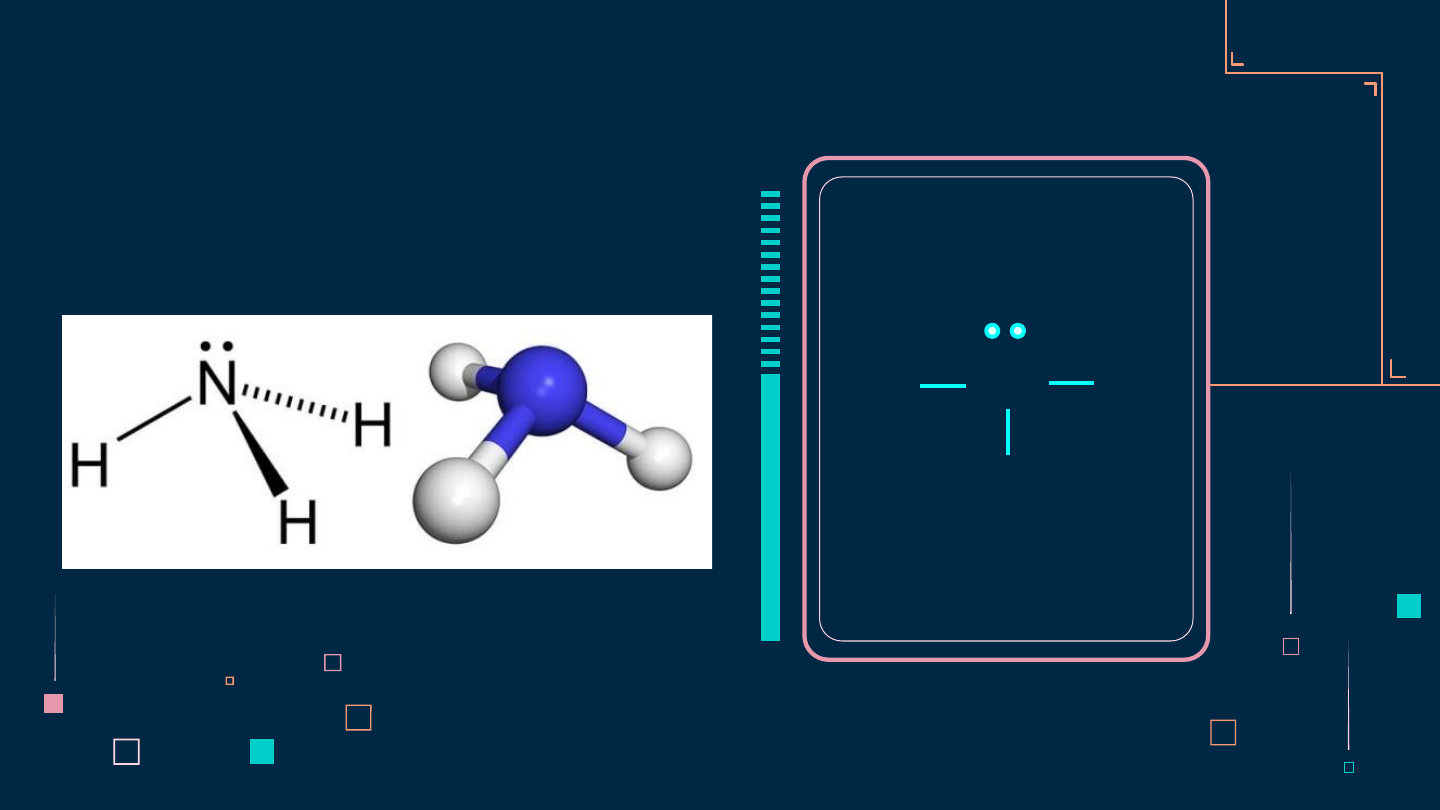
1. Viết cấu hình electron của
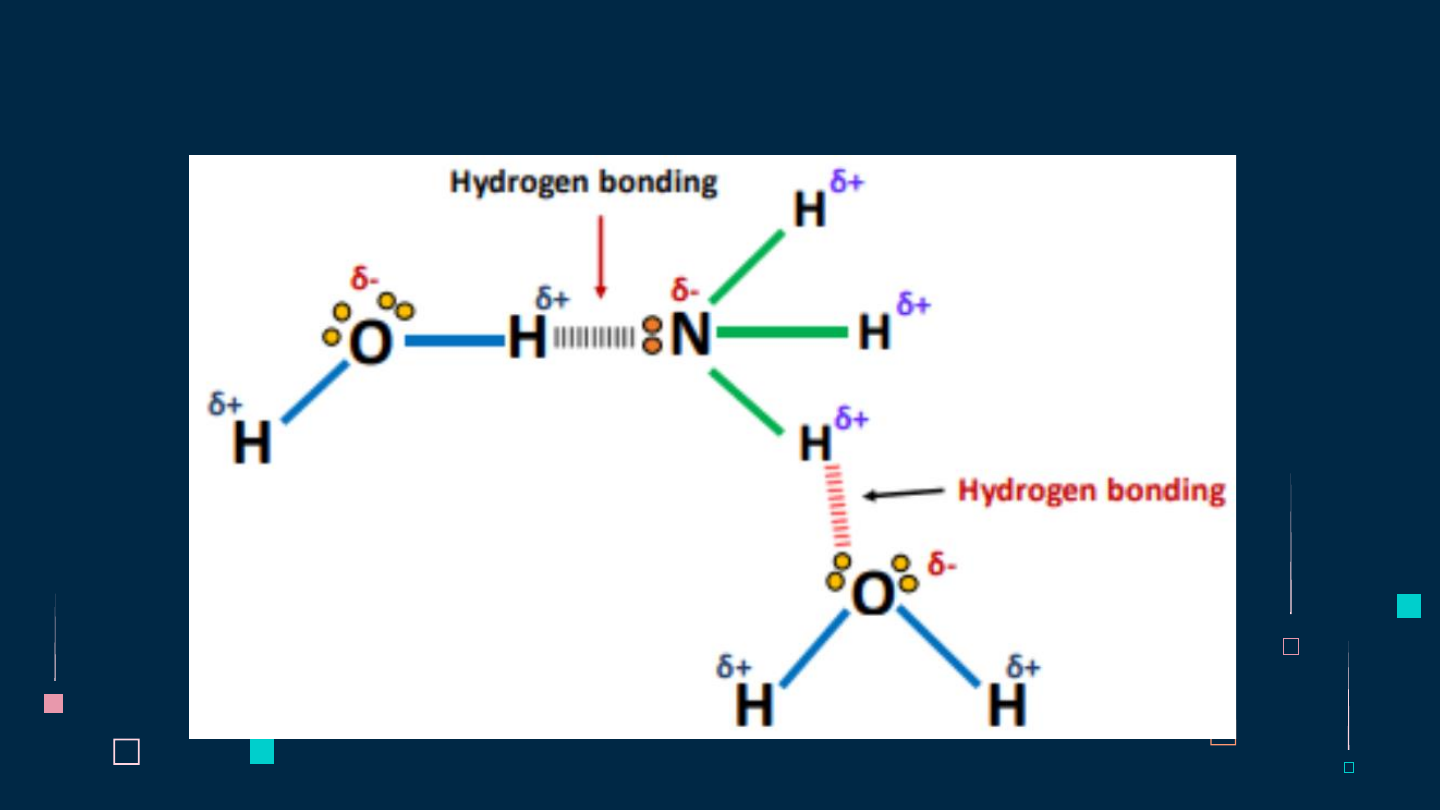
1H và 7N → CT Lewis của NH3 H N H H
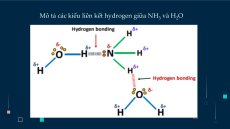
Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy
là một tam giác mà đỉnh là 3 nguyên tử hydrogen.
II – TÍNH CHẤT CỦA AMONIA
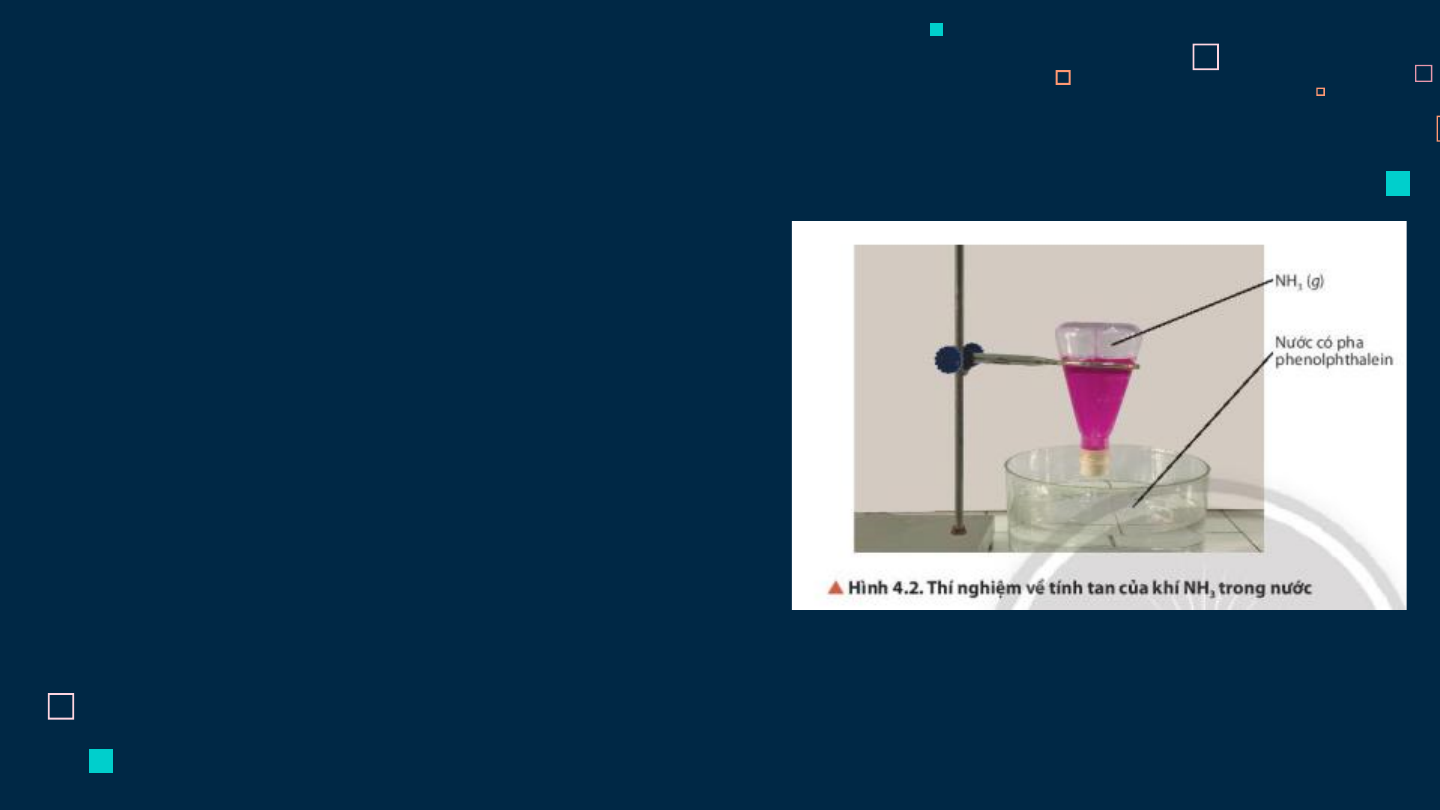
1) Tính chất vật lý Quan sát video thí nghiệm:
+ Nêu trạng thái, màu sắc của NH3.
+ Giải thích hiện tượng quan sát.
II – TÍNH CHẤT CỦA AMONIA
1) Tính chất vật lý
- Khí , không màu , mùi khai, xốc và độc
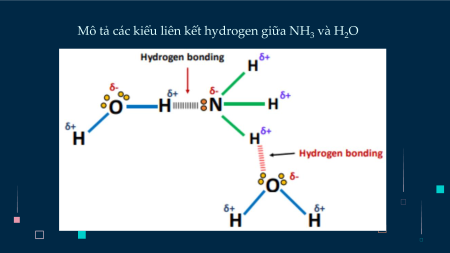
- Tan rất nhiều trong nước.
- dNH3 / KK = 17/29 < 1 → nhẹ hơn
không khí → thu khí NH3 bằng phương pháp đẩy không khí.
Document Outline
- Slide 1: AMONIA & MUỐI AMMONIUM
- Slide 2: I – CẤU TẠO PHÂN TỬ CỦA AMONIA
- Slide 3: II – TÍNH CHẤT CỦA AMONIA
- Slide 4: II – TÍNH CHẤT CỦA AMONIA
- Slide 5
- Slide 6: II – TÍNH CHẤT CỦA AMONIA
- Slide 7: II – TÍNH CHẤT CỦA AMONIA
- Slide 8: II – TÍNH CHẤT CỦA AMONIA
- Slide 9: II – TÍNH CHẤT CỦA AMONIA
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14: IV. MUỐI AMMONIUM
- Slide 15: IV. MUỐI AMMONIUM
- Slide 16: IV. MUỐI AMMONIUM
- Slide 17: IV. MUỐI AMMONIUM
- Slide 18: IV. MUỐI AMMONIUM
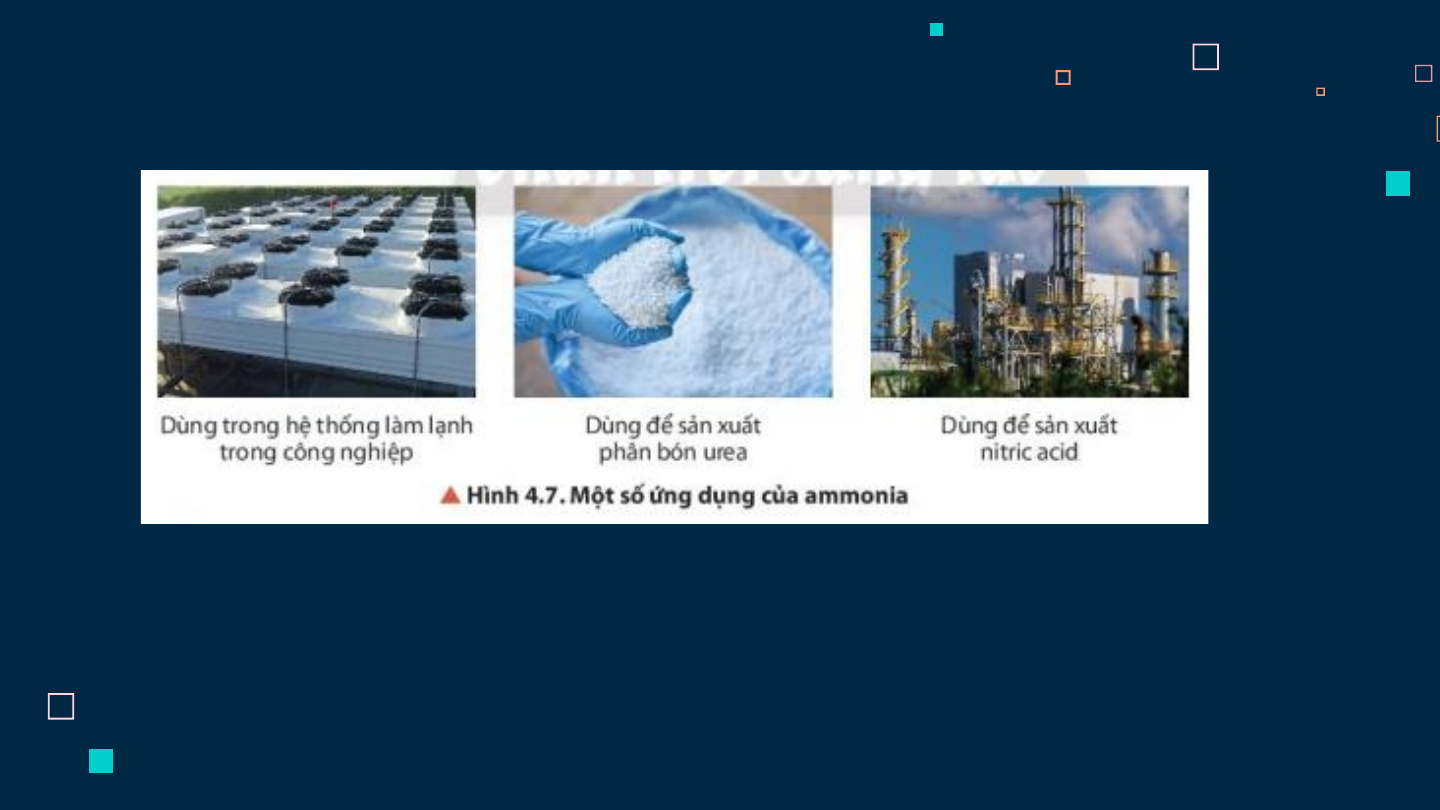
- Slide 19: V. ỨNG DỤNG AMONIA VÀ MUỐI AMMONIUM
- Slide 20
- Slide 21: V. ỨNG DỤNG CỦA AMONIA & MUỐI AMMONIUM
- Slide 22: CỦNG CỐ
- Slide 23: CỦNG CỐ
- Slide 24: THANKS