BÀI 2:
CÂN BẰNG TRONG DUNG DỊCH NƯỚC 1
01 SỰ ĐIỆN LI, CHẤT ĐIỆN LI,
CHẤT KHÔNG ĐIỆN LI NỘI
02 THUYẾT BRONSTED – LOWRY VỀ AC I D - BA S E DUNG
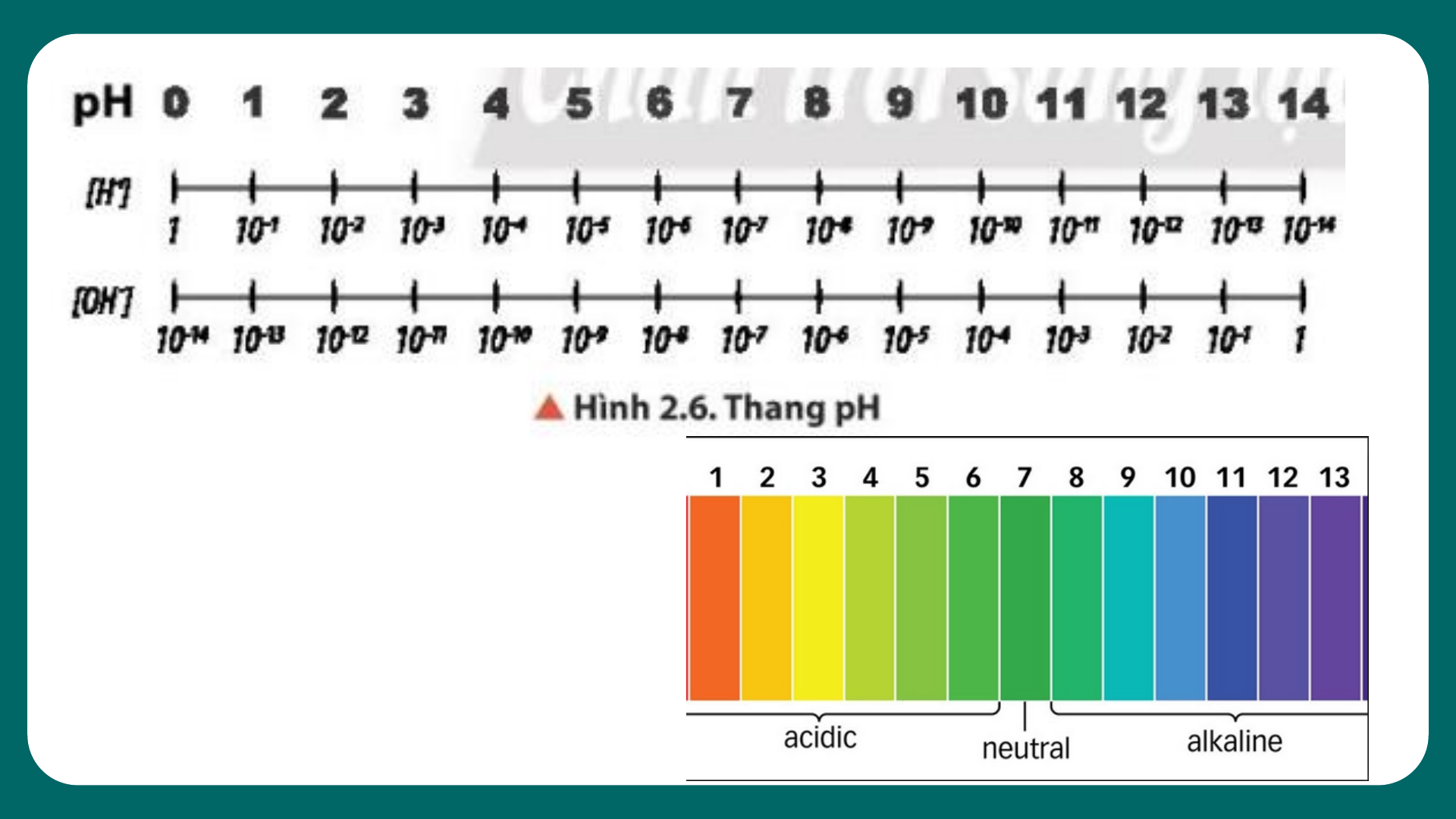
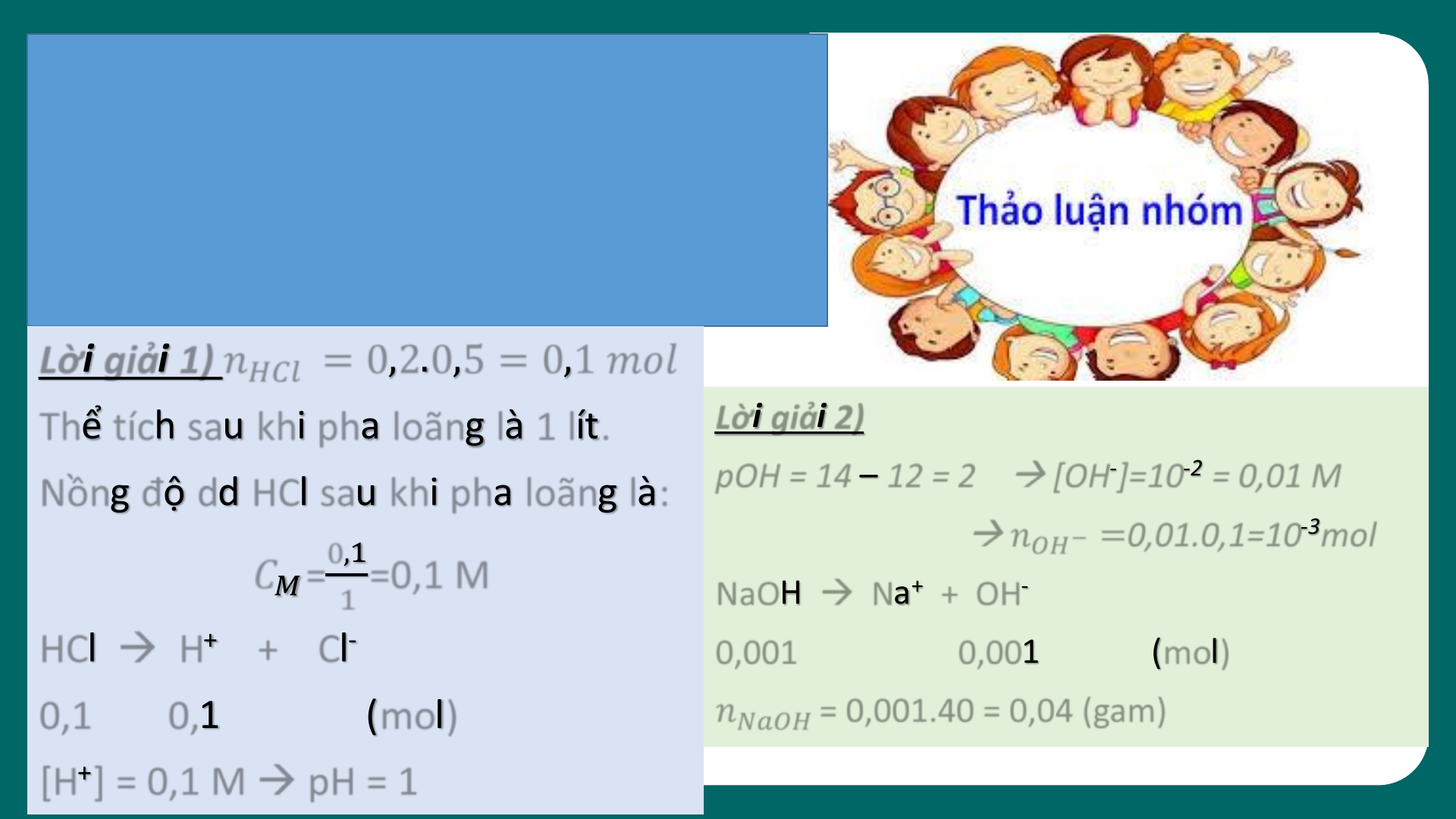
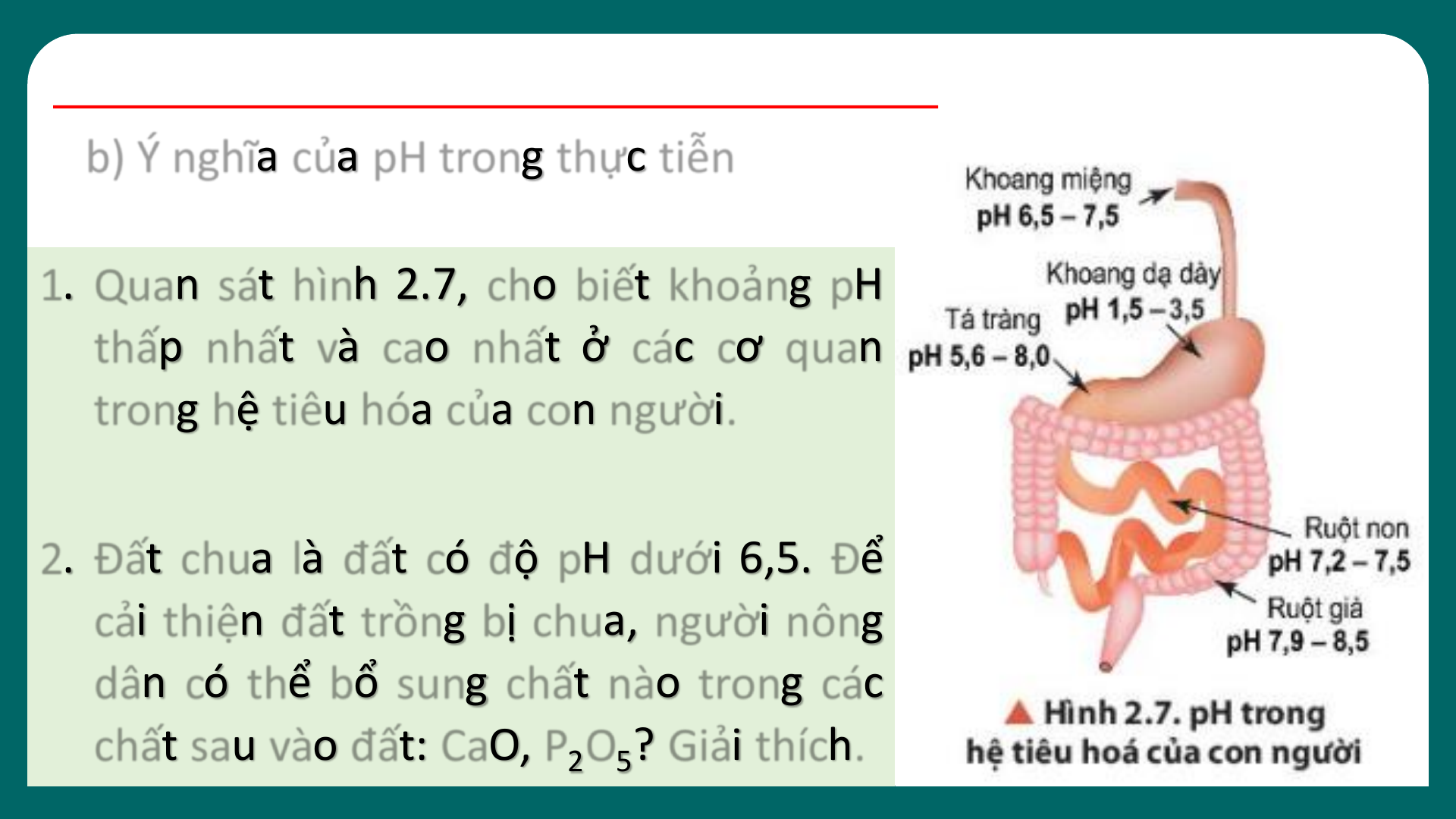
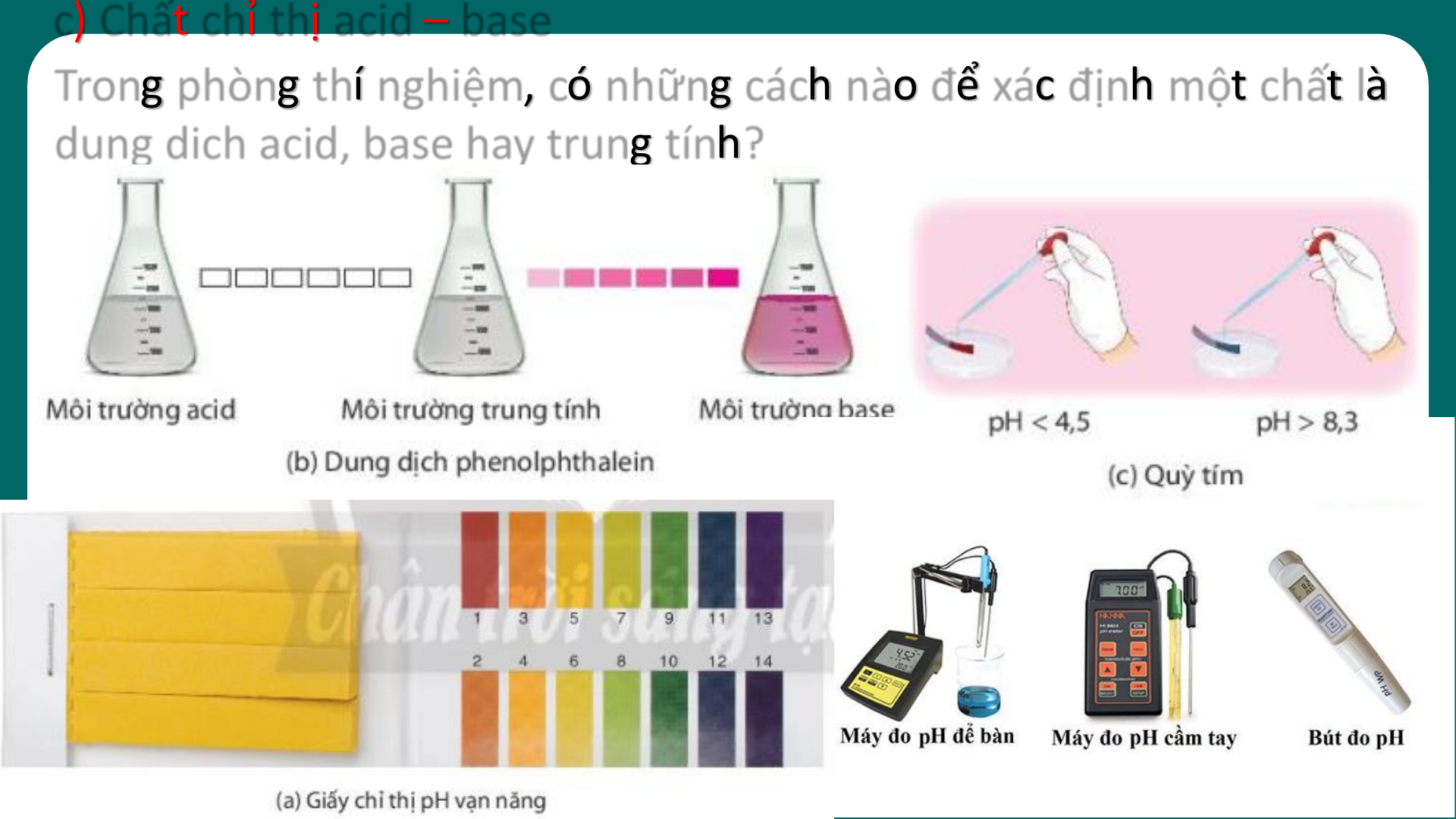
03 KHÁI NIỆM VỀ pH. CHẤT CHỈ THỊ AC I D – BA S E
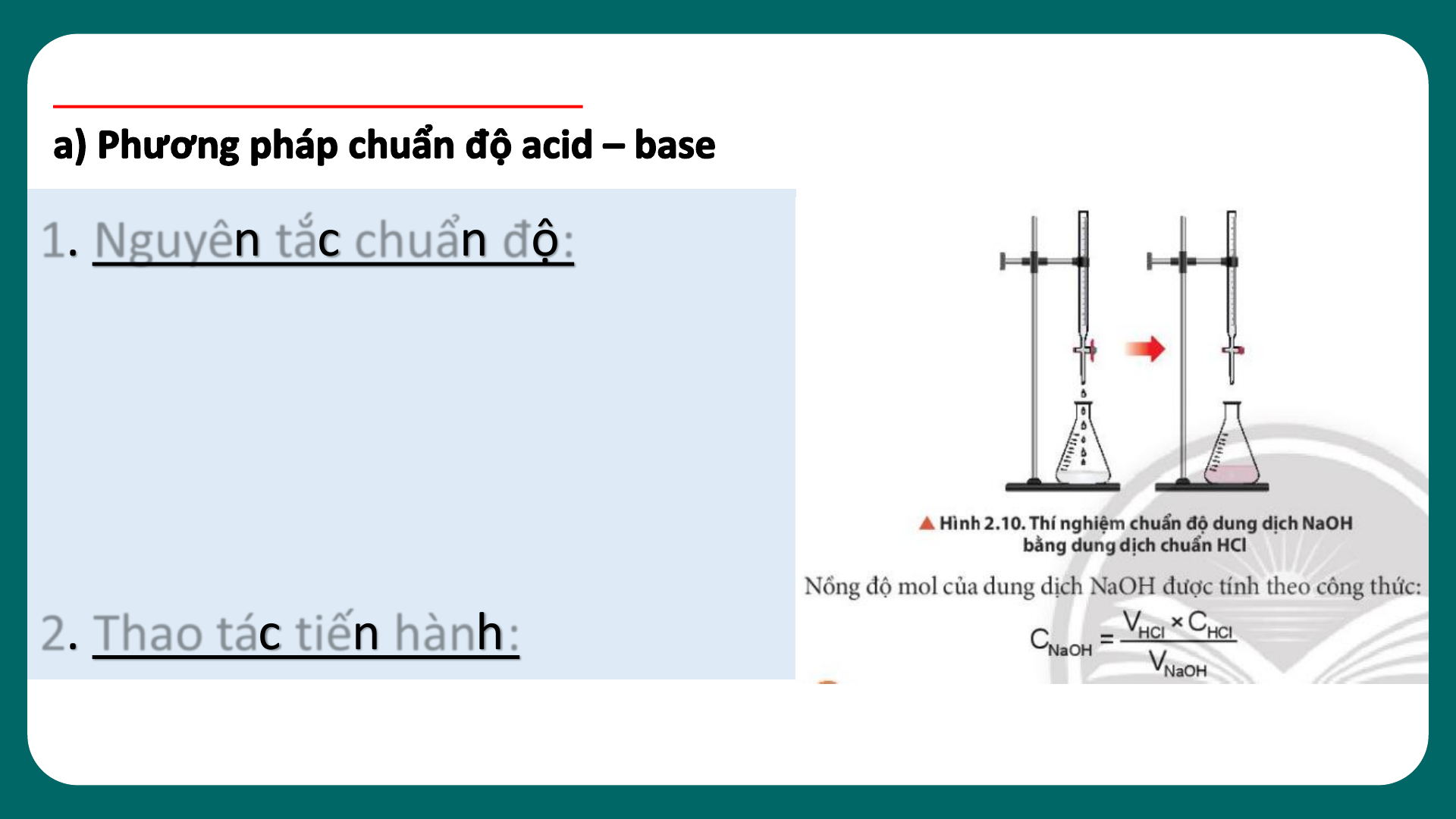
04 CHUẨN ĐỘ ACID – BASE
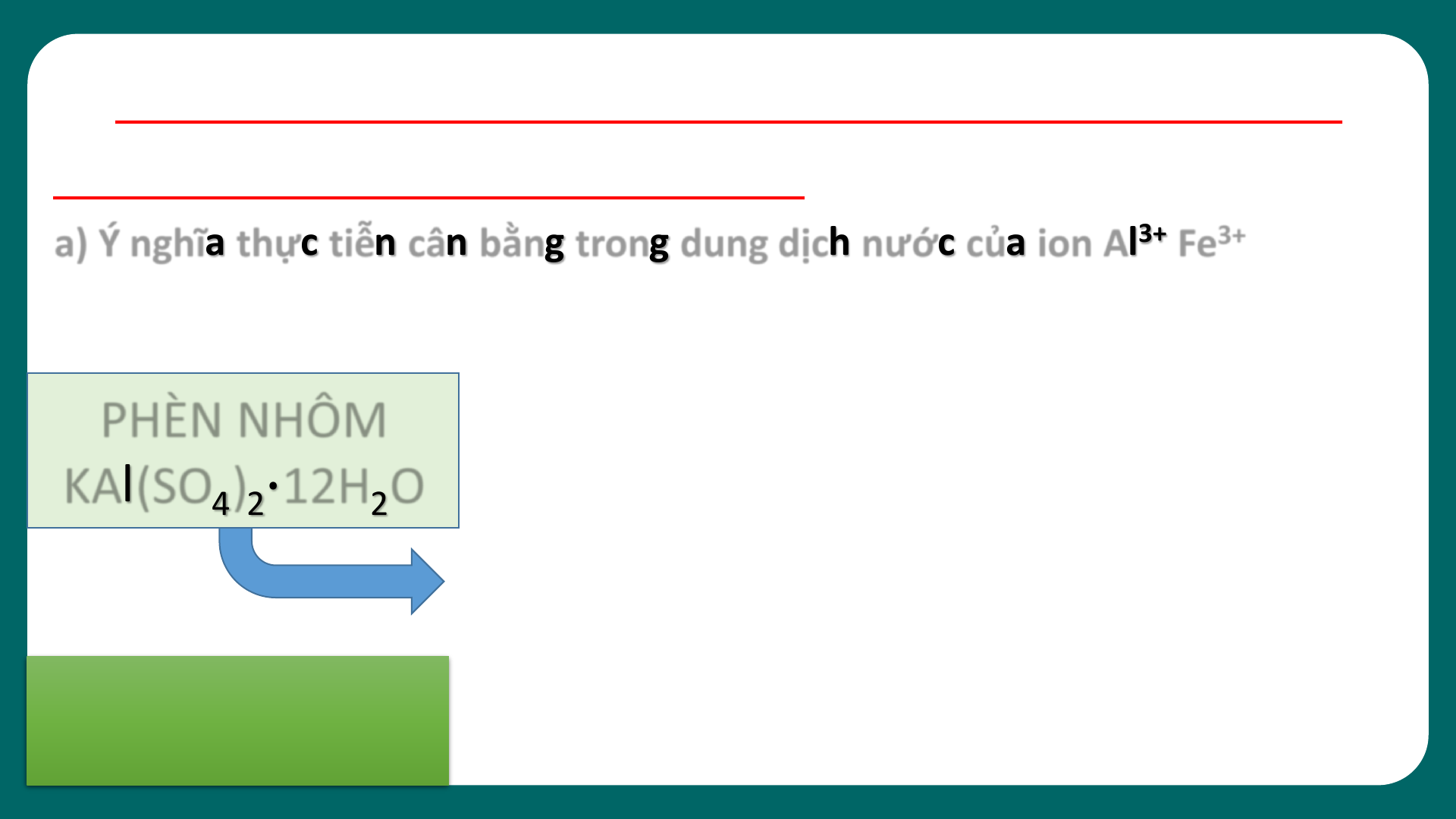
Ý N G H Ĩ A T H ỰC T I Ễ N C Â N BẰ N G
05 TRONG DUNG DỊCH NƯỚC CỦA
I O N A l 3+, Fe 3+ và CO 2- 3 2
01 SỰ ĐIỆN LI, CHẤT ĐIỆN LI,
CHẤT KHÔNG ĐIỆN LI 3
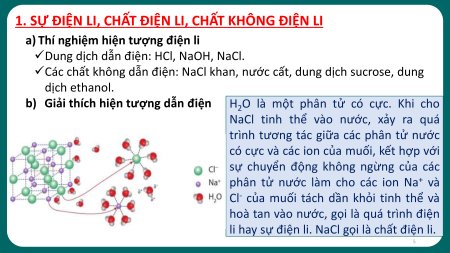
1. SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
a) Thí nghiệm hiện tượng điện li
1. Nêu khái niệm dòng điện?
2. Đèn sáng cho thấy dung dịch NaCl
dẫn điện, chứng tỏ trong dịch có
hạt mang điện. Đó có thể là loại hạt
nào (electron, cation, anion hay phân tử NaCl)?
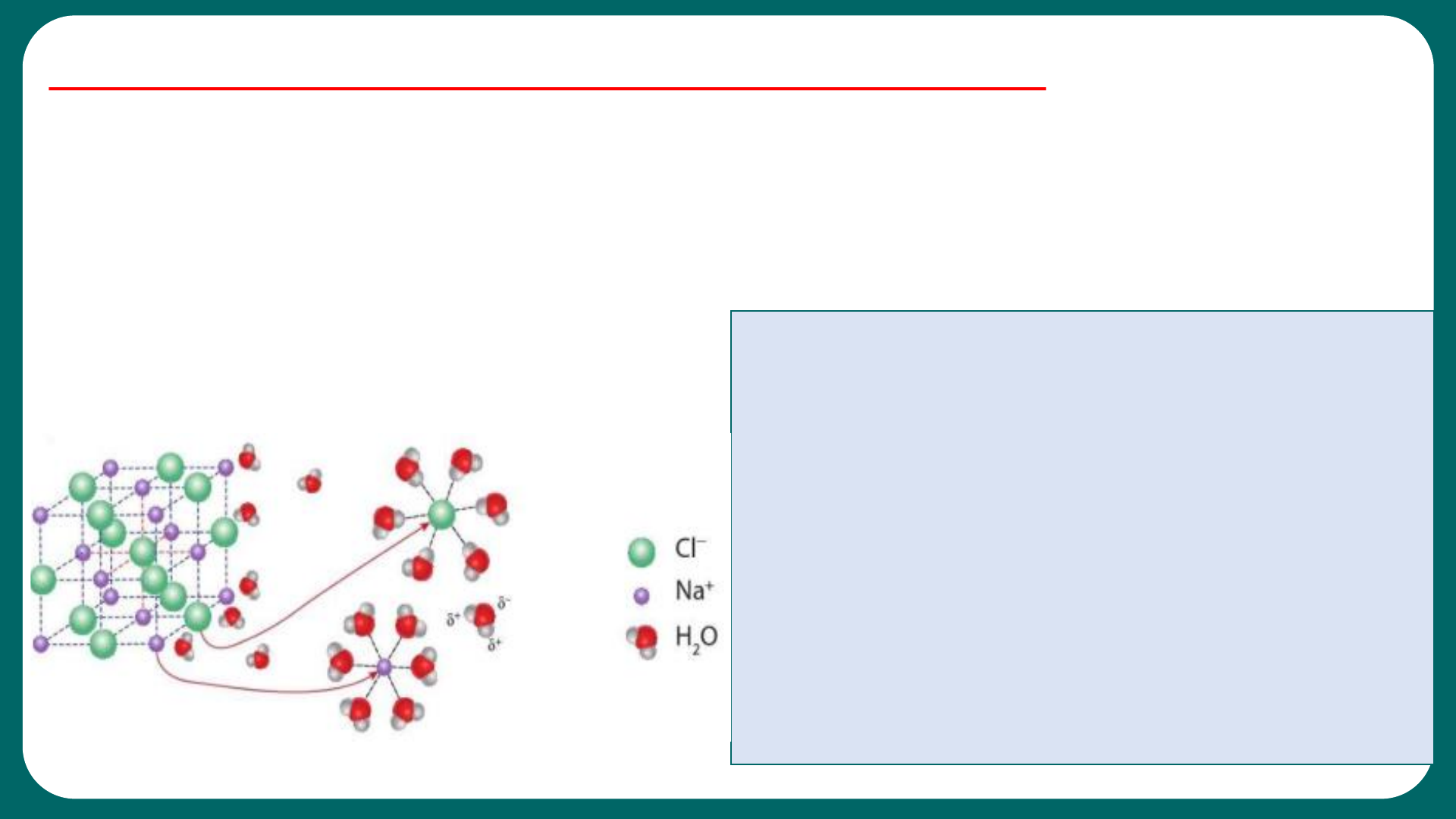
3. Hãy giải thích sự tạo thành hạt mang điện đó. 4
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32