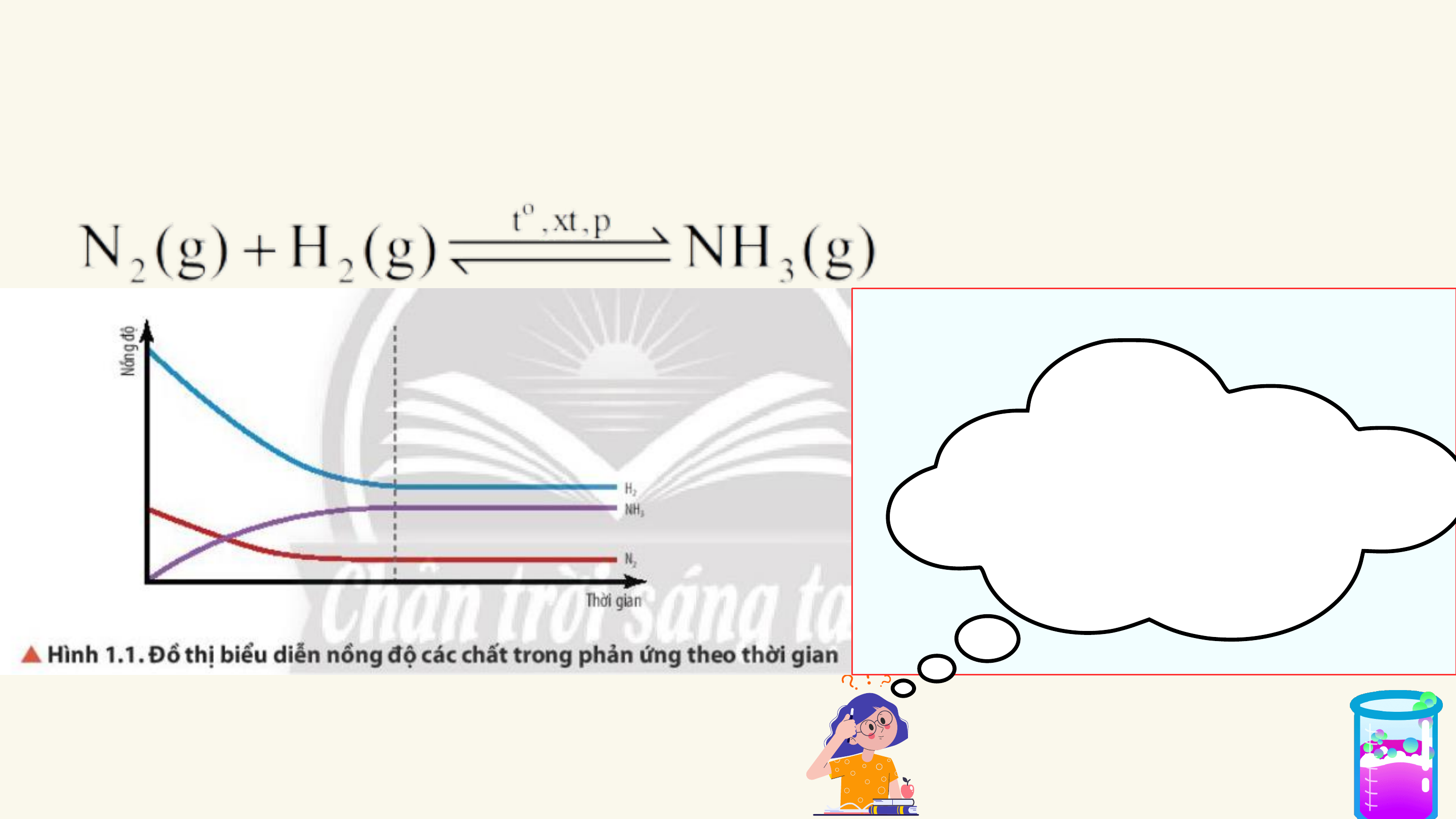
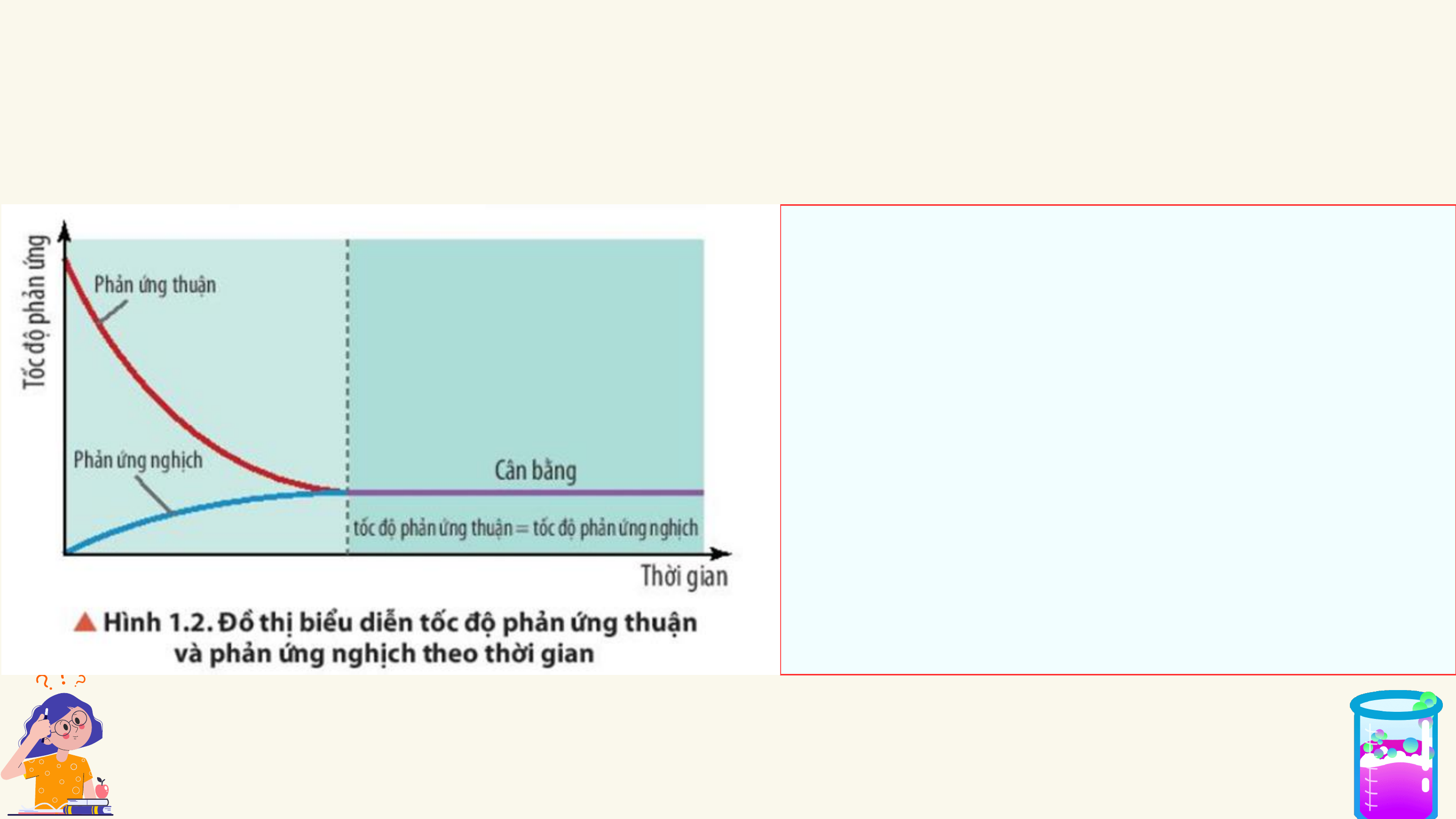
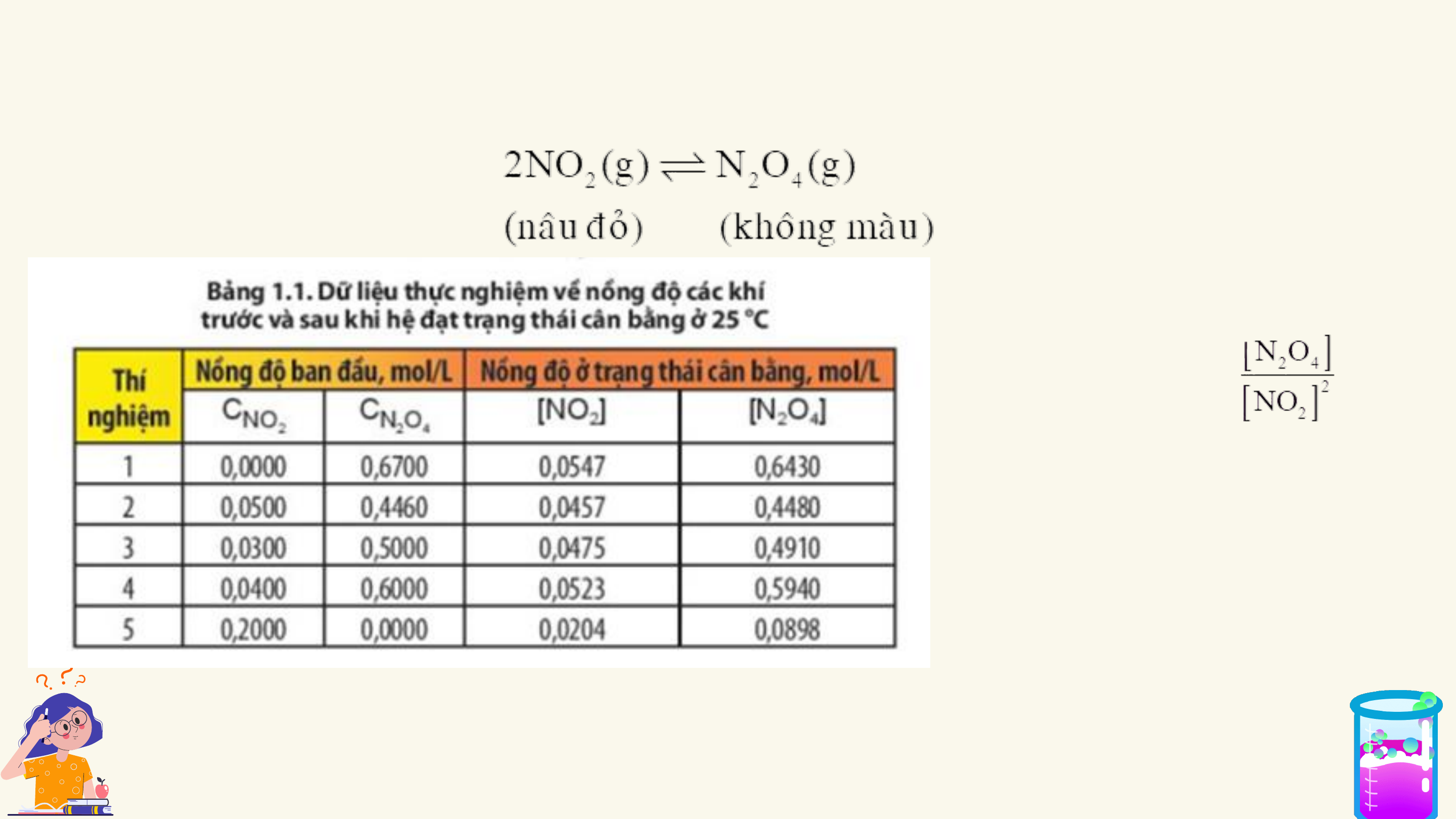
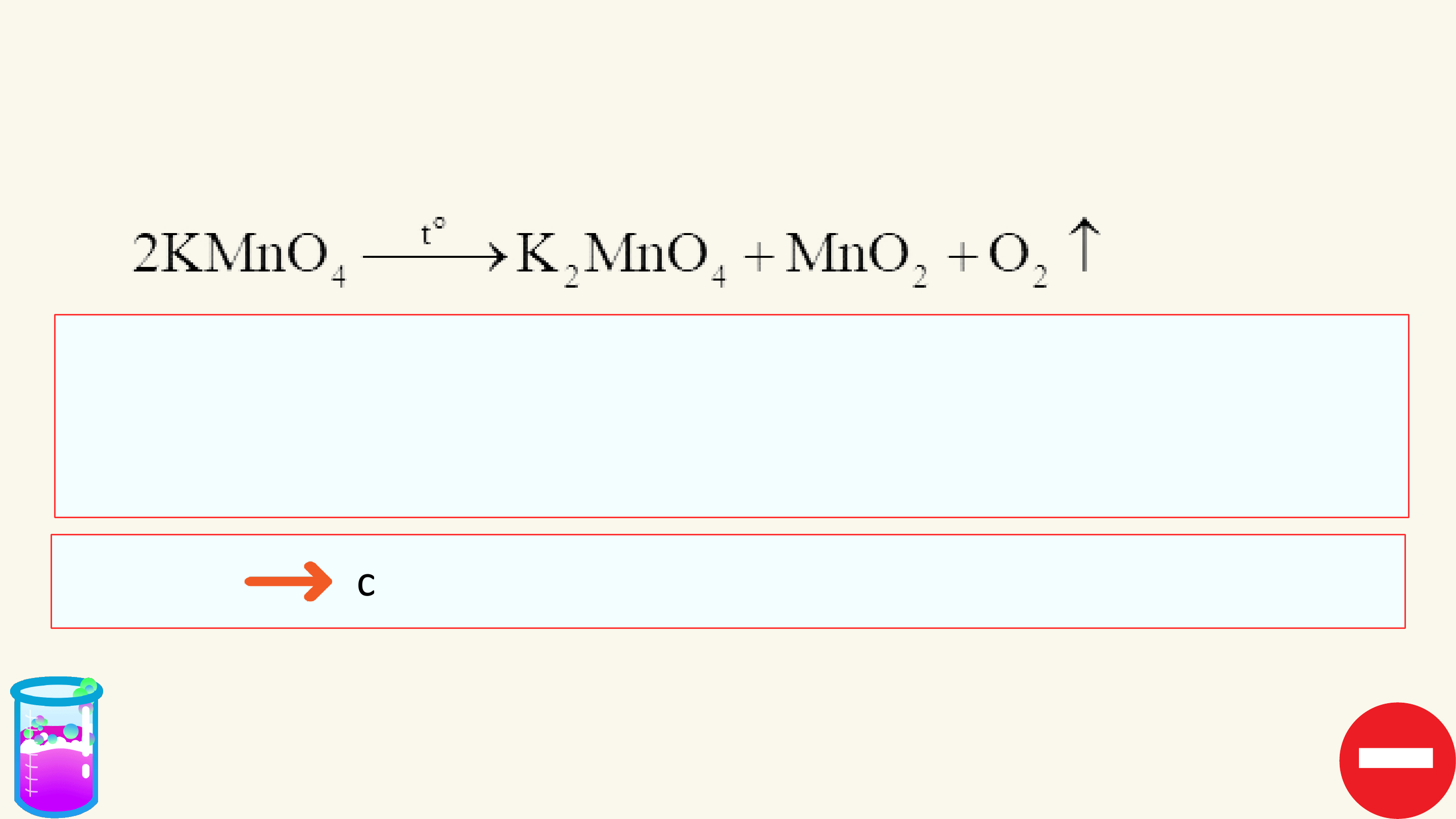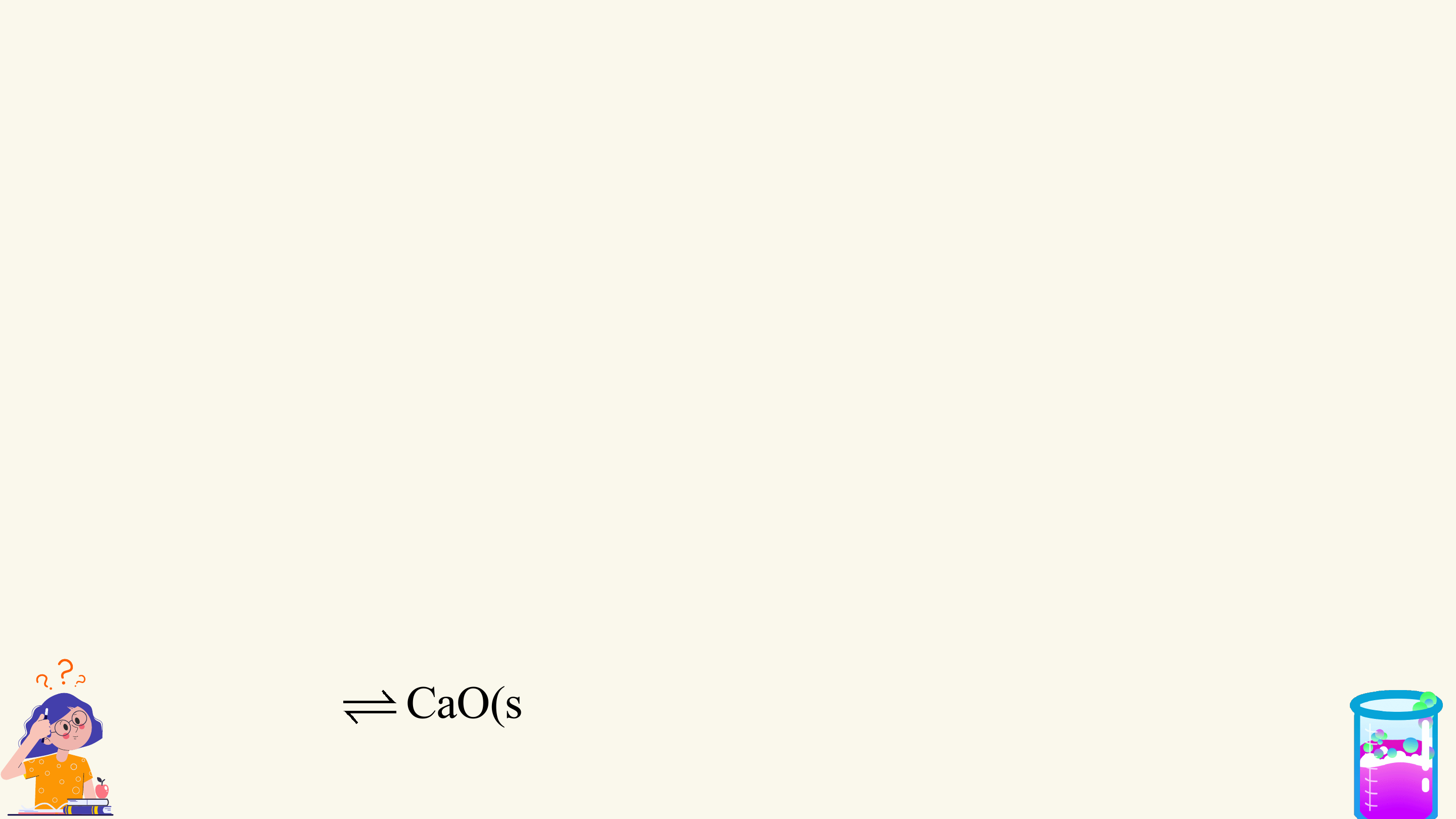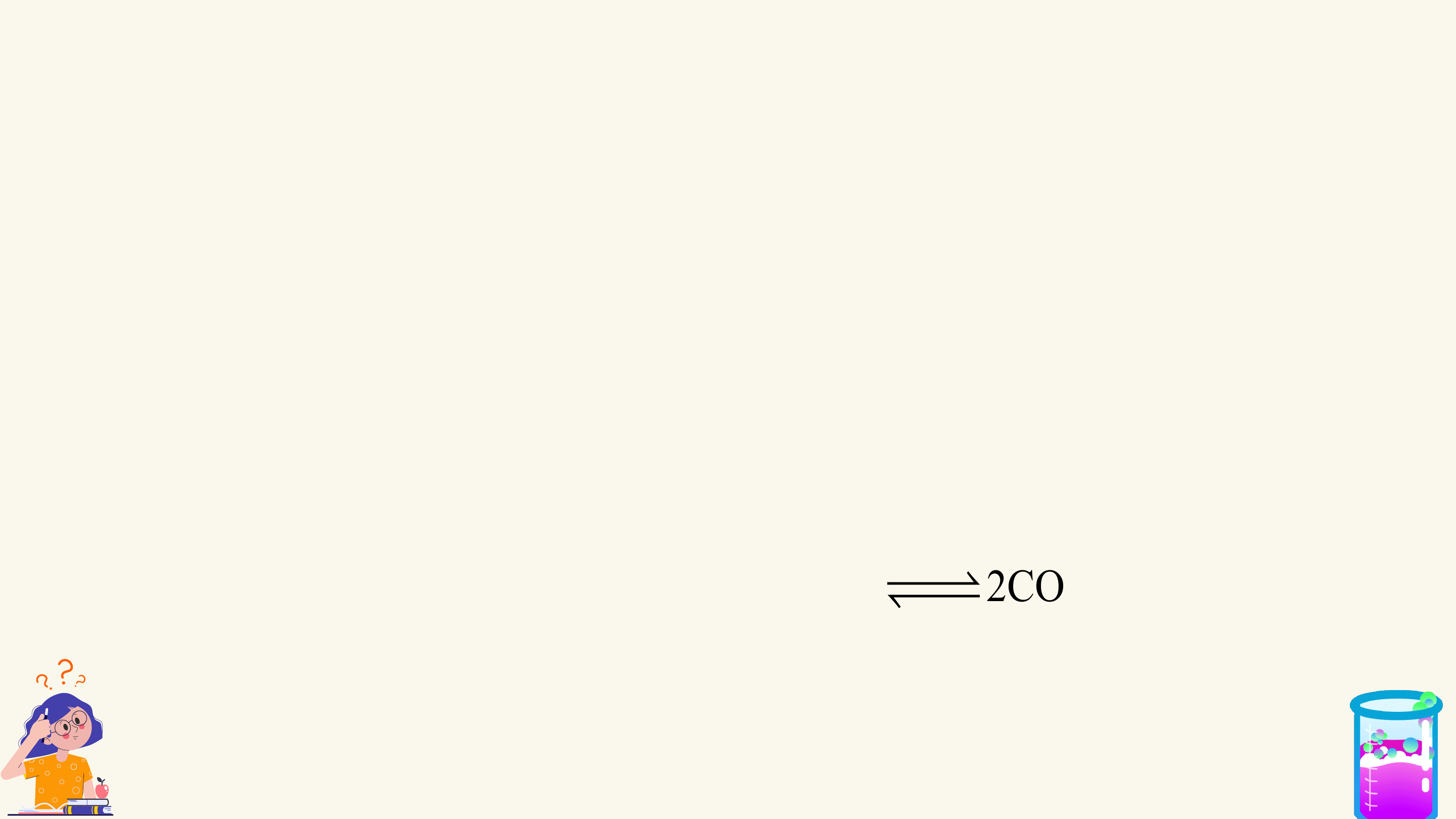CHƯƠNG I. CÂN BẰNG HÓA HỌC
BÀI 1. KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
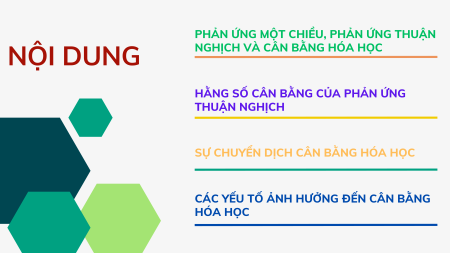
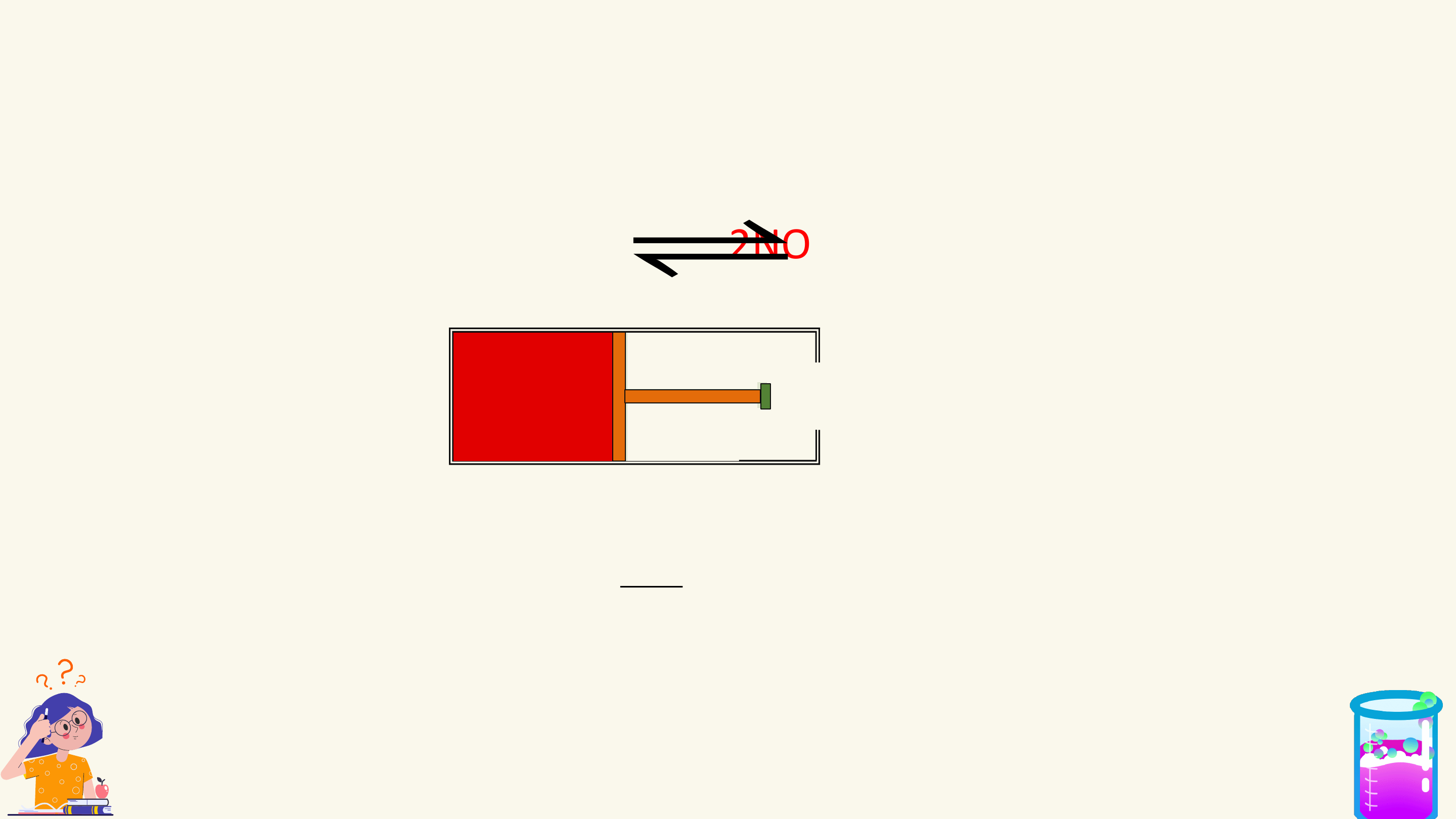
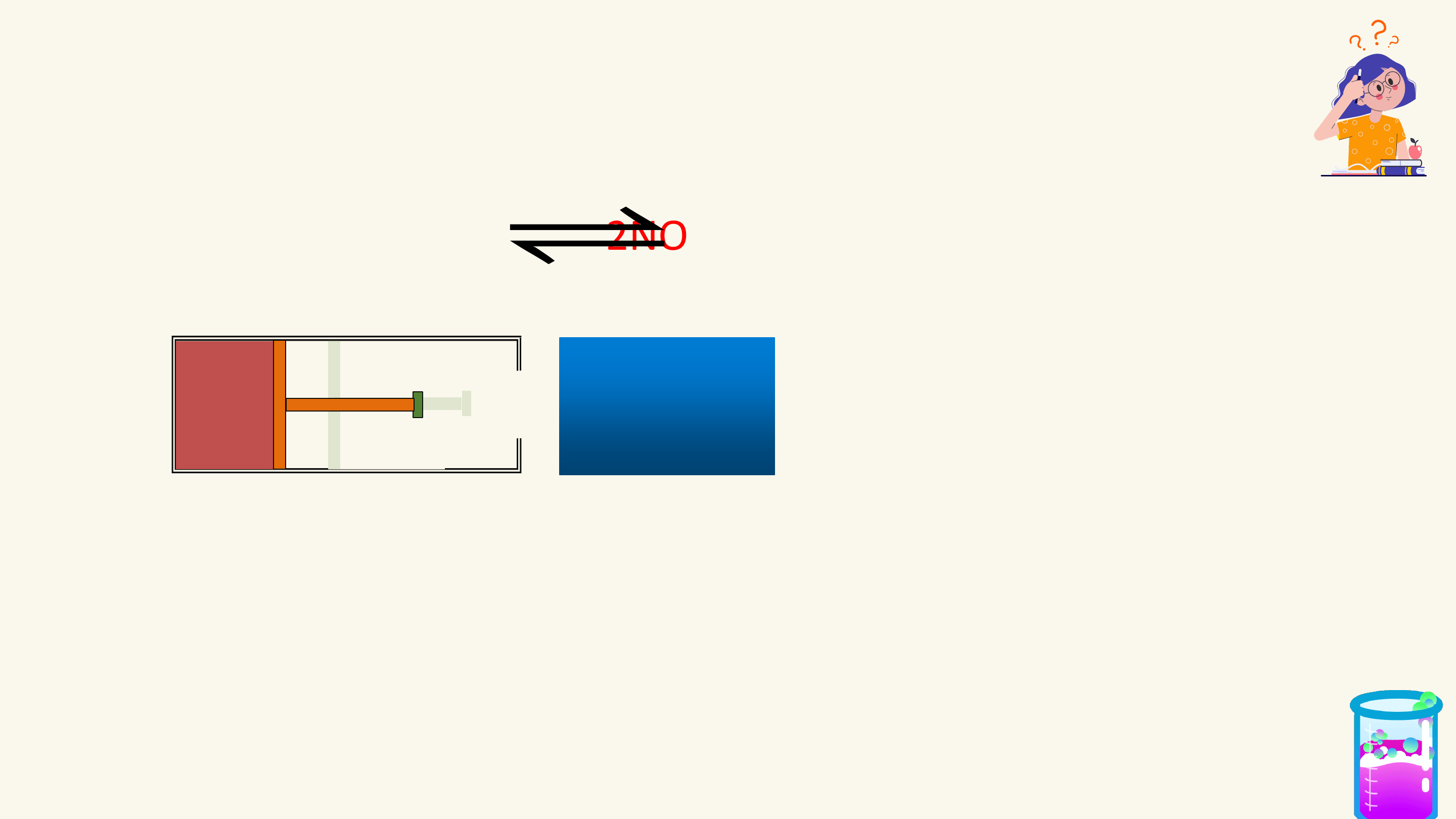
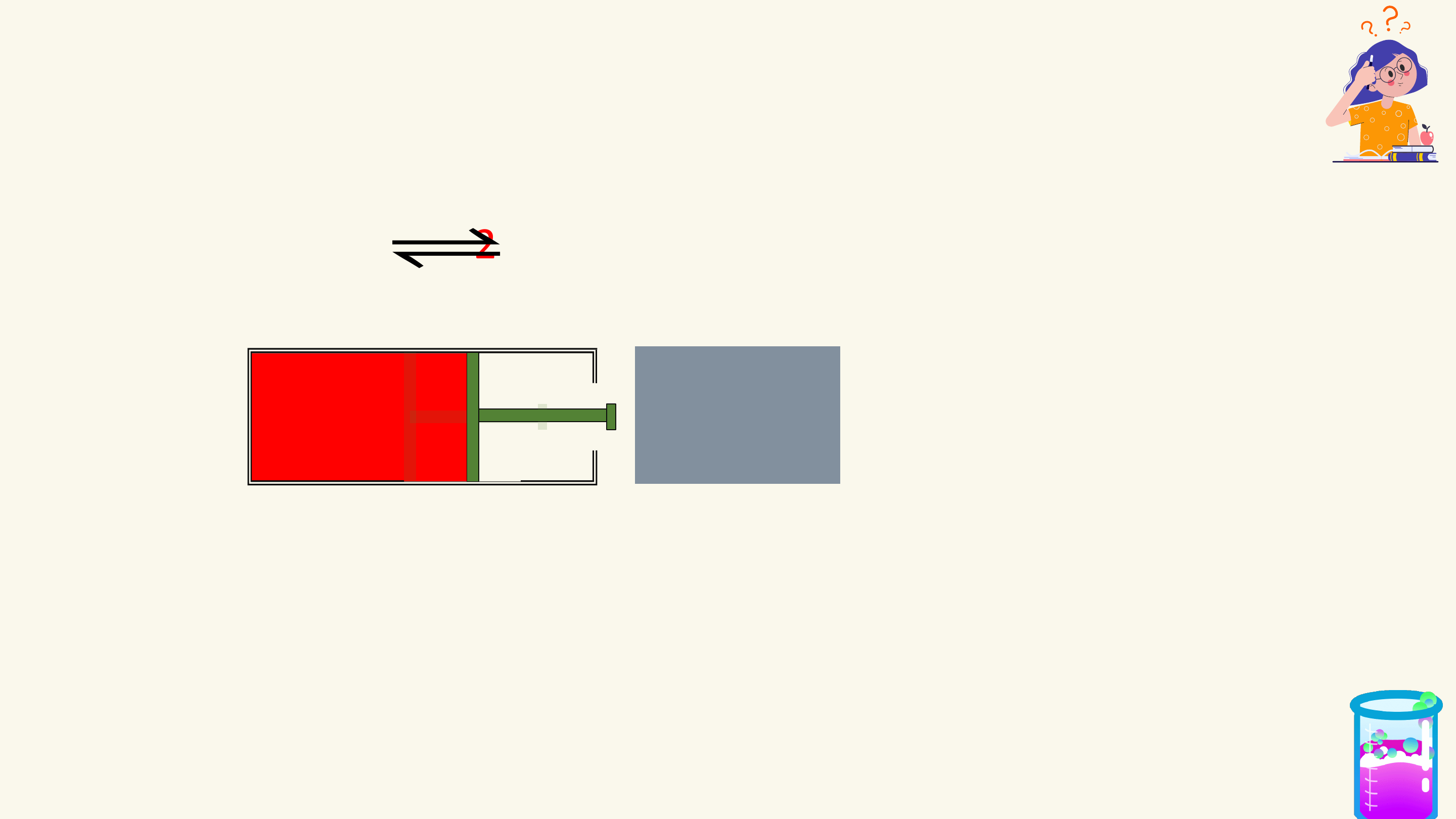
PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NỘI DUNG
NGHỊCH VÀ CÂN BẰNG HÓA HỌC
HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH
SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
I. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH
VÀ CÂN BẰNG HÓA HỌC
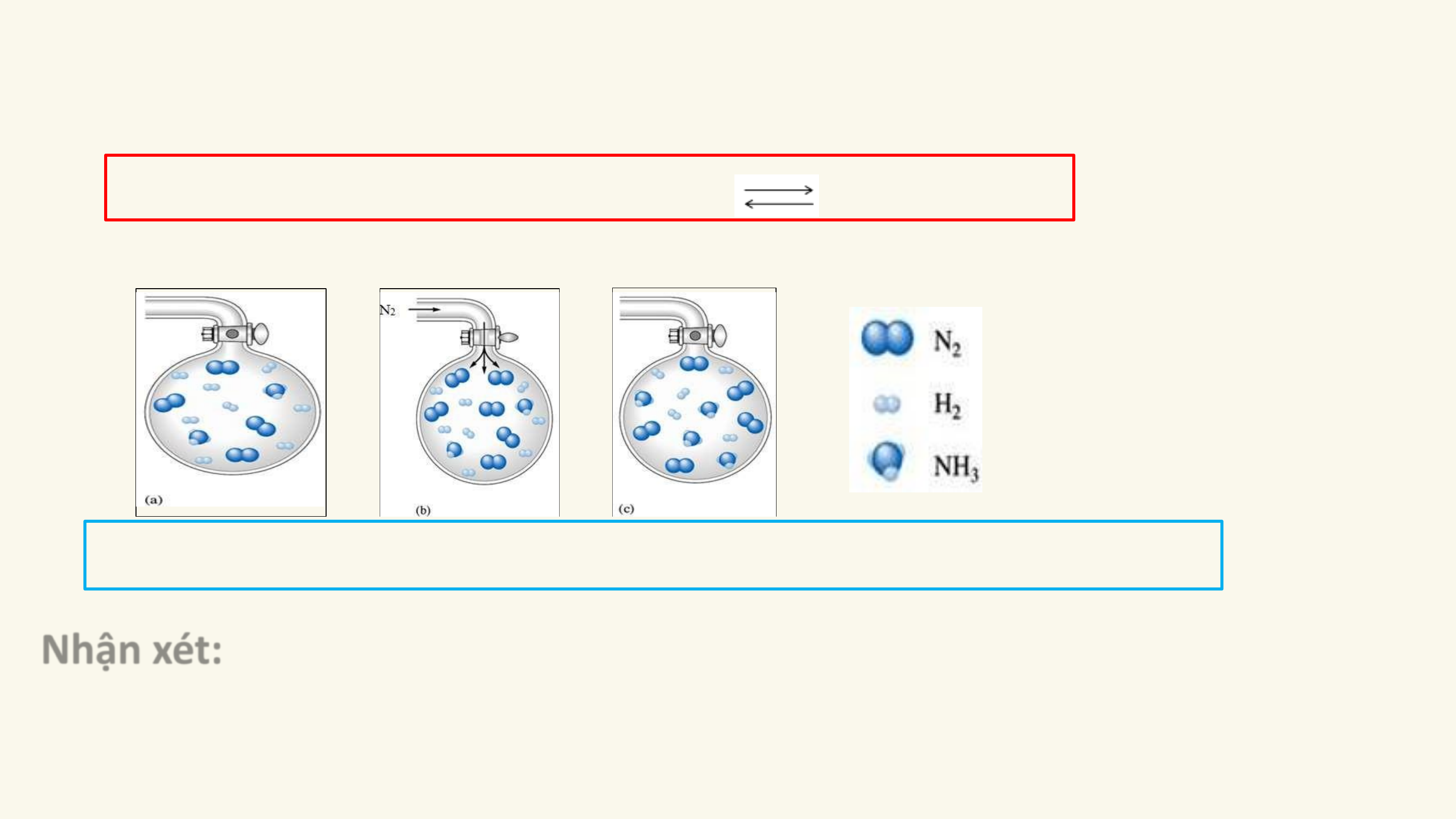
1. Phản ứng một chiều
Phản ứng một chiều là phản ứng chỉ xảy ra theo chiều từ chất tham gia
tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau để tạo thành chất ban đầu.
Kí hiệu: chỉ chiều phản ứng.
I. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH
VÀ CÂN BẰNG HÓA HỌC
1. Phản ứng một chiều
Viết một số phương trình
phản ứng một chiều khác?
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29