BÀI 6
SULFUR VÀ SULFUR DIOXIDE 1 ĐƠN CHẤT SULFUR • Trạng thái tự nhiên • Cấu tạo phân tử NỘI
• Tính chất vật lí cơ bản của đơn chất S • Cấu tạo nguyên tử • Tính chất hoá học DUNG • Ứng dụng SULFUR DIOXIDE
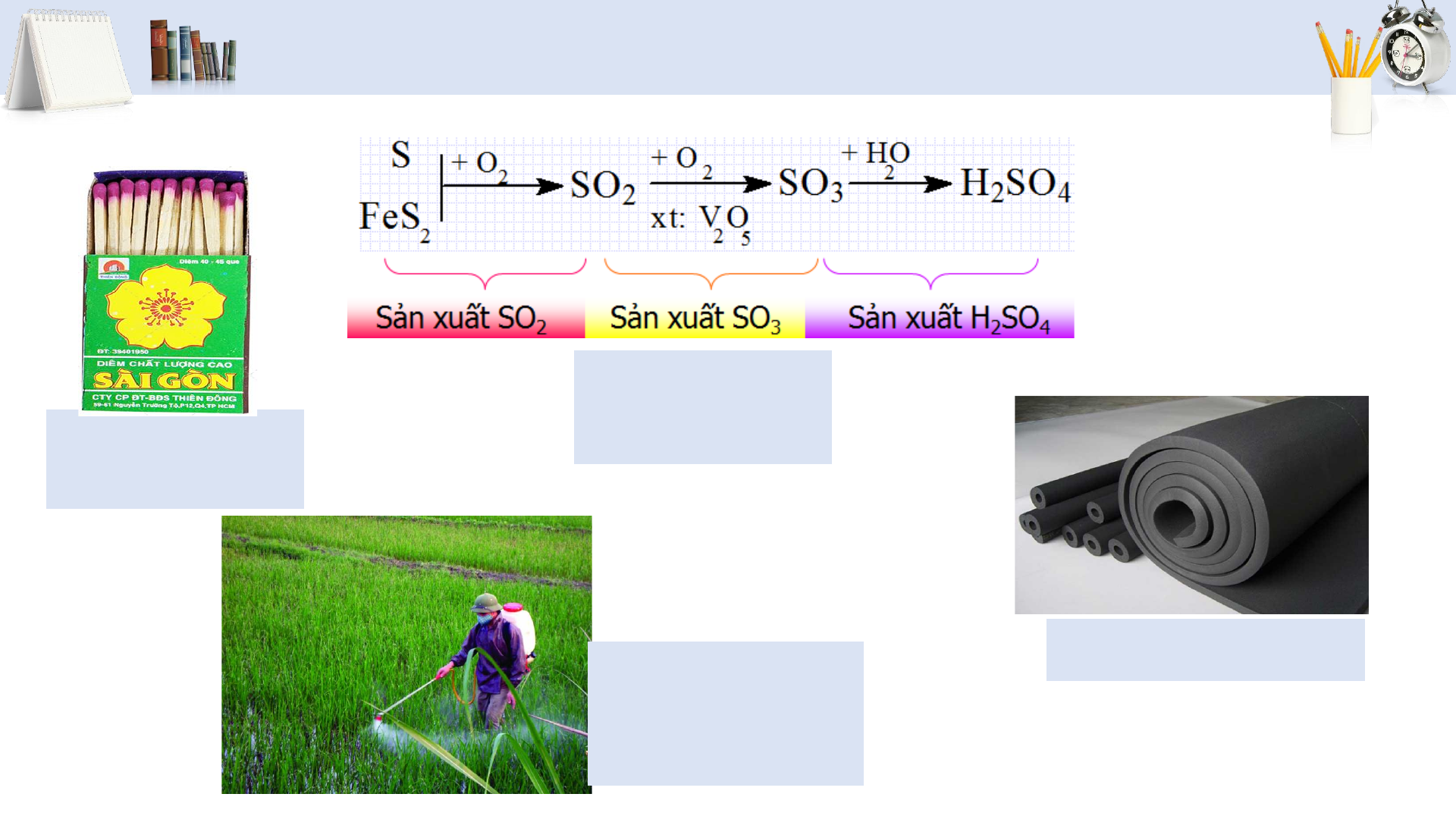
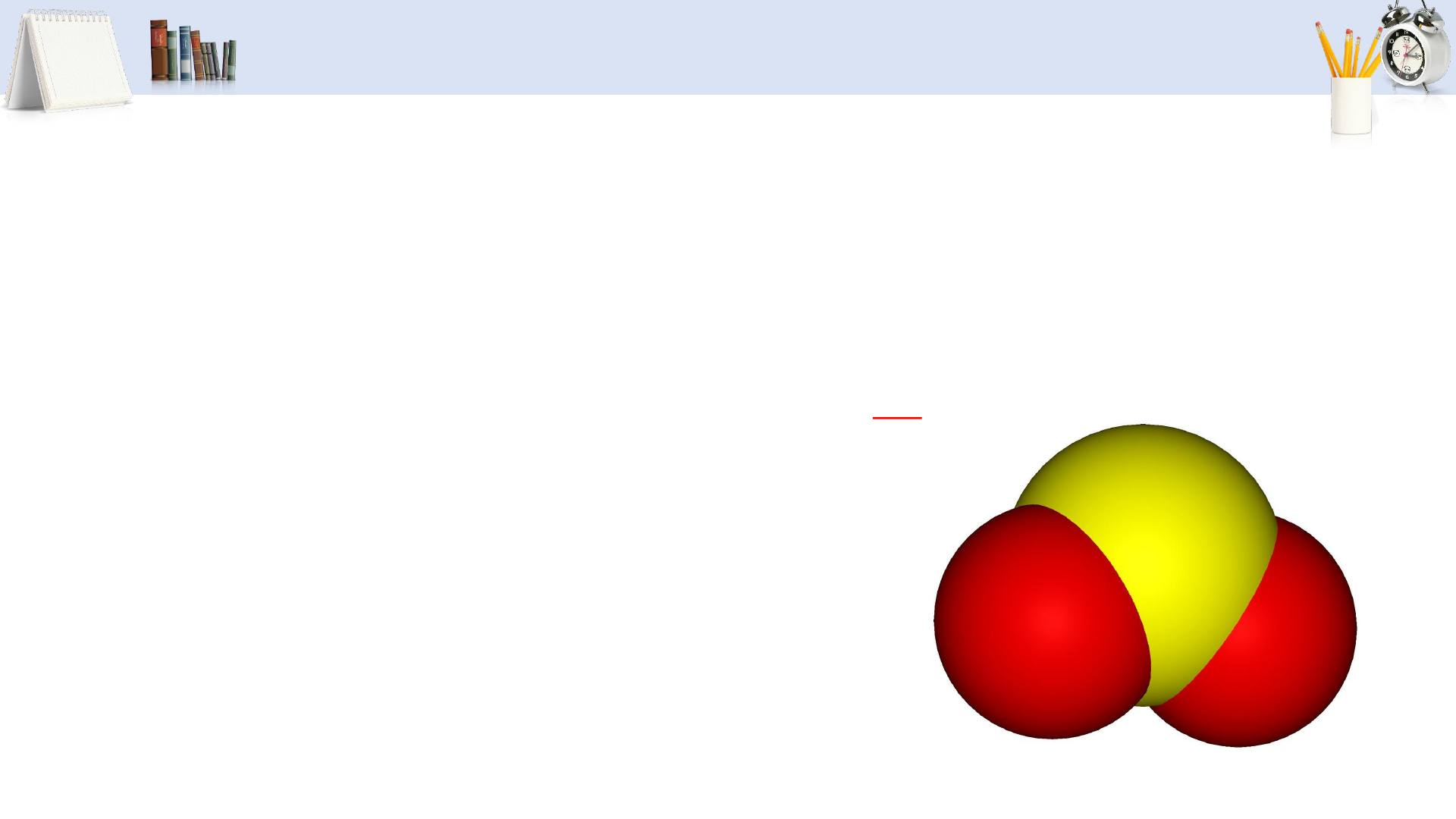
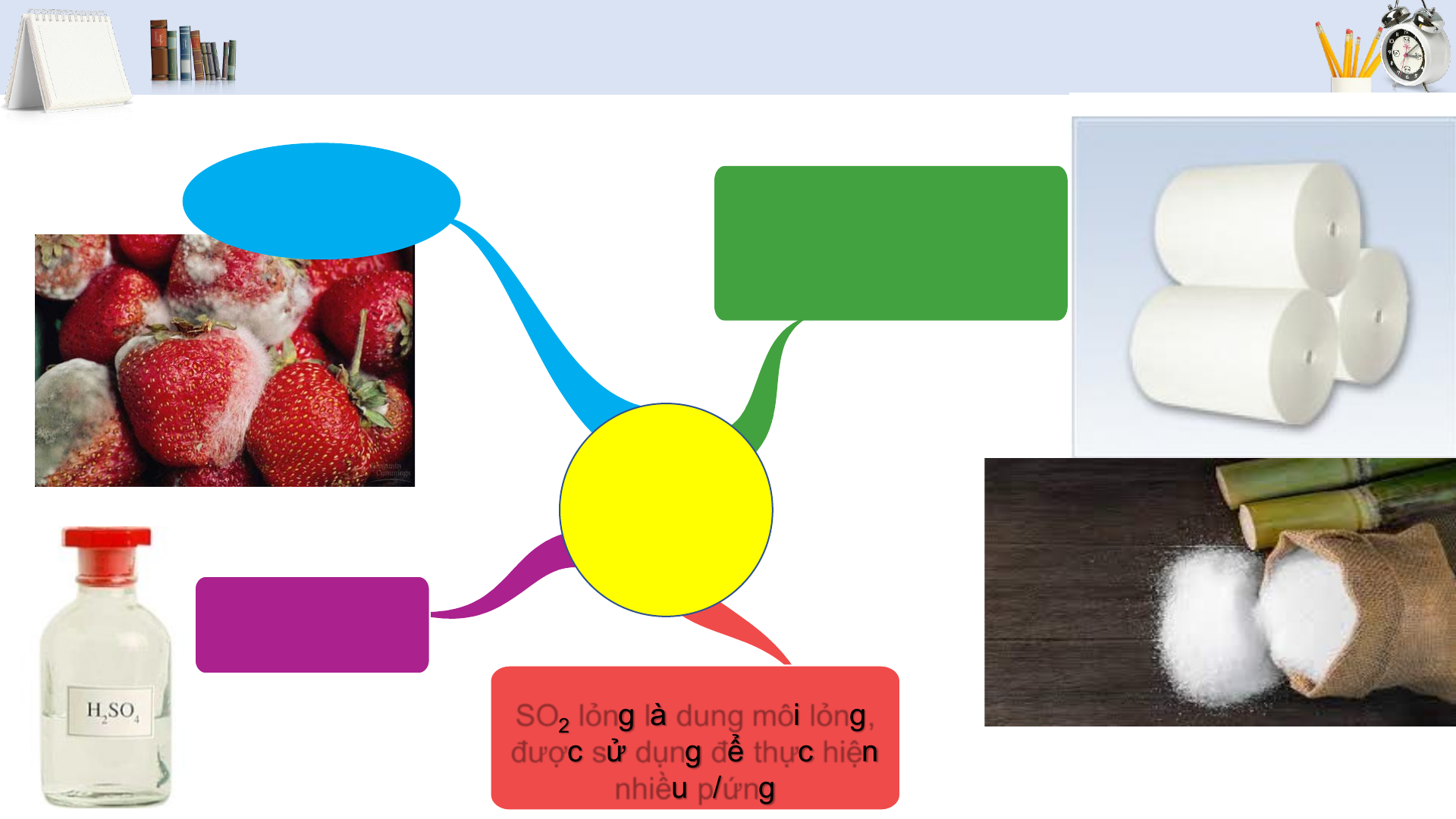
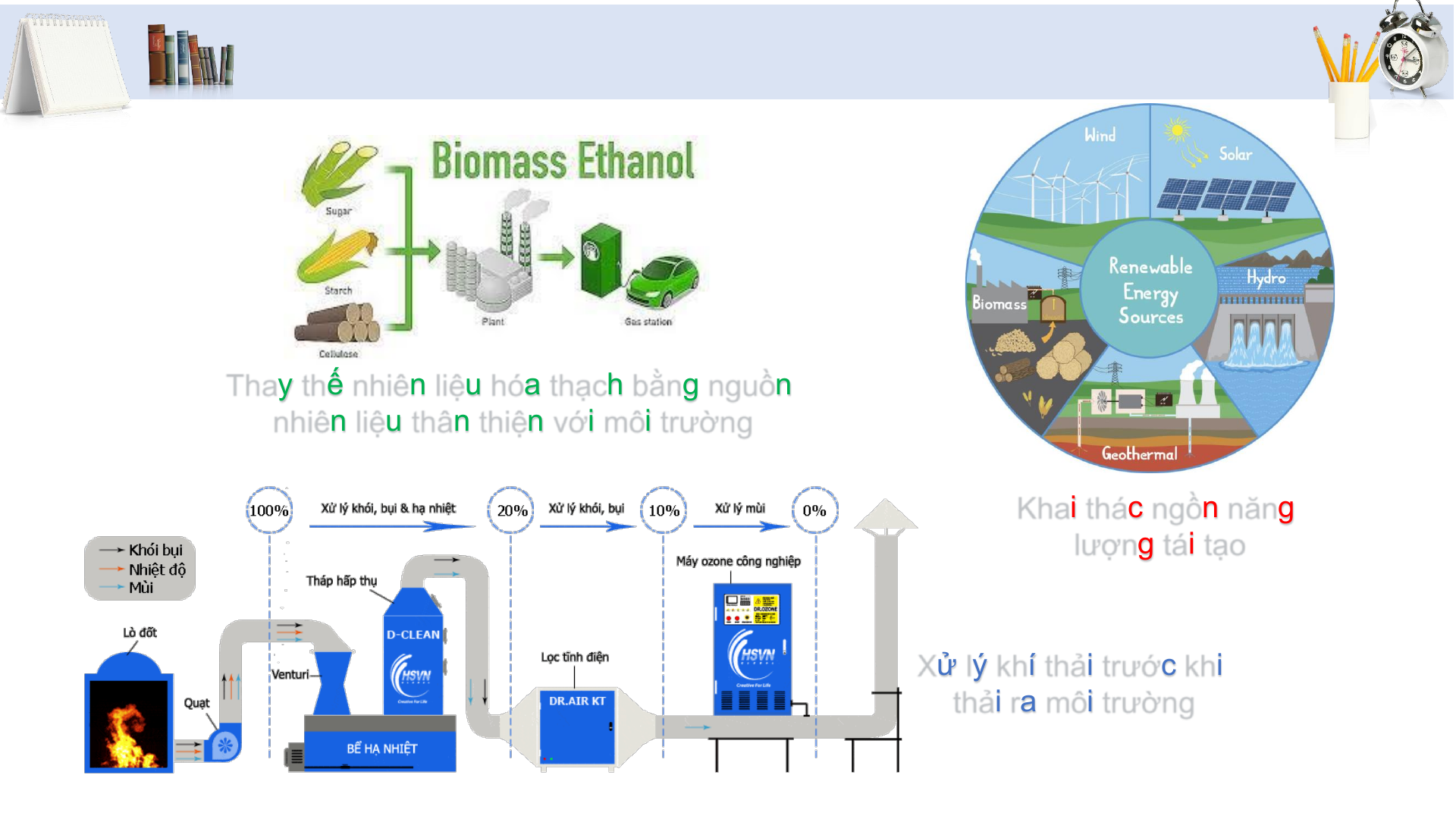
• Tính chất và ứng dụng của sulfur dioxide
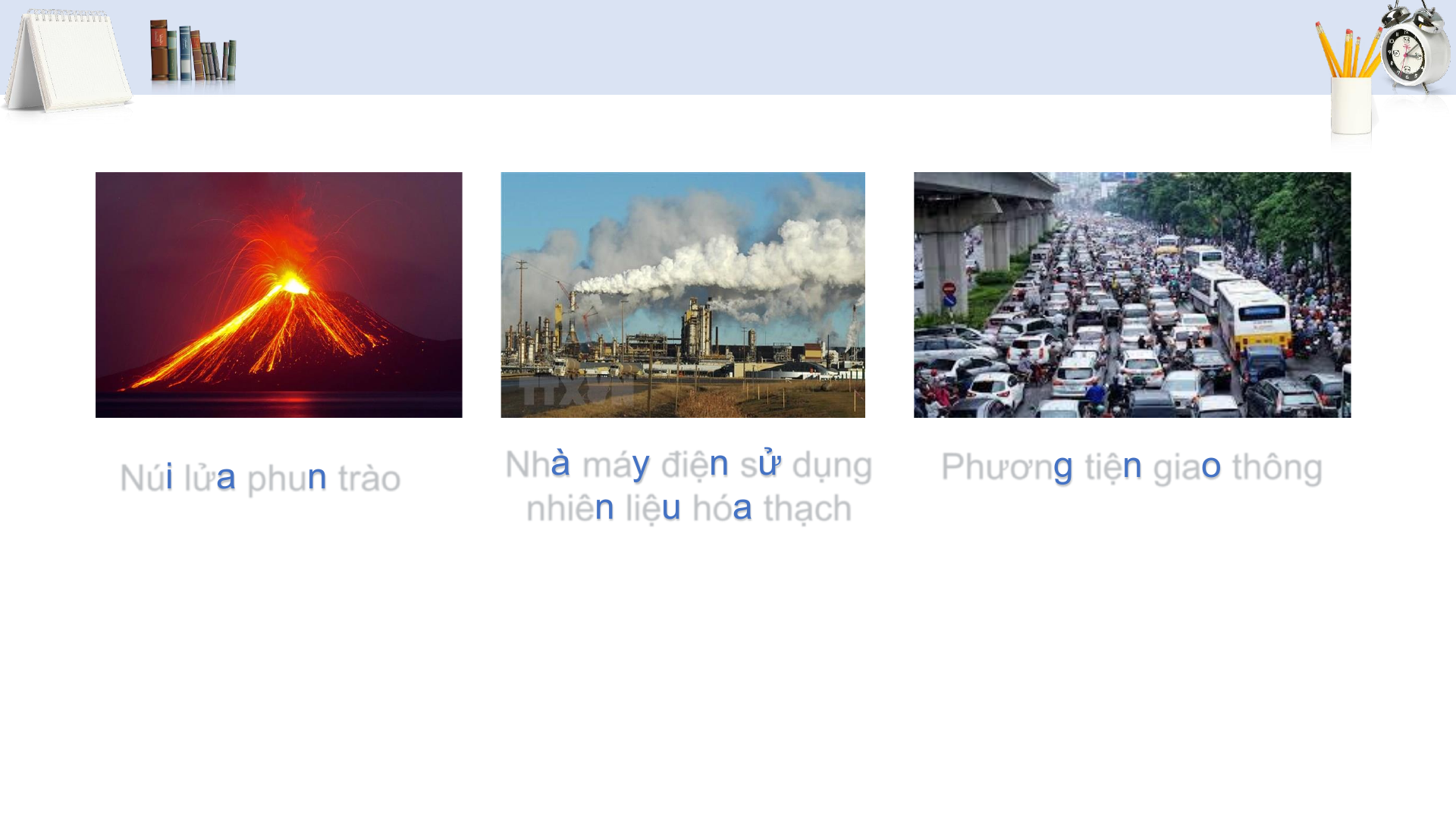
• Sự hình thành sulfur dioxide do tác động của con người, tự nhiên
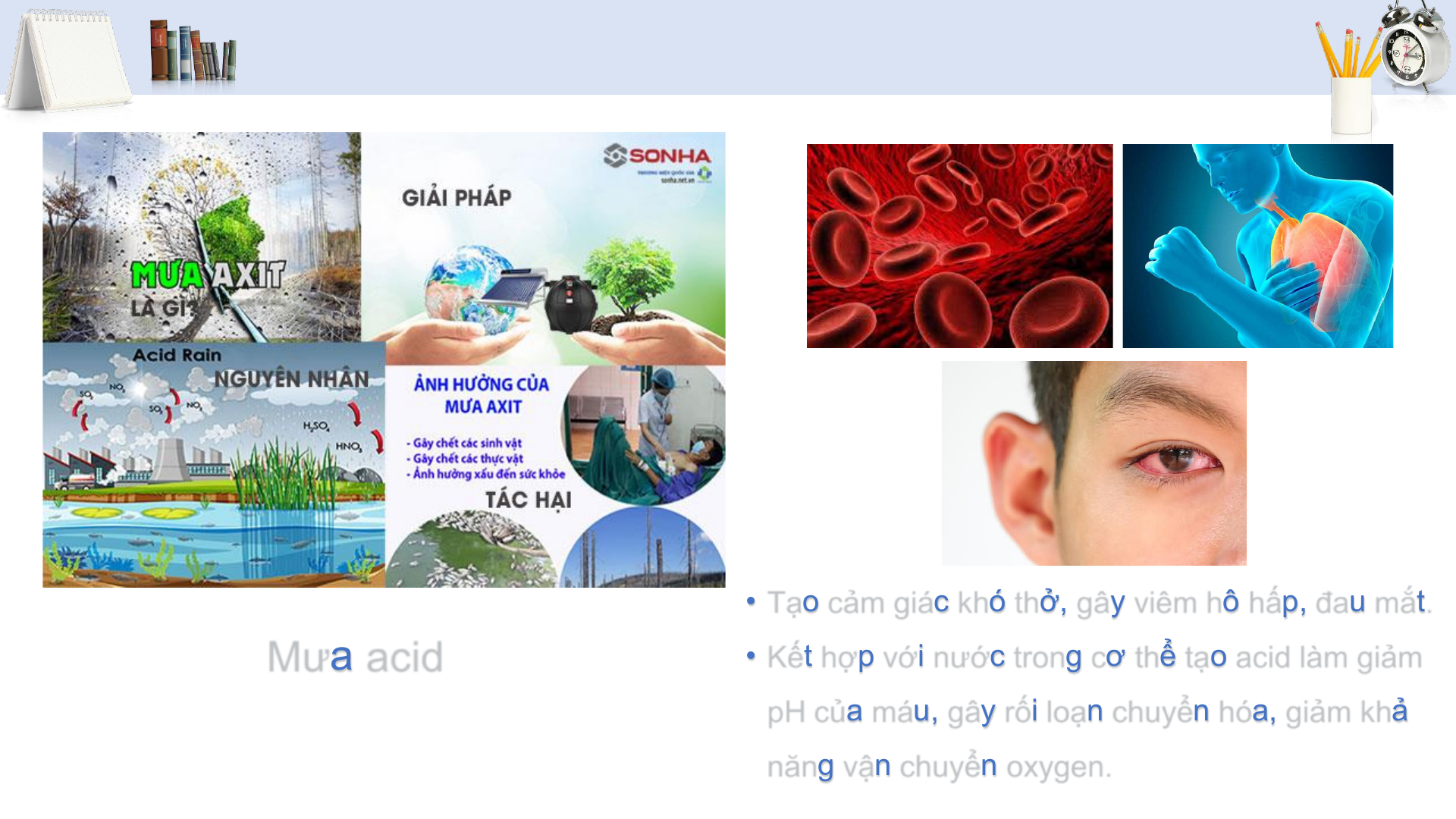
• Tác hại của sulfur dioxide và một số biện
pháp làm giảm thiểu lượng SO2 thải vào không khí A ĐƠN CHẤT SULFUR 3
I. TRẠNG THÁI TỰ NHIÊN
Em hãy cho biết lưu huỳnh có thể tồn
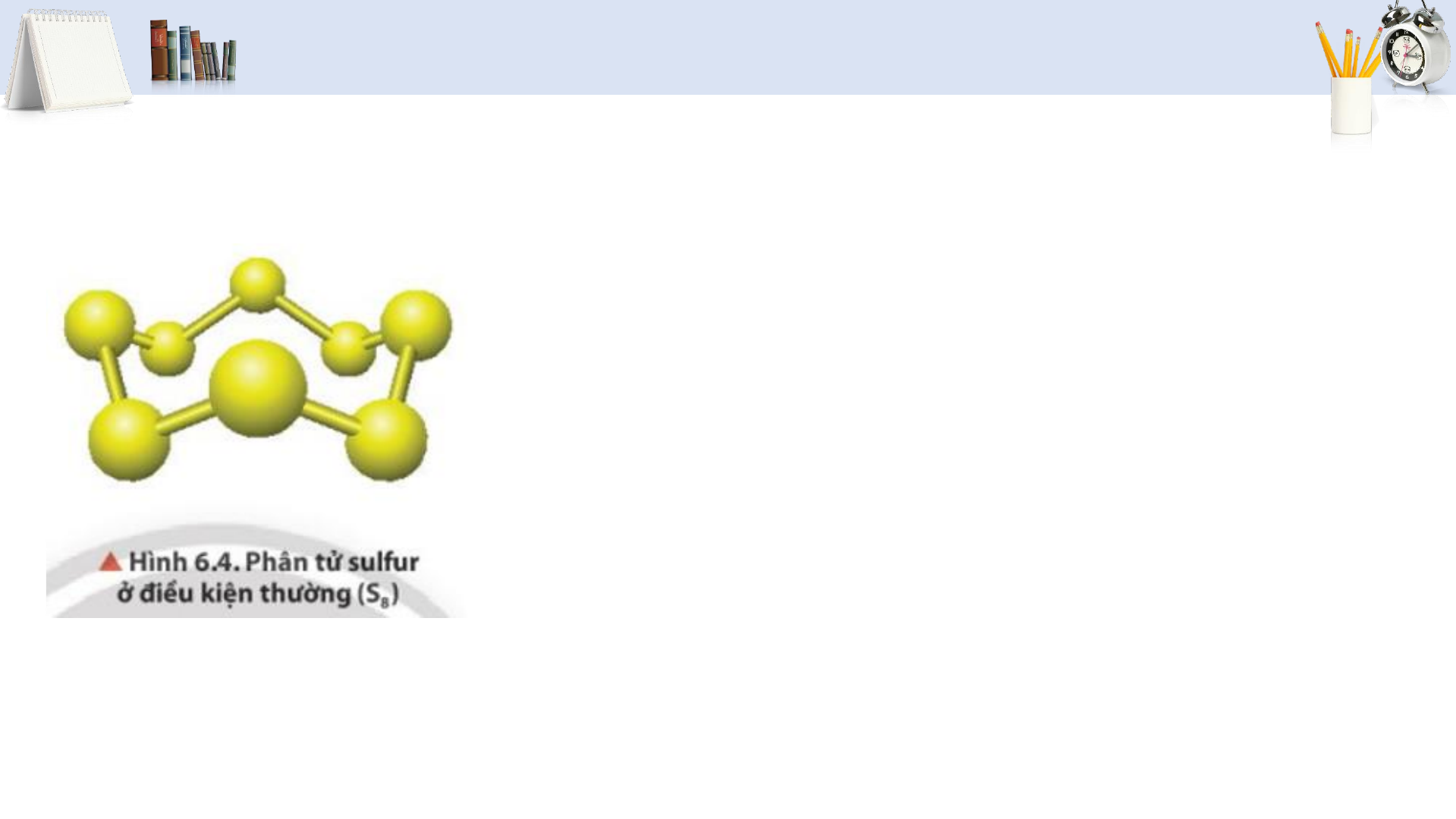
S tại những dạng chất nào trong tự nhiên?
Trong tự nhiên, sulfur lắng đọng thành những
mỏ lớn, nằm giữa lớp đá sâu hàng trăm mét trong
lòng đất. Sulfur ở dạng hợp chất cũng được tìm
thấy trong nhiều khoáng vật trong tự nhiên.
→ Đơn chất hoặc hợp chất 4
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28