THPT CHUYÊN TRẦN PHÚ
KỲ THI HỌC SINH GIỎI CÁC TRƯỜNG THPT CHUYÊN HẢI PHÒNG
KHU VỰC DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ
LẦN THỨ XIV, NĂM 2023 ĐỀ GIỚI THIỆU
ĐỀ THI MÔN: HÓA HỌC-KHỐI 11 Thời gian: 180 phút
Câu 1. (2,5 điểm) Tốc độ phản ứng
Tốc độ phản ứng thủy phân trong môi trường axit: Co(en) +
2Cl2 + H2O Co en 2 H2O Cl2+ + Cl−
được mô tả bởi phương trình động học: v = k.CCo(en) + (không phụ thuộc [H+]) 2Cl2
Hằng số tốc độ: k = 2,4.10-4 (250C) và k = 8,1.10-4 (350C) đối với phức chất dạng cis;
k = 3,5.10-4 (250C) và k = 1,5.10-4 (350C) đối với phức chất dạng trans.
1. Mô tả sự thủy phân Co en 2 H2O Cl2+ bằng cơ chế 2 giai đoạn (sử dụng các hằng số tốc độ k1, k-1, k2)
và chứng minh cơ chế đưa ra là phù hợp với thực nghiệm v = k.CCo(en) + 2Cl2
2. Vẽ các cấu trúc có thể có của tiểu phân trung gian trong cơ chế của trans-Co(en)2Cl22+.
3. Tính năng lượng hoạt hóa EA cho cis- và trans- Co(en)2Cl2+. Tính entanpi ∆H#, entropi ∆S# cho sự hình
thành phức hoạt động của cis- Co(en)2Cl22+.
(k = A.e−EA/RT = 2,08. 1010. T. e−∆G≠/RT; ∆H≠ = EA − RT , T = 298K).
Câu 2 (2,5 điểm). Cân bằng và phản ứng trong dung dịch. Pin điện – Điện phân.
1. Trong dung dịch nước, chất A bị phân hủy phương trình: A + 2H2O → 2X+ + Y2- (1)
Trong dung dịch loãng, hằng số tốc độ của phản ứng tại 350 K là k1 = 4,00.10-5 s-1.
a. Cho biết bậc của phản ứng (1).
b. Tính thời gian cần thiết, t1, để 80% lượng A bị phân hủy ở 350K.
c. Tính hằng số tốc độ của phản ứng, k2, tại 300K và thời gian cần thiết, t2, để 80% lượng A bị phân
hủy ở nhiệt độ này. Biết năng lượng hoạt hóa của phản ứng là 166,00 kJ.mol-1 và không phụ thuộc vào nhiệt độ.
d. Khi có mặt chất xúc tác, hằng số tốc độ của phản ứng phân hủy tại 300 K là k2’ = 3,00.104 s-1. Giả
sử thừa số tần số không thay đổi, tính năng lượng hoạt hóa của phản ứng khi có mặt xúc tác.
2. Một pin được cấu tạo bằng cách nối nửa pin A gồm Ni nhúng trong 100 cm3 Ni2+ chưa biết nồng độ và
nửa pin B gồm Cu nhúng trong 100 cm3 dung dịch Cu2+ 0,010 M qua một cầu muối. Hiệu điện thế đo
được của hệ là E mV. Nhiệt độ làm việc là 25oC. Thêm một ít CuCl2 vào dung dịch Cu2+ làm cho hiệu
điện thế của hệ tăng thêm (E + 9,00) mV (bỏ qua thể tích tăng thêm khi cho thêm CuCl2).
Cho M(CuCl2) = 134,45 g.mol-1. Eo(Ni2+/Ni) = - 0,257V, Eo(Cu2+/Cu) = 0,342V.
a. Lập sơ đồ pin, tính sức điện động chuẩn của pin.
b. Hãy xác định khối lượng CuCl2 thêm vào.
Câu 3. (2,5 điểm) Nhiệt động học và cân bằng hóa học
1. Đối với phản ứng đề hiđro hóa etan: C2H6 (k) ⇌ C2H4 (k) + H2 (k) (1) có các số liệu sau:
ΔG0900K = 22,39 kJ.mol-1 và các giá trị entropy được ghi ở bảng dưới đây: Chất H2 C2H6 C2H4 S0900K(J.mol-1.K-1) 163.0 319,7 291,7
a. Tính Kp của phản ứng (1) tại 900K.
b. Tính ΔH0900K của phản ứng C2H4 (k) + H2 (k) C2H6 (k)
c. Tính Kp tại 700K của phản ứng (1), giả thiết trong khoảng nhiệt độ từ 700K đến 900K thì ΔHo và ΔSo không thay đổi.
2. Khi nung CuSO4 khan trong bình kín, xảy ra hai quá trình sau: CuSO4 (s)
CuO (s) + SO3 (g) KP1 (1) 2SO3 (g)
2SO2 (g) + O2 (g) KP2 (2)
Biết rằng hai quá trình trên đều có biến thiên enthalpy dương, lượng CuSO4 sử dụng dư và thể tích của
chất rắn không đáng kể.
a. Áp suất của SO2 và O2 thay đổi thế nào nếu:
i) thêm argon vào hệ cân bằng ở nhiệt độ không đổi.
ii) tăng nhiệt độ của hệ.
b. Cho CuSO4 khan vào bình có thể tích 1 lít không đổi chứa argon ở 13,33 kPa và 0oC. Nâng nhiệt độ
lên 1050 K, khi hệ cân bằng thấy khối lượng pha rắn giảm 0,3869 gam và áp suất trong bình bằng 108,69
kPa. Tính giá trị của KP1 và KP2 tại 1050 K.
c. Biết chênh lệch biến thiên enthalpy của hai phản ứng là 0 0 H H r 1 r
2 = 27 kJ.mol-1. Tại nhiệt độ T,
khi cân bằng số mol SO2 gấp 5 lần số mol SO3. Xác định T.
Câu 4: (2,5 điểm) Hóa nguyên tố
1. Hoàn thành sơ đồ phản ứng và viết các phương trình phản ứng xảy ra:
2. Cho các giá trị nhiệt độ sôi của các hydride sau: Chất HF HCl HBr HI H2O H2S Nhiệt độ sôi (0C) + 19,5 -84,9 -66,8 -35,4 +100 - 60,75
(a) Giải thích sự biến đổi nhiệt độ sôi của các dãy sau: (i) HF, HCl, HBr, HI. (ii) H2O, H2S.
(b) Trên thực tế, liên kết H-F phân cực hơn liên kết O-H, nhưng tại sao nhiệt độ sôi của HF lại thấp hơn nhiệt độ sôi của H2O.
(c) Hãy sắp xếp theo chiều tăng dần tính Acid của các hydride đó. Giải thích.
Câu 5. (2,5 điểm) Đại cương hữu cơ 1.a. Cho các chất sau:
Với các giá trị nhiệt độ sôi không theo thứ tự: 1150C, 1170C, 1870C, 2560C.
Xếp giá trị nhiệt độ sôi trên vào các chất tương ứng. Giải thích.
b. Viết cấu trúc các dạng enol của dietyl malonat, etylaxeto axetat.
Sắp xếp theo thứ tự tăng dần độ bền các cấu trúc của etylaxeto axetat. Giải thích.
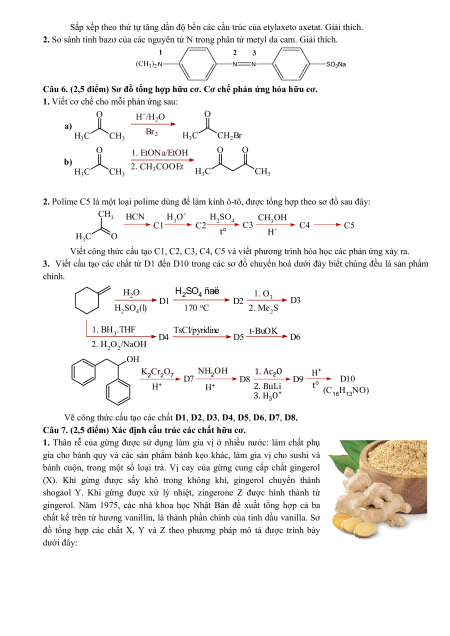
2. So sánh tính bazơ của các nguyên tử N trong phân tử metyl da cam. Giải thích.
Câu 6. (2,5 điểm) Sơ đồ tổng hợp hữu cơ. Cơ chế phản ứng hóa hữu cơ.
1. Viết cơ chế cho mỗi phản ứng sau: O H+/H O a) 2O H Br2 3C CH3 H3C CH2Br O 1. EtONa/EtOH O O b) H 2. CH3COOEt 3C CH3 H3C CH3
2. Polime C5 là một loại polime dùng để làm kính ô-tô, được tổng hợp theo sơ đồ sau đây: CH3 HCN H O+ H SO CH OH C1 3 C2 2 4 C3 3 C4 C5 to H+ H3C O
Viết công thức cấu tạo C1, C2, C3, C4, C5 và viết phương trình hóa học các phản ứng xảy ra.
3. Viết cấu tạo các chất từ D1 đến D10 trong các sơ đồ chuyển hoá dưới đây biết chúng đều là sản phẩm chính. H O H 2 2SO4 ñaë c 1. O D1 D2 3 D3 H2SO4(l) 170 oC 2. Me2S 1. BH3.THF TsCl/pyridine t-BuOK D4 D5 D6 2. H2O2/NaOH OH K Cr O NH OH 2 2 7 2 1. Ac D7 D8 2O D9 H+ D10 H+ H+ 2. BuLi to (C H NO) 3. H 16 13 3O+
Vẽ công thức cấu tạo các chất D1, D2, D3, D4, D5, D6, D7, D8.
Câu 7. (2,5 điểm) Xác định cấu trúc các chất hữu cơ.
1. Thân rễ của gừng được sử dụng làm gia vị ở nhiều nước: làm chất phụ
gia cho bánh quy và các sản phẩm bánh kẹo khác, làm gia vị cho sushi và
bánh cuộn, trong một số loại trà. Vị cay của gừng cung cấp chất gingerol
(X). Khi gừng được sấy khô trong không khí, gingerol chuyển thành
shogaol Y. Khi gừng được xử lý nhiệt, zingerone Z được hình thành từ
gingerol. Năm 1975, các nhà khoa học Nhật Bản đề xuất tổng hợp cả ba
chất kể trên từ hương vanillin, là thành phần chính của tinh dầu vanilla. Sơ
đồ tổng hợp các chất X, Y và Z theo phương pháp mô tả được trình bày dưới đây:
Xác định cấu trúc của A, X, Y và Z.
2. Hợp chất A là một D-aldopentose. Khi phản ứng A với NaBH4, tạo thành thành alditol thể hiện ba tín
hiệu trong phổ 13C NMR. Hợp chất A trải qua quá trình tổng hợp Kiliani – Fischer để tạo ra hai
aldohexoses B và C. Khi xử lý với nitric acid, hợp chất B tạo ra hợp chất D, trong khi hợp chất C tạo ra
hợp chất E. Cả D và E đều là aldaric acid hoạt động về mặt quang học.
a. Vẽ cấu trúc của hợp chất A.
b. Vẽ cấu trúc của hợp chất D và E và mô tả cách bạn có thể phân biệt giữa hai hợp chất này bằng cách sử dụng quang phổ 13C NMR.
Câu 8. (2,5 điểm) Hóa học các hợp chất thiên nhiên
1. Nguyên liệu đầu để tổng hợp thương mại vitamin C là L-sorbose. Nó có thể được
tổng hợp từ D-glucose qua chuỗi phản ứng dưới đây. Giai đoạn thứ hai của chuỗi
phản ứng này minh họa việc sử dụng quá trình oxid hóa xúc tác bởi vi khuẩn; vi sinh
vật A. suboxydans hoàn thành giai đoạn này với hiệu suất 90%. Kết quả tổng thể của
quy trình tổng hợp là chuyển hóa của một D-aldohexose (D-glucose) thành một
Lketohexose (L-sorbose). Điều này có ý nghĩa gì về tính đặc hiệu của quá trình oxid hóa vi khuẩn? L-Sorbose � �
� − ������� �, �� � − �������� �, �.���������� � − �������
2. Một trong những phương án tổng hợp Vitamin C từ glucose được tiến hành theo sơ đồ:
a. Chỉ rõ các nguyên tử C bất đối (C*) trong vitamin C.
b. Giải thích tính acid của vitamin C.
c. Xác định cấu trúc các chất (A), (B), (C), (D), (E), (F) trong sơ đồ trên.
Đề thi HSG Hóa học 11 Trường THPT Chuyên Trần Phú - Hải Phòng
752
376 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(752 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)