Trường THCS ………….
Họ và tên giáo viên
Tổ: ………………………
BÀI 4: SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC Tuần: Tiết: Ngày soạn:
Thời gian thực hiện: 7 tiết I. MỤC TIÊU 1. Kiến thức
- Nêu được nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học.
- Mô tả được cấu tạo của bảng tuần hoàn gồm: ô, chu kì, nhóm.
- Xác định được vị trí của các nhóm nguyên tố kim loại, phi kim, khí hiếm trong bảng
tuần hoàn các nguyên tố hóa học. 2. Năng lực
2.1. Năng lực chung
- Năng lực tự chủ và tự học: tìm kiếm thông tin, đọc sách giáo khoa, quan sát tranh
ảnh để tìm hiểu về cấu tạo bảng tuần hoàn.
- Năng lực giao tiếp và hợp tác: thảo luận nhóm để tìm ra vị trí của các nhóm nguyên tố
kim loại, phi kim, khí hiếm trong bảng tuần hoàn các nguyên tố hóa học.
- Năng lực giải quyết vấn đề và sáng tạo: giải quyết vấn đề trong thực hiện nhiệm vụ.
2.2. Năng lực khoa học tự nhiên
- Năng lực tìm hiểu tự nhiên: nêu được cấu tạo chung của bảng tuần hoàn.
- Năng lực sử dụng ngôn ngữ hóa học: đọc được tên các nguyên tố trong bảng tuần
hoàn các nguyên tố hoá học.
- Vận dụng kiến thức, kỹ năng đã học: trình bày được cấu tạo, vị trí của các nguyên tố
trong bảng tuần hoàn. Từ vị trí nguyên tố trong bảng tuần hoàn (ô, nhóm, chu kì) suy
ra cấu trúc nguyên tử của nguyên tố và ngược lại. 3. Phẩm chất
- Chăm học, chịu khó tìm tòi tài liệu và thực hiện các nhiệm vụ cá nhân nhằm tìm
hiểu về bảng tuần hoàn.
- Có trách nhiệm trong hoạt động nhóm, chủ động nhận và thực hiện nhiệm vụ có hiệu quả.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU 1. Giáo viên
- Bảng tuần hoàn các nguyên tố hóa học.
- Thẻ các nguyên tố (18 nguyên tố đầu trong BTH).
- Mô hình cấu tạo nguyên tử của các nguyên tố. - Phiếu học tập. 2. Học sinh
- Ôn tập bài cũ và chuẩn bị bài mới.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu: Tạo hứng thú cho HS, thu hút HS sẵn sàng thực hiện nhiệm vụ học tập
của mình. HS xác định được mục tiêu bài học.
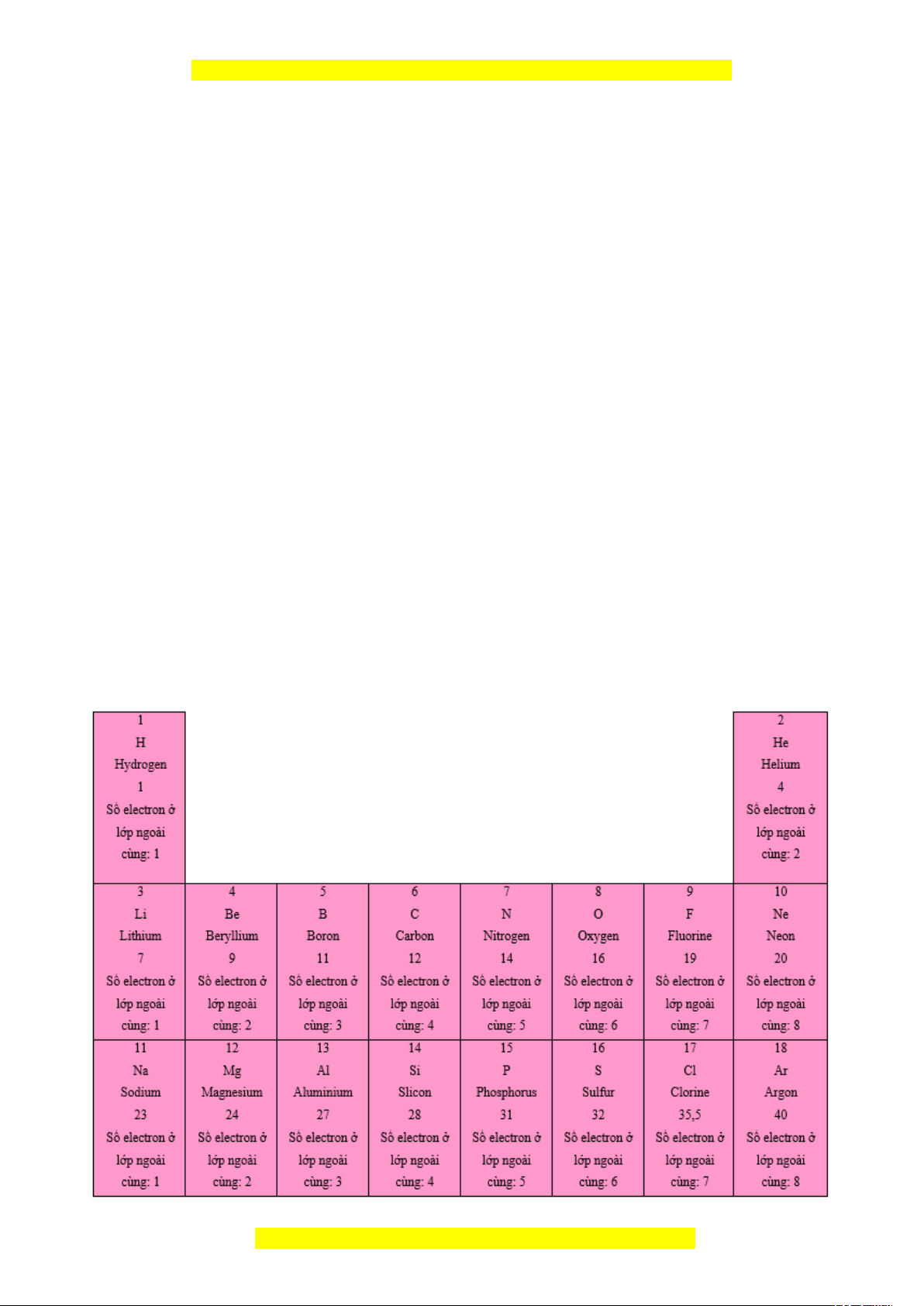
b) Nội dung: GV chuẩn bị 18 tấm thẻ ghi thông tin của 18 nguyên tố đầu tiên theo
mẫu như hình 4.1 – SGK trang 23. Yêu cầu HS thảo luận nhóm thực hiện gắn thẻ vào
bảng mẫu, từ đó hình thành vấn đề cần tìm hiểu.
c) Sản phẩm: Sản phẩm của học sinh.
d) Tổ chức thực hiện
* Giao nhiệm vụ học tập
- GV yêu cầu HS hoạt động nhóm thảo luận thống nhất sắp xếp 18 tấm thẻ vào các ô
trong bảng theo quy luật nhất định. - HS nhận nhiệm vụ.
* Thực hiện nhiệm vụ
- Các nhóm thảo luận và thực hiện gắn thẻ theo yêu cầu của giáo viên.
- GV quan sát các nhóm hoạt động, hỗ trợ các cá nhân hoặc nhóm gặp khó khăn.
* Báo cáo, thảo luận
- GV yêu cầu đại diện nhóm trình bày.
- HS các nhóm quan sát, lắng nghe, nhận xét.
* Kết luận, nhận định
- Giáo viên nhận xét đánh giá mức độ hoàn thành, thái độ học tập và kĩ năng hoạt
động nhóm của HS. Từ đó giới thiệu: Vừa rồi chúng ta đã sắp xếp các nguyên tố vào
1 bảng, đây chính là 1 phần của bảng tuần hoàn các nguyên tố hoá học hiện nay.
- GV cho HS quan sát hình, giới thiệu về lịch sử ra đời bảng tuần hoàn:
Bảng tuần hoàn các nguyên tố hóa học của Mendeleev.
D.I. Mendeleev là một nhà hóa học người Nga, ông là người đầu tiên tìm ra quy luật
cũng như phân loại các nguyên tố hóa học. Vào ngày 6 tháng 3 năm 1869, Mendeleev
đã lập ra bảng tuần hoàn của các nguyên tố hóa học, phân loại các dạng nguyên tố
thành từng nhóm cũng như sắp xếp chúng theo một quy trình tuần hoàn. Trong phiên
bản chỉnh sửa lần cuối vào năm 1871, Mendeleev có để sẵn nhưng ô trống trong bảng
tuần hoàn của mình và dự đoán đó là những nguyên tố sẽ được tìm thấy trong tương lai.
GV đặt vấn đề: Vậy để tìm hiểu chi tiết về bảng tuần hoàn, cô sẽ cùng các em tìm
hiểu trong bài học hôm nay: Bài 4 – Sơ lược về bảng tuần hoàn các nguyên tố hoá học.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu nguyên tắc sắp xếp các nguyên tố hoá học trong bảng tuần hoàn a) Mục tiêu
- Nêu được nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học. b) Nội dung
-GV treo kết quả sắp xếp của HS phần khởi động lên bảng, yêu cầu HS quan sát, thảo
luận cặp đôi, trả lời câu hỏi phiếu học tập số 1, từ đó lĩnh hội kiến thức.
PHIẾU HỌC TẬP SỐ 1
Câu 1: Nhận xét về các đặc điểm của bảng sau khi đã sắp xếp:
a. Sự thay đổi số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một
hàng khi đi từ trái sang phải.
b. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột.
Câu 2: Dựa vào đặc điểm nào về cấu tạo nguyên tử để sắp xếp các nguyên tố vào
hàng, vào cột trong bảng tuần hoàn?
Câu 3: Sử dụng bảng tuần hoàn, hãy cho biết các nguyên tố nào trong số các nguyên
tố Li, Na, C, O có cùng số lớp electron trong nguyên tử.
c) Sản phẩm: Câu trả lời của học sinh:
TRẢ LỜI PHIẾU HỌC TẬP SỐ 1 Câu 1:
a. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một hàng khi đi từ
trái sang phải tăng dần từ 1 đến 8.
Giáo án Hóa học 7 Kết nối tri thức Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
1.1 K
556 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa học 7 Kết nối tri thức được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa học 7 Kết nối tri thức năm 2023 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình sách giáo khoa Hóa học 7 Kết nối tri thức.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1111 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN KHTN
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 7
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Trường THCS ………….
Tổ: ………………………
Họ và tên giáo viên
BÀI 4: SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
I. MỤC TIÊU
1. Kiến thức
!"#$#%&
'(")*!"+,(-./-0,&
1#23245*#0,$.,6-7.,-.5,4!"
#$0%&
2. Năng lực
2.1. Năng lực chung
86*3%/,.,(-%##.-9#4
":/,:3;)!"&
86737#"6<0,:/,43245*#0,$
.,6-7.,-.5,4!"#$0%&
86"93);3#"93);4,3=&
2.2. Năng lực khoa học tự nhiên
86/,:)*!"&
86> =(?0%%#$4!"
#$#%&
@< =.A-.B8C%4/!)-3245*#$
4!"&D3245$4!"E(-0,-./F
4)4G>*$36&
3. Phẩm chất
H8,%-2.0/,I63#,3=#J,/,
:3;!"&
H04#,4K0,-*K<3,3=0
9"&
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
L"#$0%&
M#$ENO$4LPF&
'(/)>*#$&
Q%<7&
2. Học sinh
R<7!S3T!2!,U&
III.TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu:AGPV-GPVW,3=%<7
*,/&PV#2,=!%&
b) Nội dung:X@T!2NO),M(*NO$Y
,Z/[&N\VX]4^_&`PV"6<0,M3
!",Z-D0/3);/,:&
c) Sản phẩmV"7T,*%&
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
d) Tổ chức thực hiện
* Giao nhiệm vụ học tập
X@PVK0,"6<$)77NO),M3#(
4!"Y96<)2&
PV<,3=&
* Thực hiện nhiệm vụ
H#0,"6<3MY*#3&
X@9##0,K-a4##b0,b7.0.8&
* Báo cáo, thảo luận
X@ 0,4/!&
PV#0,9#-6Y-<c&
* Kết luận, nhận định
X#3<c##,AK-#K%<73.d8
K0,*PV&D0U@D4+GC77#$3
N!"-56N7*!"#$#%&
X@PV9#/-U3;62>4!"
L"#$0%*'Y Y6YY3&
D.I. Mendeleeve6,K0%-(6/,496<
S76#$0%&@f#_8,NOfg-'Y Y6YY3
C6<74!"*#$0%-76# $
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
D0,S77GY,K94/&47
!"h>6$38,NON-'Y Y6YY30:W(4$4!"
*,/3 #06?$i/,)4j
6&
X@b3);@<:/,:3;!"-(ik#Y,/,
:4!%(,L[\Vj63;!"#$#
%&
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu nguyên tắc sắp xếp các nguyên tố hoá học trong bảng
tuần hoàn
a) Mục tiêu
- !"#$#%&
b) Nội dung
-X@4Y.9"77*PV7.lK6!"- PV9#-"
6<b7(-4"6m7%<7$N-D06dK.A&
PHIẾU HỌC TẬP SỐ 1
Câu 1:<c3;#b:,*!".C77
&Vn$Y6Y4l6U7k*>#$4,K
.D4#7"&
!&V$Y6Y4l6U7k*>#$4k,KK&
Câu 2: o3b:,3;)>:77#$3
-3K4!"p
Câu 3: V> =!"-C!#$4$#
$q--H-r0k$6U7Y6Y44>&
c) Sản phẩm: H4"6*%
TRẢ LỜI PHIẾU HỌC TẬP SỐ 1
Câu 1:
&V$Y6Y4l6U7k*>#$4,K.D
4#7"8 DNO&
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
!& V$Y6Y4l6U7k*>#$4k,KK!J
&
Câu 2:
o3#b:,3;5-$6U7Y6Y4-$Y6Y46U7
k*>#$:77G3-K4!"
&
Câu 3:
$6,EqF-4!EHF-YErF;k0^6U7Y6Y44
> Kk,KA4!"&
d) Tổ chức thực hiện
HOẠT ĐỘNG CỦA GV & HS NỘI DUNG
* Chuyển giao nhiệm vụ
X@%"6<Yb7
(-7%<7$N&
PV<,3=&
* Thực hiện nhiệm vụ
- PV"6<37%
<7&
X@($3a4PV.&
* Báo cáo kết quả và thảo luận
X@%Z,KPV
,K0, 4/ !- # 0, .#!n
E0F&
s PV 4/ !- PV .# 6
Y-7"!&
* Đánh giá kết quả thực hiện nhiệm vụ
P%<c-!n&
X#3<c-##&
X@ < c 3 T # K
I. Nguyên tắc sắp xếp các nguyên tố
trong bảng tuần hoàn
-!"#
$0%+,NNO$0%-
Y
tH#$0%77
Y;8 *5
&
tH#$4S,K0
k$6U7Y6Y44>&
tH#$4k,KK0
5)$&
Mọi thắc mắc xin vui lòng liên hệ hotline: 084 283 45 85