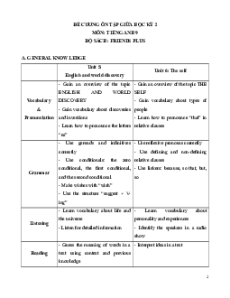
MỤC LỤC
PHẦN A. CHƯƠNG TRÌNH LỚP 8 ......................................................................... 2
Chương I : CHẤT – NGUYÊN TỬ - PHÂN TỬ ................................................... 2
Chương II : PHẢN ỨNG HÓA HỌC ...................................................................12
Chương III : MOL VÀ TÍNH TOÁN HÓA HỌC ................................................17
Chương IV : OXI – KHÔNG KHÍ .......................................................................26
Chương V : HIDRO. NƯỚC ................................................................................31
Chương VI : DUNG DỊCH ...................................................................................37
PHẦN B. CHƯƠNG TRÌNH LỚP 9 .......................................................................44
Chương I : CÁC LOẠI HỢP CHẤT VÔ CƠ .......................................................44
Chương II : KIM LOẠI ........................................................................................56
Chương III : PHI KIM. SƠ LƯỢC VỀ BẢNG TUẦN HOÀN. CÁC NGUYÊN
TỐ HÓA HỌC ......................................................................................................63
Chương IV: HIDROCACBON. NHIÊN LIỆU ....................................................74
Chương V: DẪN XUẤT CỦA HIDROCACBON. POLIME ..............................81
PHẦN A. CHƯƠNG TRÌNH LỚP 8
Chương I : CHẤT – NGUYÊN TỬ - PHÂN TỬ I. CHẤT 1. Vật thể và chất a) Vật thể:
Là những vật cụ thể mà ta có thể quan sát, cảm nhận được bằng giác quan. Vật
thể tự nhiên và vật thể nhân tạo. b) Chất:
- Ở đâu có vật thể thì ở đó có chất. Mỗi chất đều có tính chất nhất định.
- Có những chất có sẵn trong tự nhiên. Nhiều chất do con người điều chế
được. Từ chất này có thể chuyển đổi thành chất khác. 2. Tính chất của chất
- Mỗi chất (tinh khiết) đều có tính chất vật lí, hóa học nhất định.
- Khi trộn lẫn nhiều chất vào nhau, thu được hỗn hợp. Hỗn hợp không có tính
chất nhất định, thay đổi và phụ thuộc vào bản chất và tỉ lệ trộn giữa các chất.
- Hỗn hợp có sự bảo toàn về khối lượng nhưng có thể không bảo toàn thể tích.
- Dựa vào tính chất của chất có thể tách riêng từng chất ra khỏi hỗn hợp. Các
phương pháp hay sử dụng: chiết, lọc, chưng cất và bay hơi. II. NGUYÊN TỬ
1. Nguyên tử: là hạt vô cùng nhỏ (vi mô), trung hòa điện.
Nguyên tử gồm có hạt nhân mang điện tích dương và lớp vỏ mang điện tích âm. 2. Cấu tạo nguyên tử
- Lớp vỏ: được cấu tạo bởi một hay nhiều electron mang điện tích âm, chuyển
động xung quanh hạt nhân và sắp xếp thành từng lớp.
Khối lượng của hạt electron: 9,1.10-28 gam.
- Hạt nhân: được cấu tạo bời proton (p) và notron (n).
▪ Mỗi hạt proton mang một điện tích dương, các nguyên tử cùng loại có
cùng số proton trong hạt nhân. Khối lượng của hạt proton: 1,67.10-24 gam.
▪ Điện tích của proton có trị số bằng điện tích của electron nhưng ngược
dấu và notron không mang điện.
▪ Khối lượng của hạt nhân được coi là khối lượng của nguyên tử.
- Trong mỗi nguyên tử: số proton = số electron Ví dụ:
▪ Nguyên tử hidro (H):
• Hạt nhân có 1 proton (không có notron).
• Vỏ nguyên tử có 1 electron. ▪ Nguyên tử kali (K):
• Hạt nhân có 19 proton và 20 notron.
• Vỏ nguyên tử có 19 electron chuyển động xung quanh hạt nhân trên 4 lớp.
3. Kích thước nguyên tử
- Nếu xem nguyên tử như một quả cầu, tâm là hạt nhân, các electron chuyển
động rấ nhanh xung quanh hạt nhân thì đường kính nguyên tử cực kì bé, khoảng 10-10m = 1Å.
- Để đo kích thước nguyên tử, người ta dùng đơn vị Angstron (Å) hay nanomet (nm).
1Å = 10-10m = 10-8 cm; 1nm = 10-9 m => 1nm = 10Å
- Đường kính của hạt nhân nguyên tử: 10-4 Å.
- Đường kính của electron và proton đều bằng: 10-7 Å.
- Khoảng cách giữa hạt nhân và electron là môi trường chân không nên
nguyên tử có cấu tạo rỗng.
4. Khối lượng nguyên tử
- Khối lượng nguyên tử bằng tổng khối lượng của proton, notron và electron.
Vì khối lượng electron rất bé só với khối lượng của proton và notron nên
khối lượng nguyên tuwrr xấp xỉ bằng khối lượng của proton và notron.
- Khối lượng tuyệt đối (KLTĐ): là khối lượng thực sự của nguyên tử, khối lượng này rất bé.
Công thức tính: KLTĐ = ∑ ?? + ∑ ?? + ∑ ?? (gam) Hoặc: KLTĐ = M x 1,66.10-24 (gam)
Ví dụ: KLTĐ (Zn) = 65 x 1,66.10-24 = 107,9.10-24 (gam)
- Khối lượng tương đối (KLtđ): là khối lượng lớn gấp N lần khối lượng tuyệt
đối, tính bằng đơn vị cacbon (đvC).
Công thức tính: KLtđ = N x KLTĐ = N x 6,02.1023 (số Avôgađro)
Ví dụ: KLtđ (Zn) = 6,02.1023 x 107,9.10-24 = 64,95 (đvC).
III. NGUYÊN TỐ HÓA HỌC
1. Nguyên tố hóa học là gì? a) Định nghĩa:
- Nguyên tố hóa học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân,
- Số proton có trong hạt nhân nguyên tử là số đặc trưng của một nguyên tố hóa học.
- Các nguyên tử thuộc cùng nguyên tố hóa học có tính chất hóa học giống nhau. 2. Kí hiệu hóa học
- Mỗi nguyên tố hóa học được biểu diễn bằng một hay hai chữ cái, trong đó
chữ cái đầu được viết in hoa gọi là kí hiệu hóa học.
- Kí hiệu hóa học cho biết: ▪ Tên nguyên tố.
▪ Chỉ một nguyên tử của nguyên tố đó.
▪ Nguyên tử khối của nguyên tố.
Ví dụ: Kí hiệu hóa học của Fe cho biết:
▪ Tên nguyên tố là: sắt
▪ Chỉ một nguyên tử sắt
▪ Nguyên tử khối của sắt là: 56đvC
- Nếu biểu diễn 2, 3 … nguyên tử thì ta thêm các số vào trước kí hiệu của nguyên tố. Ví dụ:
▪ Ba nguyên tử nito: 3N
▪ Sáu nguyên tử photpho: 6P
Chú ý:Nếu viết Cl: đọc là nguyên tố clo, viết Cl : đọ 2
c là phân tử khí clo, viết
3Cl: đọc là ba nguyên tử clo. 3. Nguyên tử khối
- Nguyên tử khối (NTK) là khối lượng của một nguyên tử tính bằng đơn vị cacbon (đvC)
1đvC = 1 khối lượng một nguyên tử cacbon. 2
- Mỗi nguyên tố có nguyên tử khối riêng biệt. Chú ý:
▪ Khối lượng của nguyên tử tính bằng đơn vị gam gọi là khối lượng tuyệt
đối (KLTĐ). Khối lượng nguyên tử tính bằng đơn vị cacbon (đvC) gọi là
khối lượng tương đối (KLtđ).
▪ Để xác định tên của một nguyên tố hóa học chưa biết ta xác định số
proton trong nguyên tố hoặc nguyên tử khối.
4. Có bao nhiêu nguyên tố hóa học?
- Hiện nay người ta đã tìm ra 113 nguyên tố hóa học, trong đó có 92 nguyên
tố tự nhiên, còn lại là các nguyên tố nhân tạo.
- Nguyên tố tồn tại chủ yếu ở hai dạng:
▪ Dạng tự do (đơn chất): như oxi, hidro, lưu huỳnh…
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
- Tailieugiaovien.com.vn giới thiệu Giúp trí nhớ Hóa học 8, 9 trình bày một cách ngắn gọn, hệ thống toàn bộ kiến thức hóa học THCS nhằm giúp các em học tập, ôn tập một cách dễ nhất, nhanh nhất, chuẩn bị tốt kiến thức trong các kì thi.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(636 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)