Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
VI. BÀI KIỂM TRA HỌC KÌ II
VI.1. Tự luận: Từ bài 85 đến bài 88 Bài 85:
Câu 1 (1,5 điểm): Viết 3 phương trình phản ứng điều chế glucozo.
Câu 2 (1,5 điểm): Để xác minh đường gluocozo (thường có trong nước tiểu của
người bệnh đái đường) người ta chọn thuốc thử nào? Viết phương trình hóa học để minh họa.
Câu 3 (2 điểm): Khi đốt cháy cùng số mol các khí: CH4, C2H4, C3H4, C4H4. Tính tỉ
lệ theo thể tích của khí oxi cần dùng để đốt cháy mỗi chất (đo cùng điều kiện).
Câu 4 (2,5 điểm): Xà phòng hóa hoàn toàn 964,2g một loại chất béo thuộc dạng
(RCOO)3C3H5, cần vừa đủa 130g NaOH. Tính khối lượng muối của axit hữu cơ
thu được (cho H=1, C=12, O=16, Na=23).
Câu 5 (2,5 điểm): Nhúng một thanh sắt vào dung dịch CuSO4 sau một thời gian lấy
thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch
giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Bài 86: (Mỗi câu 2 điểm)
Câu 1 (2 điểm): Nhỏ 10ml dung dịch AgNO3 1M trong NH3 vào ống nghiệm đựng
dung dịch glucozo dư, sau khi kết thúc phản ứng, người ta thu được một lượng Ag
cân nặng 0,864g. Tính hiệu suất phản ứng (Ag=108)
Câu 2 (2 điểm): Viết phương trình hóa học của H2N – CH2 – COOH lần lượt với NaOH, C2H5OH.
Câu 3 (2 điểm): Hai phân tử X và Y có công thức cấu tạo lần lượt là:
HO – CH2 – COOH và H2N – CH2 – COOH. Viết các phương trình hóa học với Na
Câu 4 (2 điểm): Hãy điền Đ (nếu đúng) S (nếu sai) vào bảng sau: Đ hay S
1 Glucozo tác dụng được với AgNO3 trong NH3
2 Saccarozo tác dụng được với H2O trong axit
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
3 Xenlulozo không tác dụng với natri
4 Tinh bột tác dụng với iot cho màu xanh
5 Axit axetic tác dụng được với rượu etylic trong axit
6 Amino axit bị thủy phân trong môi trường axit hay kiềm
7 Rượu etylic tác dụng với natri
8 Benzen không tác dụng với nước
Câu 5 (2 điểm): Trộn 50ml axit axetic (D = 1,03 g/cm3) với 50ml nước cất (D = 1
g/cm3). Tính nồng độ % của axit axetic trong dung dịch đó.
Bài 87: (Mỗi câu 2 điểm)
Câu 1: Viết các phương trình hóa học của khí SO2 với dung dịch KOH.
Câu 2: Tính thể tích dung dịch CH3COOH 1,25M cần để trung hòa 60ml dung dịch NaOH 0,75M.
Câu 3: Cho một dây nhôm vào dung dịch Cu(NO3)2. Sau một thời gian lấy dây
nhôm ra khỏi dung dịch. Nhận xét hiện tượng.
Câu 4: Cho 0,1 lít dung dịch glucozo 0,1M tác dụng vừa đủ với dung dịch AgNO3
trong NH3. Tính khối lượng Ag thu được (cho Ag = 108).
Câu 5: Khi đốt cùng số mol các chất: rượu etylic, axit axetic và glucozo cần các thể
tích khí oxi (đktc) lần lượt là V1, V2, V3.
Xác định thứ tự tăng dần của V1, V2, V3.
Bài 88: (Mỗi câu 2 điểm)
Câu 1: Viết các phương trình hóa học (điều kiện thích hợp) của cacbon lần lượt tác
dụng với các chất sau: CuO, Fe2O3, O2.
Câu 2: Cho các dung dịch sau: axit sunfuric loãng, axit axetic, rượu etylic.
Bằng phương pháp hóa học nhận biêt từng chất.
Câu 3: Một chất béo có công thức: C15H31COO-CH(CH2-OOC17H35)2 bị thủy phân
trong dung dịch NaOH. Hãy viết phương trình hóa học.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Câu 4: Sục khí CO2 vào dung dịch NaOH dư. Viết phương trình hóa học.
Sau phản ứng trong dung dịch sẽ tồn tại những chất gì?
Câu 5: Tính nồng độ % của dung dịch rượu etylic 70° (biết 𝐷 = 0,8 g/ml, 𝐷 = 1 g/ml, H=1, C=12, O=16).
VI.2. TRẮC NGHIỆM KHÁCH QUAN (40%) VÀ TỰ LUẬN (60%): Từ bài 89 đến bài 92 Bài 89:
I. TRẮC NGHIỆM KHÁCH QUAN (mỗi câu 0,5 điểm)
Câu 1: Dãy các chất làm mất màu dung dịch nước brom là A. C2H2, C6H6, CH4 B. C2H2, CH4, C2H4 C. C2H2, C2H4 D. C2H2, H2, CH4
Câu 2: Dẫn 0,56 lít khí etilen (đktc) vào 200ml dung dịch Br2 0,2M.
Hiện tượng quan sát được là
A. màu dung dịch Br2 không đổi
B. màu da cam của dung dịch brom nhạt hơn so với ban đầu
C. màu da cam của dung dịch brom đậm hơn so với ban đầu
D. màu da cam của dung dịch brom chuyển thành không màu
Câu 3: Cặp chất nào sau đây tồn tại được trong cùng một dung dịch? A. K2CO3 và HCl B. NaNO3 và KHCO3 C. K2CO3 và Ca(OH)2
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải) D. KHCO3 và NaOH
Câu 4: Cho axetilen vào bình dung dịch brom dư. Khối lượng bình tăng lên a gam, a là khối lượng của A. dung dịch brom B. khối lượng brom C. axetilen D. brom và khí axetilen
Câu 5: Dãy các chất phản ứng với dung dịch NaOH là A. CH3COOH, ( C6H10O5 )n B. CH3COOC2H5, C2H5OH C. CH3COOH, C6H12O6 D. CH3COOH, CH3COOC2H5
Câu 6: Cho natri tác dụng với rượu etylic, chất tạo thành là A. H2, CH3CH2ONa B. H2, NaOH C. NaOH, H2O D. CH3CH2ONa, NaOH
Câu 7: Một loại rượu etylic có độ rượu 15°, thể tích C2H5OH chứa trong 1 lít rượu đó là A. 850 ml B. 150 ml C. 300 ml D. 450 ml
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đề kiểm tra Học kì 2 Hóa học 9
739
370 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Bộ đề kiểm tra Hóa học 9 Học kì 2 (gồm Bài kiểm tra 15p và Bài kiểm tra 1 tiết) kèm đáp án giúp Giáo viên tham khảo nhiều tài liệu môn Hóa lớp 9.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(739 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 9
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
VI. BÀI KIỂM TRA HỌC KÌ II
VI.1. Tự luận: Từ bài 85 đến bài 88
Bài 85:
Câu 1 (1,5 điểm): Viết 3 phương trình phản ứng điều chế glucozo.
Câu 2 (1,5 điểm): Để xác minh đường gluocozo (thường có trong nước tiểu của
người bệnh đái đường) người ta chọn thuốc thử nào? Viết phương trình hóa học để
minh họa.
Câu 3 (2 điểm): Khi đốt cháy cùng số mol các khí: CH
4
, C
2
H
4
, C
3
H
4
, C
4
H
4
. Tính tỉ
lệ theo thể tích của khí oxi cần dùng để đốt cháy mỗi chất (đo cùng điều kiện).
Câu 4 (2,5 điểm): Xà phòng hóa hoàn toàn 964,2g một loại chất béo thuộc dạng
(RCOO)
3
C
3
H
5
, cần vừa đủa 130g NaOH. Tính khối lượng muối của axit hữu cơ
thu được (cho H=1, C=12, O=16, Na=23).
Câu 5 (2,5 điểm): Nhúng một thanh sắt vào dung dịch CuSO
4
sau một thời gian lấy
thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch
giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Bài 86: (Mỗi câu 2 điểm)
Câu 1 (2 điểm): Nhỏ 10ml dung dịch AgNO
3
1M trong NH
3
vào ống nghiệm đựng
dung dịch glucozo dư, sau khi kết thúc phản ứng, người ta thu được một lượng Ag
cân nặng 0,864g. Tính hiệu suất phản ứng (Ag=108)
Câu 2 (2 điểm): Viết phương trình hóa học của H
2
N – CH
2
– COOH lần lượt với
NaOH, C
2
H
5
OH.
Câu 3 (2 điểm): Hai phân tử X và Y có công thức cấu tạo lần lượt là:
HO – CH
2
– COOH và H
2
N – CH
2
– COOH. Viết các phương trình hóa học với Na
Câu 4 (2 điểm): Hãy điền Đ (nếu đúng) S (nếu sai) vào bảng sau:
Đ hay S
1 Glucozo tác dụng được với AgNO
3
trong NH
3
2 Saccarozo tác dụng được với H
2
O trong axit

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
3 Xenlulozo không tác dụng với natri
4 Tinh bột tác dụng với iot cho màu xanh
5 Axit axetic tác dụng được với rượu etylic trong axit
6 Amino axit bị thủy phân trong môi trường axit hay kiềm
7 Rượu etylic tác dụng với natri
8 Benzen không tác dụng với nước
Câu 5 (2 điểm): Trộn 50ml axit axetic (D = 1,03 g/cm
3
) với 50ml nước cất (D = 1
g/cm
3
). Tính nồng độ % của axit axetic trong dung dịch đó.
Bài 87: (Mỗi câu 2 điểm)
Câu 1: Viết các phương trình hóa học của khí SO
2
với dung dịch KOH.
Câu 2: Tính thể tích dung dịch CH
3
COOH 1,25M cần để trung hòa 60ml dung dịch
NaOH 0,75M.
Câu 3: Cho một dây nhôm vào dung dịch Cu(NO
3
)
2
. Sau một thời gian lấy dây
nhôm ra khỏi dung dịch. Nhận xét hiện tượng.
Câu 4: Cho 0,1 lít dung dịch glucozo 0,1M tác dụng vừa đủ với dung dịch AgNO
3
trong NH
3
. Tính khối lượng Ag thu được (cho Ag = 108).
Câu 5: Khi đốt cùng số mol các chất: rượu etylic, axit axetic và glucozo cần các thể
tích khí oxi (đktc) lần lượt là V
1
, V
2
, V
3
.
Xác định thứ tự tăng dần của V
1
, V
2
, V
3
.
Bài 88: (Mỗi câu 2 điểm)
Câu 1: Viết các phương trình hóa học (điều kiện thích hợp) của cacbon lần lượt tác
dụng với các chất sau: CuO, Fe
2
O
3
, O
2
.
Câu 2: Cho các dung dịch sau: axit sunfuric loãng, axit axetic, rượu etylic.
Bằng phương pháp hóa học nhận biêt từng chất.
Câu 3: Một chất béo có công thức: C
15
H
31
COO-CH(CH
2
-OOC
17
H
35
)
2
bị thủy phân
trong dung dịch NaOH. Hãy viết phương trình hóa học.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 4: Sục khí CO
2
vào dung dịch NaOH dư. Viết phương trình hóa học.
Sau phản ứng trong dung dịch sẽ tồn tại những chất gì?
Câu 5: Tính nồng độ % của dung dịch rượu etylic 70° (biết 𝐷
= 0,8 g/ml,
𝐷
= 1 g/ml, H=1, C=12, O=16).
VI.2. TRẮC NGHIỆM KHÁCH QUAN (40%) VÀ TỰ LUẬN (60%):
Từ bài 89 đến bài 92
Bài 89:
I. TRẮC NGHIỆM KHÁCH QUAN (mỗi câu 0,5 điểm)
Câu 1: Dãy các chất làm mất màu dung dịch nước brom là
A. C
2
H
2
, C
6
H
6
, CH
4
B. C
2
H
2
, CH
4
, C
2
H
4
C. C
2
H
2
, C
2
H
4
D. C
2
H
2
, H
2
, CH
4
Câu 2: Dẫn 0,56 lít khí etilen (đktc) vào 200ml dung dịch Br
2
0,2M.
Hiện tượng quan sát được là
A. màu dung dịch Br
2
không đổi
B. màu da cam của dung dịch brom nhạt hơn so với ban đầu
C. màu da cam của dung dịch brom đậm hơn so với ban đầu
D. màu da cam của dung dịch brom chuyển thành không màu
Câu 3: Cặp chất nào sau đây tồn tại được trong cùng một dung dịch?
A. K
2
CO
3
và HCl
B. NaNO
3
và KHCO
3
C. K
2
CO
3
và Ca(OH)
2
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
D. KHCO
3
và NaOH
Câu 4: Cho axetilen vào bình dung dịch brom dư. Khối lượng bình tăng lên a gam,
a là khối lượng của
A. dung dịch brom
B. khối lượng brom
C. axetilen
D. brom và khí axetilen
Câu 5: Dãy các chất phản ứng với dung dịch NaOH là
A. CH
3
COOH, ( C
6
H
10
O
5
)
n
B. CH
3
COOC
2
H
5
, C
2
H
5
OH
C. CH
3
COOH, C
6
H
12
O
6
D. CH
3
COOH, CH
3
COOC
2
H
5
Câu 6: Cho natri tác dụng với rượu etylic, chất tạo thành là
A. H
2
, CH
3
CH
2
ONa
B. H
2
, NaOH
C. NaOH, H
2
O
D. CH
3
CH
2
ONa, NaOH
Câu 7: Một loại rượu etylic có độ rượu 15°, thể tích C
2
H
5
OH chứa trong 1 lít rượu
đó là
A. 850 ml
B. 150 ml
C. 300 ml
D. 450 ml

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 8: Chỉ dùng dung dịch iot và dung dịch AgNO
3
trong NH
3
có thể phân biệt
được các chất trong mỗi dãy của dãy nào sau đây?
A. axit axetic, glucozo, saccarozo
B. xenlulozo, rượu etylic, saccarozo
C. hồ tinh bột, rượu etylic, glucozo
D. benzene, rượu etylic, glucozo
II. TỰ LUẬN (6 điểm)
Câu 9 (2 điểm): Hãy viết phương trình hóa học và ghi rõ điều kiện của các phản
ứng sau:
1. Trùng hợp etilen.
2. Axit axetic tác dụng với magie.
3. Oxi hóa rượu etylic thành axit axetic.
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác
Câu 10 (2 điểm): Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những
chuyển hóa sau: FeS
2
SO
2
SO
3
H
2
SO
4
CH
3
COOH
Câu 11 (2 điểm): Cho 2,24 lít (đktc) hỗn hợp khí axetilen và metan vào dung dịch
brom, dung dịch brom bị nhạt màu. Sau phản ứng khối lượng dung dịch tăng 1,3g.
1. Tính khối lượng brom tham gia phản ứng.
2. Xác định thành phần % về thể tích của mỗi khí trong hỗn hợp.
(cho O=16, C=12, H=1)
Bài 90:
I. TRẮC NGHIỆM KHÁCH QUAN (mỗi câu 0,5 điểm)
Câu 1: Dãy các chất tác dụng được với dung dịch H
2
SO
4
loãng là
A. Ca(HCO
3
)
2
, Ba(OH)
2
B. NaHCO
3
, Na
2
SO
4
C. CH
3
COOH, Ca(OH)
2
, BaCO
3

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
D. CH
4
, K
2
CO
3
, NaNO
3
Câu 2: Đốt cháy hoàn toàn một lượng sắt trong khí clo dư. Hòa tan sản phẩm phản
ứng vào nước thu được dung dịch X. Thêm dung dịch NaOH vào dung dịch X.
hiện tượng quan sát được sẽ là
A. chỉ tạ thành dung dịch không màu
B. có chất kết tủa màu xanh tạo thành
C. có chất kết tủa màu nâu đỏ tạo thành
D. có dung dịch màu nâu đỏ tạo thành
Câu 3: Dãy gồm tất cả các chất không làm mất màu dung dịch brom là
A. CH
4
, C
6
H
6
, CH
3
COONa
B. C
2
H
4
, C
2
H
2
, CH
3
COOH
C. CH
4
, C
2
H
2
, C
2
H
5
OH
D. C
6
H
6
, C
2
H
4
, C
6
H
12
O
6
Câu 4: Điều nào sau đây không đúng?
A. Dầu thực vật và mỡ động vật là những chất béo
B. Chất béo là hỗn hợp nhiều este
C. Chất béo là hỗn hợp các este của glixerol với axit hữu cơ mà phân tử có nhiều
nguyên tử cacbon
D. Các chất béo đều bị thủy phân trong môi trường axit
Câu 5: Cặp chất cùng tồn tại trong dung dịch là
A. CH
3
COOH và H
2
SO
4
loãng
B. NaHCO
3
và HCl
C. KNO
3
và Na
2
CO
3
D. NaHCO
3
và NaOH

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 6: Các chất được dùng điều chế trực tiếp etyl axetat là
A. axit axetic, natri hidroxit, tinh bột
B. axit axetic, rượu etylic, axit clohidric
C. rượu etylic, nước và axit sunfuric đặc
D. rượu etylic, axit axetic và axit sunfuric đặc
Câu 7: Hãy chọn câu đúng:
A. Rượu etylic tan nhiều trong nước vì phân tử rượu etylic chỉ có liên kết đơn.
B. Những chất mà phân tử có nhóm –OH hoặc –COOH thì tác dụng được với
NaOH.
C. Trong 1 lít rượu etylic 15° có 0,15 lít rượu etylic và 0,85 lít nước.
D. Natri có khả năng đẩy được tất cả các nguyên tử H ra khỏi phân tử rượu etylic.
Câu 8: Dung dịch ZnCl
2
có tạp chất CuCl
2
có thể dùng chất nào trong các chất sau
đây để loại tạp chất trên?
A. Mg
B. Zn
C. Cu
D. Ni
II. TỰ LUẬN (6 điểm)
Câu 9 (2 điểm): Có 2 dung dịch sau đựng riêng biệt 2 bình không dán nhãn: axit
axetic và glucozo.
Hãy nêu 2 phương pháp hóa học để phân biệt mỗi dung dịch (dụng cụ, hóa chất coi
như có đủ). Viết các phương trình hóa học (nếu có).
Câu 10 (2 điểm): Viết công thức cấu tạo thu gọn và viết phương trình hóa học với
dung dịch H
2
SO
4
và với dung dịch NaOH của một chất có công thức
(C
17
H
35
COO)
3
C
3
H
5
.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 11 (2 điểm): Cho 100ml etanol 96°.
a) Tìm thể tích etanol nguyên chất.
b) Tính thể tích khí H
2
(ở đktc) thu được khi đem 10ml rượu đó tác dụng với
Na dư. (biết 𝐷
= 1 g/ml, 𝐷
= 0,8 g/ml, C=12, H=1, O=16)
Bài 91:
I. TRẮC NGHIỆM KHÁCH QUAN (mỗi câu 0,5 điểm)
Câu 1: Dung dịch HCl có thể tác dụng với
A. NaHCO
3
B. KCl
C. CuSO
4
D. AgBr
Câu 2: Oxit cacbon (CO) phản ứng với tất cả các chất trong dãy nào dưới đây?
A. Fe, CuO, O
2
B. Ca, Fe
2
O
3
, CuO
C. PbO, ZnO, Fe
2
O
3
D. Al
2
O
3
, CuO, PbO
Câu 3: Đốt cháy hoàn toàn chất hữu cơ X thu được CO
2
và H
2
O với số mol bằng
nhau. X là
A. C
2
H
5
OH
B. C
2
H
4
C. C
2
H
2
D. C
6
H
6
Câu 4: Mọi chất hữu cơ đều

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
A. có mặt nguyên tố cacbon
B. chứa nguyên tố oxi
C. có cùng công thức phân tử khi có cùng khối lượng mol
D. chứa nguyên tố cacbon và nguyên tố hidro
Câu 5: Benzen không phản ứng với
A. Br
2
khan có bột Fe làm xúc tác
B. không khí khi đốt
C. H
2
có mặt Ni nung nóng
D. dung dịch Br
2
Câu 6: Dãy các chất phản ứng với kim loại kali là
A. axit axetic, xenlulozo, polietilen
B. tinh bột, rượu etylic, poli(vinyl clorua)
C. axit axetic, nước, rượu etylic
D. axit axetic, xenlulozo, tinh bột
Câu 7: Dãy nào sau đây gồm các chất bị thủy phân trong môi trường axit?
A. xenlulozo, polietilen, axit axetic
B. etyl axetat, rượu etylic, poli(vinyl clorua)
C. glucozo, rượu etylic, fructozo
D. tinh bột, saccarozo, xenlulozo
Câu 8: Nung hỗn hợp: C
2
H
5
OH, H
2
SO
4
đặc ở 170°C thu được hỗn hợp hỗn hợp khí
gồm C
2
H
4
, CO
2
, SO
2
. Hóa chất nào sau đây được dùng để thu đươc khí C
2
H
4
không lẫn khí CO
2
, SO
2
?
A. dung dịch KMnO
4

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
B. dung dịch Br
2
C. dung dịch KOH
D. dung dịch K
2
CO
3
II. Tự luận (6 điểm)
Câu 9 (2 điểm): Viết phương trình hóa học thể hiện chuyển hóa sau:
C
12
H
22
O
11
C
6
H
12
O
6
C
2
H
5
OH CH
3
COOH CH
3
COONa
Câu 10 (2 điểm): Có 3 khí sau đựng riêng biệt trong 3 lọ: C
2
H
4
, Cl
2
, CH
4
Nêu phương pháp hóa học để nhận biết mỗi khí trong lọ (dụng cụ, hóa chất coi như
có đủ).
Câu 11 (2 điểm): Để điều chế axit axetic người ta có thể lên men 1,5 lít rượu etylic
10°.
a) Tính thể tích rượu etylic nguyên chất đã dùng (biết 𝐷
= 0,8 g/ml).
b) Tính khối lượng axit axetic tạo thành (biết hiệu suất phản ứng 80%, C=12,
H=1, O=16).
Bài 92:
I. TRẮC NGHIỆM KHÁCH QUAN (mỗi câu 0,5 điểm)
Câu 1: Nếu biết nguyên tố R tạo được với clo hợp chất có công thức hóa học RCl
5
.
Công thức oxit cao nhất của R sẽ là
A. R
2
O
3
B. R
2
O
5
C. RO
3
D. R
2
O
7
Câu 2: Trong dãy các chất sau, dãy nào chỉ chứa chất hữu cơ?
A. CO
2
, CH
3
COONa, C
6
H
12
O
6

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
B. Na
2
CO
3
, C
2
H
5
OH, CH
3
CH
2
ONa
C. CO, NaHCO
3
, C
6
H
6
D. CH
3
Cl, (C
17
H
35
COO)
3
C
3
H
5
Câu 3: Dãy gồm các chất đều làm mất màu dung dịch brom là
A. CH
4
, C
6
H
6
, C
2
H
6
B. C
2
H
4
, C
2
H
2
, SO
2
C. CH
4
, C
2
H
2
, H
2
D. C
6
H
6
, C
2
H
2
, CO
Câu 4: Đốt nóng hỗn hợp bột CuO và C rồi dẫn khí thu được vào bình đựng nước
vôi trong (dư). Hiện tượng quan sát được ở bình đựng nước vôi là
A. nước vôi trong vẫn đục
B. có chất rắn màu đỏ
C. có hơi nước tạo thành còn màu chất rắn không thay đổi
D. có chất rắn màu đỏ tạo thành và nước vôi trong vẩn đục
Câu 5: Thuốc thử nào say đây được dùng để nhận ra rượu etylic và axit axetic?
A. Na
B. NaHCO
3
C. NaCl
D. KCl
Câu 6: Dãy các chất không bị thủy phân trong môi trường axit là
A. polietilen, rượu etylic, poli(vinyl clorua)
B. tinh bột, protein, saccarozo
C. xenlulozo, saccarozo, glucozo

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
D. tinh bột, xenlulozo, protein
Câu 7: Để nhận biết các lọ mất nhãn riêng biệt chứa các chất CO
2
, CH
4
, C
2
H
4
, ta
dùng các thuốc thử
A. dung dịch phenolphtalein
B. giấy đo độ pH
C. nước vôi trong và dung dịch brom
D. nước và giấy quỳ tím
Câu 8: Dẫn 1,12 lít khí C
2
H
4
(đktc) vào 200ml dung dịch Br
2
1M.
Màu da cam của dung dịch sẽ
A. nhạt dần
B. chuyển thành không màu
C. chuyển thành vàng đậm hơn
D. không thay đổi gì
II. TỰ LUẬN (6 điểm)
Câu 9 (2 điểm): Hoàn thành các phương trình hóa học sau:
a) C
2
H
5
OH + ___ C
2
H
5
OK + ___↑
b) CH
3
COOH + CaCO
3
___ + ___ + ___
c) ___ + ZnO (CH
3
COO)
2
Zn + ___
d) ___ + KOH CH
3
COOK + ___
Câu 10 (2 điểm): Đốt cháy hoàn toàn 6 g chất hữu cơ A. Thu được 8,8g khí CO
2
và
3,6g H
2
O.
a) Trong chất hữu cơ A có những nguyên tố nào?
b) Biết phân tử khối của A trong khoảng từ 55đvC đến 65đvC.
Tìm công thức phân tử của A (cho C=12, H=1, O=16).
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 11 (2 điểm): Có hỗn hợp A gồm rượu etylic và axit axetic. Cho 21,2g A phản
ứng với Na dư thì thu được 4,48 lít khí (ở đktc). Tính phần trăm khối lượng mỗi
chất trong hỗn hợp A (cho C=12, O=16, H=1).
VI.3. TRẮC NGHIỆM KHÁCH QUAN: Từ bài 93 đến bài 96
Bài 93: (20 câu: mỗi câu 0,5 điểm)
Câu 1: Sản phẩm phản ứng nào được tạo ra khi hòa tan khí clo và nước?
A. Cl
2
B. HCl
C. HClO, Cl
2
D. HCl, HClO
Câu 2: Dãy nào sau đây gồm các chất phản ứng được với dung dịch NaOH?
A. CH
3
COOH, ( C
6
H
10
O
5
)
n
B. CH
3
COOH, C
6
H
12
O
6
C. CH
3
COOC
2
H
5
, C
2
H
5
OH
D. CH
3
COOH, CH
3
COOC
2
H
5
Câu 3: Dãy các kim loại tác dụng với dung dịch CuSO
4
là
A.Mg, Al, Cu
B. Al, Fe, Mg
C. Al, Fe, Ag
D. Ag, Al, Cu
Câu 4: Chọn câu sai trong các câu sau:
A. Etanol là một chất lỏng, không màu, tan vô hạn trong nước
B. Natri đẩy được nguyên tử H trong nhóm –OH của etanol

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
C. Rượu etylic có nhiệt độ sôi thấp hơn nhiệt độ sôi của nước
D. Rượu etylic tác dụng được với NaOH
Câu 5: Khí clo phản ứng được với tất cả các chất trong dãy nào sau đây tạo sản
phẩm là muối?
A. Fe, KOH, H
2
O
B. Cu, Al, H
2
O
C. KOH, Fe, Al
D. H
2
, Ca(OH)
2
, Mg
Câu 6: Đốt cháy hoàn toàn 2,3 g một chất hữu cơ X, thu được 2,24 lít CO
2
(đktc)
và 2,7g H
2
O. Biết phân tử X chỉ có 1 nguyên tử oxi.
Công thức phân tử của X là (cho C+12, O=16, H=1)
A. C
2
H
6
O
B. CH
4
O
C. C
3
H
6
O
D. C
2
H
6
O
2
Câu 7: Tổng hệ số cân bằng tối giản và nguyên, khi đốt cháy etanol là
A. 9
B. 10
C. 17
D. 8
Câu 8: Cho các chất: CH
3
– O – CH
3
, C
6
H
6
, CH
3
OH, C
2
H
5
OH, ( C
6
H
10
O
5
)
n
Dãy các chất tác dụng được với Na là
A. CH
3
OH, C
2
H
5
OH, ( C
6
H
10
O
5
)
n

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
B. CH
3
– O – CH
3
, C
2
H
5
OH, ( C
6
H
10
O
5
)
n
C. CH
3
– O – CH
3
, C
6
H
6
, CH
3
OH
D. CH
3
OH, C
2
H
5
OH
Câu 9: Độ rượu là số ml rượu etylic có trong ___
Bổ sung đoạn còn thiếu bằng cụm từ nào trong các cụm từ sau?
A. 100ml dung dịch rượu
B. 100 gam dung dịch rượu
C. 100ml nước cất
D. 100 gam nước cất
Câu 10: Chất nào trong các chất sau khi tác dụng với kiềm tạo glixerol và muối của
axit hữu cơ?
A. benzen
B. axit axetic
C. rượu etylic
D. chất béo
Câu 11: Hòa tan hoàn toàn 15,3g BaO vào 84,7g nước. Nồng độ % của dung dịch
tạo ra là (cho H=1, C=12, O=16, Ba=137)
A. 17,1%
B. 26,55%
C. 13,28%
D. 39,83%
Câu 12: Khí nào trong các khí sau có khả năng làm phai màu dung dịch brom?
A. H
2

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
B. C
2
H
4
C. O
2
D. CO
Câu 13: Khi đun nóng chất béo tự nhiên với dung dịch kiềm, thu được
A. glixerol và 1 muối của axit béo
B. glixerol và 2 muố của axit béo
C. glixerol và 3 muối của axit béo
D. glixerol và hỗn hợp các muối của axit béo
Câu 14: Thể tích dung dịch H
2
SO
4
1M cần để trung hòa 200ml dung dịch NaOH
1M là
A. 100ml
B. 150ml
C. 200ml
D. 250ml
Câu 15: Khi đun nóng 1,78kg (C
17
H
35
COO)
3
C
3
H
5
với dung dịch NaOH dư. Phản
ứng xảy ra hoàn toàn. Khối lượng glixerol thu được là (cho H=1, C=12, O=16)
A. 180g
B. 182 g
C. 184 g
D. 276 g
Câu 16: Cho các hợp chất có công thức: (C
17
H
35
COO)
3
C
3
H
5
, C
3
H
7
OH, CH
3
COOH,
C
6
H
6
, ( C
6
H
10
O
5
)
n
Dãy nào gồm các chất không tác dụng với NaOH?
A. CH
3
COOH, C
6
H
6
, ( C
6
H
10
O
5
)
n

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
B. (C
17
H
35
COO)
3
C
3
H
5
, CH
3
COOH, C
6
H
6
C. (C
17
H
35
COO)
3
C
3
H
5
, C
3
H
7
OH, ( C
6
H
10
O
5
)
n
D. C
3
H
7
OH, C
6
H
6
, ( C
6
H
10
O
5
)
n
Câu 17: Dung dịch hỗn hợp gồm rượu etylic, axit axetic và phenolphthalein sẽ
A. có màu xanh
B. có màu đỏ
C. có màu hồng
D. không màu
Câu 18: Người ta điều chế 1 tạ poli(vinyl clorua) từ vinyl clorua với hiệu suất 85%
theo phương trình sau: nCH
2
=CHCl
ú á,á ấ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
( CH
2
– CHCl )
n
Lượng vinyl clorua cần dùng là (cho H=1, C=12, Cl=35,5)
A. 15kg
B. 100kg
C. 85kg
D. 117,65kg
Câu 19: Biết rằng chất xơ cung cấp ít năng lượng hơn chất béo. Trong các chất sau:
tinh bột, protein, chất xơ, chất béo, chất cung cấp nhiều năng lượng nhất là
A. tinh bột
B. protein
C. chất xơ
D. chất béo
Câu 20: Chất nào sau đây tác dụng được với CaO?
A. CO

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
B. NO
C. SO
2
D. C
2
H
2
Bài 94: (20 câu: mỗi câu 0,5 điểm)
Câu 1: Dãy các chất tan được trong nước là
A. K
2
O, BaO, C
2
H
5
OH
B. CuO, CaO, CH
3
COOH
C. CuSO
4
, AgCl, Fe(OH)
3
D. CO
2
, SO
3
, BaSO
4
Câu 2: Sục khí C
2
H
2
qua dung dịch Br
2
sẽ làm dung dịch
A. giảm khối lượng
B. tăng khối lượng
C. không thay đổi khối lượng
D. không thay đổi màu sắc
Câu 3: Thể tích dung dịch NaOH 1M cần dùng để tạo kết tủa tối đa với 100ml
dung dịch Al
2
(SO
4
)
3
0,1M là
A. 200ml
B. 30ml
C. 25ml
D. 60ml
Câu 4: Dãy nào sau đây gồm các chất đều có phản ứng thủy phân?
A. Tinh bột, xenlulozo, PVC
B. Tinh bột, xenlulozo, protein, saccarozo, chất béo
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
C. Tinh bột, xenlulozo, protein, saccarozo, glucozo
D. Tinh bột, xenlulozo, protein, saccarozo, PE
Câu 5: Dãy nào sau đây gồm các chất thuộc loại polime?
A. Metan, etilen, polietilen
B. Metan, tinh bột, polietilen
C. Poli(vinyl clorua), etilen, polietilen
D. Poli(vinyl clorua), tinh bột, polietilen
Câu 6: Đốt cháy chất hữu cơ X trong oxi tạo ra sản phẩm là CO
2
, H
2
O và khí N
2
. X
là
A. xenlulozo
B. tinh bột
C. protein
D. poli(vinyl clorua)
Câu 7: Dãy nào sau đây gồm các chất phản ứng với kim loại natri?
A. CH
3
COOH, ( C
6
H
10
O
5
)
n
B. CH
3
COOH, C
2
H
5
OH
C. C
2
H
5
OH, ( C
6
H
10
O
5
)
n
D. C
2
H
5
OH, CH
3
COOC
2
H
5
Câu 8: Khi chưng khô 25ml dung dịch CuSO
4
0,5M, người ta thu được một lượng
CuSO
4
là (cho Cu=64, S=32, O=16)
A. 2,0 g
B. 2,5 g
C. 6,25 g

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
D. 5,0 g
Câu 9: Etanol tan vô hạn trong nước là vì trong phân tử C
2
H
6
O
A. chỉ có liên kết đơn
B. ngoài 2 nguyên tố cacbon, hidro còn có nguyên tố oxi
C. có nhóm -OH
D. chỉ có 2 nguyên tử C
Câu 10: Cho 6,9 g etanol tác dụng hết với kim loại kali. Thể tích ở đktc khí hidro
thu được là (H=1, C=12, O=16)
A. 1,68 lít
B. 3,36 lít
C. 4,48 lít
D. 5,6 lít
Câu 11: Chất nào sau đây ở điều kiện thường là một chất lỏng?
A. axetilen
B. metan
C. etilen
D. thủy ngân
Câu 12: Lấy 4,5g một chất X có công thức C
n
H
2n+1
OH tác dụng với kali (vừa đủ),
chưng khô dung dịch sau phản ứng thì được 7,35g chất rắn.
Công thức chất X là (cho H=1, C=12, O=16, K=39)
A. C
3
H
7
OH
B. CH
3
OH
C. C
2
H
5
OH

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
D. C
4
H
9
OH
Câu 13: Kim loại nào trong các kim loại dưới đây, tác dụng với nước mạnh nhất?
A. Mg
B. Ba
C. K
D. Al
Câu 14: Chất có khả năng làm mất màu dung dịch quỳ tím là
A. clo
B. axit axetic
C. NaOH
D. axit clohidric
Câu 15: Đốt cháy hoàn toàn 0,74g chất Y (có C, H, O) trong bình kín sau đó dẫn
sản phẩm qua bình (1) đựng H
2
SO
4
đặc và bình (2) đựng NaOH (dư). Khi kết thúc
phản ứng, độ tăng khối lượng ở bình (1) là 0,9g và bình (2) là 1,76g. Trong phân tử
Y chỉ có 1 nguyên tử O. Công thức của Y là (H=1, C=12, O=16)
A. C
3
H
8
O
B. C
2
H
4
O
C. CH
4
O
D. C
6
H
12
O
6
Câu 16: Sản phẩm tạo ra của ; phản ứng: CH
3
COOH tác dụng với Mg là
A. CH
3
COOMg, H
2
B. (CH
3
COO)
2
Mg, H
2
C. (CH
3
CH
2
O)
2
Mg, H
2
D. (CH
3
COO)
2
Mg, CO
2
, H
2
O

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 17: Một chất hữu cơ X, tan được trong nước. Khi đốt 1 mol X thu được 6 mol
CO
2
. X là chất nào trong số các chất sau?
A. H
2
N – CH
2
– COOH
B. ( C
6
H
10
O
5
)
n
C. (C
17
H
35
COO)
3
C
3
H
5
D. C
6
H
12
O
6
Câu 18: Để hoàn thành sơ đồ:
Tinh bột
()
glucozo
()
rượu etylic
()
axit axetic
()
etyl axetat
Điều kiện ở các vị trí (1), (2), (3), (4) nào sau đây là không phù hợp?
A. (1) dung dịch H
2
SO
4
loãng
B. (2) men rượu
C. (3) men rượu
D. (4) rượu etylic và H
2
SO
4
đặc, nung nóng
Câu 19: Cho biết nhiệt lượng tỏa ra khi oxi hóa hoàn toàn glucozo là 239 kJ/mol.
Vậy nhiệt lượng tỏa ra khi oxi hóa hoàn toàn 500 g glucozo là (H=1, C=12, O=16)
A. 663,9kJ
B. 737,6kJ
C. 1991,6kJ
D. 66,39kJ
Câu 20: Sự quan hợp của cây xanh tạo thành glucozo, thơ phương trình:
6CO
2
+ 6H
2
O
+ 2816kJ
á á,ệ ụ
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
C
6
H
12
O
6
+ 6O
2
Năng lượng tối thiểu mà cây xanh hấp thụ để tổng hợp 1,8kg glucozo là (H=1,
C=12, O=16)

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
A. 28160kJ
B. 45750kJ
C. 37250kJ
D. 91520kJ
Bài 95: (20 câu: mỗi câu 0,5 điểm)
Câu 1: Đốt cháy 32g khí metan (ở đktc), thể tích CO
2
sinh ra là (C=12, H=1)
A. 11,2 lít
B. 22,4 lít
C. 33,6 lít
D. 44,8 lít
Câu 2: Tổng hệ số cân bằng phương trình hóa học (nguyên và tối giản) của phản
ứng điều chế khí clo từ MnO
2
và dung dịch HCl là
A. 9
B. 9
C. 10
D. 11
Câu 3: Etilen không tác dụng với chất nào sau đây?
A. CH
4
B. Br
2
C. H
2
D. O
2
Câu 4: Thể tích của 14g khí (ở đktc) etilen là (C=12, H=1)
A. 28 lít

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
B. 5,6 lít
C. 11,2 lít
D. 14 lít
Câu 5: Số phương trình phản ứng khi CH
3
COOH tác dụng lần lượt với: CuO,
CaCO
3
, Ag, C
2
H
5
OH, Ca(OH)
2
, Na
2
SO
4
là
A. 4
B. 3
C. 5
D. 6
Câu 6: Phân tử C
2
H
4
O
2
nếu có khả năng làm quỳ tím ẩm hóa đỏ thì trong cấu tạo
phân tử phải có nhóm
A. -OH
B. -COOH
C. -CH=O
D. CH
3
-
Câu 7: Để nhận biết các lọ mất nhãn đựng các chất lỏng: axit axetic, rượu etylic và
benzene bằng phương pháp hóa học người ta có thể dùng
A. quì tím và Na
B. dung dịch NaOH
C. dung dịch H
2
SO
4
D. nước tinh khiết
Câu 8: Thả từ từ 10,6g Na
2
CO
3
vào 300ml dung dịch CH
3
COOH 1M khi thoát ra
cho hấp thụ vào dung dịch Ba(OH)
2
(dư). Khối lượng kết tủa thu được là (Na=23,
C=12, H=1, Ba=137)

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
A. 19,7g
B. 29,65g
C. 35,46g
D. 11,82g
Câu 9: Hiện tượng quan sát được khi sục từ từ khí CO
2
qua dung dịch nước vôi
trong là
A. độ vẩn đục tăng, sau một thời gian thì độ vẩn đục giảm dần
B. không thấy hiện tượng gì
C. độ đục tăng dần
D. có màu đỏ xuất hiện
Câu 10: Cho 3g axit axetic vào 4,6g rượu etylic và H
2
SO
4
đặc, đun nóng sau phản
ứng thu được 3,3g etyl axetat. Hiệu suất phản ứng là (H=1, C=12, O=16)
A. 75%
B. 25%
C. 50%
D. 65%
Câu 11: Khi đốt một chất hữu cơ có công thức C
n
H
2n
thì tỉ lệ thể tích khí O
2
phản
ứng và thể tích khí CO
2
tạo thành (cùng nhiệt độ và áp suất) luôn bằng
A. 1,5
B. 2
C.
D.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 12: Để xác định hàm lượng % tinh bột trong một loại ngũ cốc, nguời ta thủy
phân 65g ngũ cốc đó. Đem lượng glucozo tạo ra lên men rượu rồi kiểm tra lượng
CO
2
sinh ra bằng dung dịch nước vôi (dư), thì thấy có 50g CaCO
3
. Hiệu suất cả
quá trình 80%. Tỉ lệ tinh bột trong loại ngũ cốc đó là (H=1, C=12, O=16, Ca=40)
A. 77,88%
B. 86,54%
C. 95,50%
D. 65,32%
Câu 13: Cách ghép cột (I) và cột (II) nào sau đây là thích hợp (không lặp lại)?
Cột (I) Cột (II)
1. Glucozo
2. Saccarozo
3. Tinh bột
4. Xenlulozo
a. thủy phân cho glucozo.
b. gặp iot cho màu xanh.
c. thủy phân cho glucozo và fructozo.
d. có phản ứng tráng bạc.
A. 1-b, 2-a, 3-d, 4-c
B. 1-d, 2-c, 3-b, 4-a
C. 1-d, 2-a, 3-c, 4-b
D. 1-a, 2-b, 3-c, 4-d
Câu 14: Biết nhiệt lượng tỏa ra khi oxi hóa hoàn toàn glucozo là 562,68kJ/mol.
Lượng nhiệt tỏa ra khi oxi hóa hoàn toàn 100 g glucozo là (H=1, C=12, O=16)
A. 146,3kJ
B. 292,6kJ
C. 877,8kJ
D. 351,12kJ

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 15: Dung dịch nào trong các dung dịch sau đây có pH lớn nhất?
A. HCl
B. NaCl
C. NaOH
D. NaHCO
3
Câu 16: Biết năng lượng tỏa ra khi cơ thể oxi hóa hoàn toàn một loại chất béo là 38
kJ/gam. Cũng loại chất béo đó, nếu cơ thể oxi hóa hết 50g, thì năng lượng tỏa ra sẽ
(cho H=1, C=12, O=16) là
A. 950kJ
B. 1900kJ
C. 2850kJ
D. 2191,3kJ
Câu 17: Tơ tằm thuộc loại
A. tơ hóa học
B. tơ nhân tạo
C. tơ tổng hợp
D. tơ thiên nhiên
Câu 18: Ngâm bột sắt thật lâu trong dung dịch CuSO
4
thì màu của dung dịch
A. xanh đậm dần lên
B. từ màu xanh chuyển sang màu nâu đỏ
C. nhạt dần
D. không đổi
Câu 19: Các cặp khí sau, khí nào tác dụng được với nhau?

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
A. CH
4
và H
2
B. CO
2
và O
2
C. SO
2
và O
2
D. CO và NO
Câu 20: Hòa tan 75ml dung dịch CH
3
COOH 1M với 25ml dung dịch CH
3
COOH
2M. Nếu sự hòa tan không làm thay đổi thể tích thì nồng độ mol của dung dịch
CH
3
COOH tạo ra là
A. 1,2M
B. 1,5M
C. 1,25M
D. 1,75M
Bài 96: (20 câu: mỗi câu 0,5 điểm)
Câu 1: Phương pháp háo học nào sau đây được dùng để loại bỏ khí etilen lẫn trong
metan?
A. đốt cháy hỗn hợp trong không khí
B. dẫn hỗn hợp khí đi qua dung dịch brom dư
C. dẫn dung dịch khí đi qua muối ăn
D. dẫn hỗn hợp khí đi qua nước
Câu 2: Trong cấu tạo phân tử hợp chất hữu cơ thì
A. liên kết ba bền hơn gấp ba lần liên kết đơn
B. liên kết đôi bền gấp hai lần liên kết đơn
C. trong liên kết đôi có một liên kết kém bền hơn liên kết đơn
D. liên kết đôi và liên kết đơn đều rất bền vững
Câu 3: Benzen không phản ứng với chất nào sau đây?

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
A. Br
2
có Fe làm xúc tác
B. O
2
C. H
2
D. Na
Câu 4: Rượu etylic có công thức cấu tạo là
A. CH
3
– O – CH
3
B. CH
3
– CH
2
– OH
C. CH
3
– OH
D. CH
3
– CH
2
– CH
2
– OH
Câu 5: Cho hỗn hợp M gồm axit axetic và rượu etylic tác dụng hết với Na thu được
0,672 lít khí (đktc). Nếu cho hỗn hợp trên tác dụng với dung dịch NaOH thì cần
0,04 mol NaOH. Khối lượng rượu etylic trong hỗn hợp đầu là (H=1, C=12, O=16)
A. 0,92 g
B. 0,69g
C. 1,38g
D. 4,6g
Câu 6: Biết rằng etyl axetat có thể hòa tan trong benzene. Lắc một hỗn hợp gồm
etyl axetat, benzene với dung dịch NaOH (dư), đun nhẹ, để yên sau một thời gian,
dung dịch chia làm 2 lớp. Giả sử các phản ứng xảy ra hoàn toàn. Lớp trên sẽ chứa
A. benzen
B. benzene, etyl axetat
C. nước, NaOH
D. natri axetat, rượu etylic

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 7: Có 2 hợp chất X và Y, cùng có C, H, O và khối lượng mol phân tử 60.
Dung dịch chưa chất Y làm quỳ hóa đỏ. X, Y tác dụng được với Na, phân tử chất
Y ít hơn phân tử chất X một nguyên tử C.
Công thức của X và Y (H=1, C=12, O=16) là
A. C
3
H
7
– OH và CH
3
– COOH
B. CH
3
– O – C
2
H
5
và CH
3
– COOH
C. C
3
H
7
– OH và CH
3
– O – CHO
D. CH
3
– O – C
2
H
5
và CH
3
– O – CHO
Câu 8: Dầu mỡ dùng làm thực phẩm và dầu mỡ dùng để bôi trơn xe, máy khác
nhau do
A. thành phần phân tử khác nhau
B. khả năng tác dụng với NaOH khác nhau
C. sự hòa tan trong nước khác nhau
D. phamk vi sử dụng khác nhau.
Tìm câu sai.
Câu 9: Để tẩy sạch các vết dầu mỡ hay chất béo dính vào vải sợi người ta dùng
chất nào trong các chất sau?
A. Nước Gia-ven
B. Giấm ăn
C. Rượu etylic
D. Nước
Câu 10: Tơ nilon – 6,6 thuộc loại
A. tơ hóa học
B. tơ nhân tạo

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
C. tơ tổng hợp
D. tơ thiên nhiên
Câu 11: Khi thủy phân hoàn toàn 10g saccarozo, khối lượng fructozo thu được là
(H=1, C=12, O=16)
A. 5,3g
B. 7,9g
C. 9,5g
D. 10,6g
Câu 12: Tinh bột và xenlulozo được tạo thành trong cây xanh nhờ quá trình quang
hợp từ
A. CO
2
, H
2
O, clorophin, ánh sáng
B. C
6
H
12
O
6
, clorophin, ánh sáng
C. Không khí, diệp lục, ánh sáng
D. N
2
, CO
2
, H
2
O, diệp lục, ánh sang
Câu 13: Để trung hòa 14,8g hỗn hợp CH
3
COOH, CH
3
COOC
2
H
5
phải dùng 200ml
dung dịch NaOH 0,5M. Thành phần % theo khối lượng của CH
3
COOC
2
H
5
trong
hỗn hợp đầu là (H=1, C=12, O=16)
A. 40,54%
B. 50%
C. 59,45%
D. 65%
Câu 14: Muốn loại CO
2
khỏi hỗn hợp với C
2
H
2
người ta dùng
A. nước
B. dung dịch brom (dư)

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
C. dung dịch NaOH (dư)
D. dung dịch NaCl (dư)
Câu 15: Các dung dịch axit axetic, rượu etylic, amino axetic và glucozo có cùng
nồng độ. Dung dịch có độ pH bé nhất là
A. dung dịch rượu etylic
B. dung dịch glucozo
C. dung dịch axit axetic
D. dung dịch amino axetic
Câu 16: Đốt cháy hoàn toàn 20ml rượu etylic chưa rõ độ rượu, cho toàn bộ sản
phẩm sinh ra vào nước vôi trong (dư). Lọc lấy kết tủa sấy khô cân nặng 62,6g.
Giả sử các phản ứng xảy ra hoàn toàn (biết: 𝐷
= 0,8 g/ml).
Loại rượu trên có độ rượu là (H=1, C=12, O=16, Ca=40)
A. 95°
B. 96°
C. 80°
D. 90°
Câu 17: Sản phẩm cuối cùng của sự khử Fe
2
O
3
bới CO là
A. Fe
B. FeO
C. Fe
3
O
4
D. Fe
3
C
Câu 18: Một hỗn hợp gồm rượu etylic và axit axetic có khối lượng 10,6g khi tác
dụng hết với Na thu được 2,24 lít H
2
(ở đktc). Nếu đem hỗn hợp đó cùng với

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
H
2
SO
4
đặc, nung nhẹ để thực hiện phản ứng este hóa (hiệu suất phản ứng este hóa
70%). Khối lượng etyl axetat thu được là (H=1, C=12, O=16)
A. 8,8g
B. 6,16g
C. 2,64g
D. 17,6g
Câu 19: Ở điều kiện thích hợp clo phản ứng được với tất cả các chất trong dãy
A. Fe, KOH, H
2
O, H
2
B. H
2
, Ca, Fe
2
O
3
Na
2
O
C. H
2
, CaO, CuO, Fe
2
O
3
D. HCl, Na
2
O, CuO, Al
2
O
3
Câu 20: Thể tích dung dịch H
2
SO
4
0,5M cần dùng để trung hòa 20ml dung dịch
NaOH 1M là
A. 20ml
B. 30ml
C. 25ml
D. 10ml
ĐÁP ÁN VÀ LỜI GIẢI CÁC BÀI KIỂM TRA HỌC KÌ II
Bài 53:
Câu 1 (3 điểm):
Trong một chu kì theo chiều tăng của điện tích hạt nhân, tính phi kim của các
nguyên tố tăng dần.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Trong một nhóm theo chiều tăng của điện tích hạt nhân, tính phi kim của các
nguyên tố giảm dần.
Câu 2 (3 điểm): 𝑚
=
,
= 2,4 gam; 𝑚
=
,
= 0,6 gam
m
C
+ m
H
bé hơn khối lượng chất chất hữu cơ đem phân tích vậy sản phẩm tạo ra có
oxi.
Kết luận chất hữu cơ Y có các nguyên tố cacbon, hidro và oxi.
Câu 3 (4 điểm): Tỉ lệ số mol CO
2
và H
2
O là 2: 1 => n
C
: n
H
= 1: 1.
a) Công thức đơn giản nhất của X là CH.
b) Công thức phân tử của Y là (CH)
n
M = 13n = 78. Suy ra n = 6. Công thức phân tử là C
6
H
6
Bài 54:
Câu 1 (3 điểm): CaCO
3
°
→ CaO + CO
2
CaO + SiO
2
°
→ CaSiO
3
Câu 2 (3 điểm): Cấu tạo phân tử Z: CH
3
CH
3
– C – CH
3
CH
3
chỉ có liên kết đơn nên chất Z có tính chất gần giống CH
4
.
C
5
H
12
+ Cl
2
á á
⎯
⎯
⎯
⎯
⎯
C
5
H
11
Cl + HCl
Câu 3 (4 điểm): CH
4
+ 2O
2
CO
2
+ 2H
2
O
𝑛
: 𝑛
theo phương trình bằng 1: 2, theo đề bài bằng 1: 3 nên oxi dư.
Sản phẩm sau khi đốt cháy hoàn toàn hỗn hợp: CO
2
, H
2
O, O
2
.
Bài 55:
Câu 1 (4 điểm): Công thức cấu tạo của C
4
H
10
:

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
CH
3
– CH
2
– CH
2
– CH
3
và CH
3
– CH(CH
3
) – CH
3
Công thức cấu tạo của C
4
H
8
:
CH
2
= CH – CH
2
– CH
3
, CH
3
– CH = CH – CH
3
, CH
2
= C(CH
3
)– CH
3
Câu 2 (3 điểm): Đốt chất hữu cơ A (C, H, O) bằng O
2
dư CO
2
, H
2
O (hơi) và O
2
.
Qua dung dịch Ca(OH)
2
hơi H
2
O ngưng tụ còn CO
2
tạo muối cacbonat, khí O
2
không tan trong nước và không tác dụng với nước nên thoát ra khỏi bình.
Vậy khối lượng bình tăng chính là khối lượng của CO
2
và H
2
O.
𝑚
+ 𝑚
= 𝑚
Câu 3 (3 điểm): Trong phân tử CH
2
=CH–CH
3
, HC≡C–CH
3
có cấu tạo giống etilen
và axetilen nên tác dụng với dung dịch brom tạo ra các sản phẩm không màu. Còn
C
2
H
6
phân tử chỉ có liên kết đơn như CH
4
nên không tác dụng với dung dịch brom.
Bài 56:
Câu 1 (3 điểm): Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO
2
, H
2
CO
3
, các
muối cacbonat kim loại…).
Có 2 loại chính: hidrocacbon và dẫn xuất của hidrocacbon.
Câu 2 (3 điểm): Tách
a) CH
4
ra khỏi hỗn hợp với C
2
H
2
: Cho hỗn hợp qua dung dịch brom dư.
C
2
H
2
bị giữ lại do phản ứng: 2Br
2
+ C
2
H
2
C
2
H
2
Br
4
CH
4
không tác dụng với dung dịch Br
2
tách ra khỏi hỗn hợp.
b) C
2
H
4
ra khỏi hỗn hợp với CO
2
: Cho hỗn hợp qua dung dịch nước vôi.
CO
2
bị giữ lại do phản ứng: CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O
Câu 3 (4 điểm): m
C
=
,
= 7,2 gam; m
H
=
,
= 0,6 gam.
m
O
= 7,8 – (7,2 + 0,6) = 0 => n
C
: n
H
=
,
: 0,6 = 1 : 1
Công thức đơn giản nhất là CH
Công thức phân tử: (CH)
n
=> M = 13n = 2,69 x 19 = 78
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
=> n = 6 => CTPT = C
6
H
6
.
Bài 57:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
D A B C A D C B
2. Lời giải:
Câu 1: (D) Giấy là xenlulozo, gạo là tinh bột đều có công thức (C
6
H
10
O
5
)
n
Than chì là một đơn chất. NaHCO
3
là chất vô cơ.
Câu 2: (A) Hợp chất hữu cơ gồm 2 loại chính là hidrocacbon và dẫn xuất của
hidrocacbon.
Câu 3: (B) Hóa học hữu cơ là ngành học chuyên nghiên cứu về các hợp chất hữu
cơ.
Câu 4: (C) Cứ 1 mol (46gam) C
2
H
6
O có 2 mol nguyên tử C (24gam).
Thành phần % theo khối lượng của cacbon =
x 100% = 52,17%
Câu 5: (A)
Câu 6: (D) Hóa trị của cacbon trong hợp chất hữu cơ luôn bằng 4.
Câu 7: (C) C
2
H
4
, C
2
H
2
tác dụng được với dung dịch brom và không thoát ra khỏi
dung dịch.
Câu 8: (B) Thành phần theo khối lượng C, H ứng với công thức phân tử của C
x
H
y
là: C% =
x100 => 𝑥 =
%
=
,
= 6
y =
%
=
,
= 6 => CTPT C
x
H
y
là: C
6
H
6
Bài 58:
1. Đáp án:

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 1 2 3 4 5 6 7 8
Đáp án
C C B A D A C A
2. Lời giải:
Câu 1: (C) Các chất: NaHCO
3
, CO
2
, NaCN không thuộc chất hữu cơ.
Câu 2: (C) Thành phần hợp chất hữu cơ nhất thiết phải có cacbon.
Câu 3: (B) Thành phần của phân tử, và trật tự liên kết của các nguyên tử trong
phân tử.
Câu 4: (A) M =
,
=
,,
= 88.
Câu 5: (D) Căn cứ vào hóa trị của C và H thì công thức cấu tạo CH
3
– CH =O,
CH
2
O đều có cùng công thức phân tử C
2
H
4
O.
CH
2
Câu 6: (A) 𝑚
= 8,533 x 0,75 = 6,4 gam => 𝑛
=
,
= 0,1 mol
CaC
2
+ 2H
2
O Ca(OH)
2
+ C
2
H
2
Suy ra số mol C
2
H
2
= 0,1 mol. Thể tich C
2
H
2
= 0,2 x 22,4 = 2,24 lít (đktc)
Câu 7: (C) C
x
H
y
+ (x +
)O
2
xCO
2
+
H
2
O
Tỉ lệ theo thể tích bằng tỷ lệ theo số mol. Suy ra: x =
= 1
Vậy công thức phân tử của A là: CH
4
Câu 8: (A) CH
3
– CH
2
– CH
2
– CH
3
và CH
3
– CH – CH
3
CH
3
Bài 59:
1. Đáp án:
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 1 2 3 4 5 6 7 8
Đáp án
D B D B A D C A
2. Lời giải:
Câu 1: (D) NaHCO
3
(2), KCN (3), CaC
2
(6) không phải là chất hữu cơ.
Câu 2: (B) Trong 1 mol C
2
H
4
cứ có 24 g C thì có 4g H
Với 6 g C thì m
H
=
= 1 (gam).
Câu 3: (D) CH
3
– CH
2
– CH
2
– OH, CH
3
– O – CH
2
– CH
3
đều có cùng công thức
phân tử C
3
H
8
O.
Câu 4: (B) Do sản phẩm phản ứng là C
2
H
4
Br
2
không màu, tan trong dung dịch nên
không có chất khí được tạo thành.
Câu 5: (A) 2C
2
H
2
+ 5O
2
4CO
2
+ 2H
2
O
𝑛
=
,
= 0,1 mol =>𝑛
= 0,2 mol =>𝑚
= 8,8 g
𝑛
= 0,1 mol =>𝑚
= 1,8 g
Câu 6: (D) C
2
H
4
làm phai màu dung dịch brom, CO
2
tạo kết tủa với dung dịch
nước vôi trong.
Câu 7: (C) C
n
H
2n-2
+
O
2
nCO
2
+ (n-1)H
2
O
=
> 1
Câu 8: (A) 𝑛
=
,
= 0,1 mol, 𝑛
=
,
= 0,1 mol.
=> m
C
= 1,2 gam, m
H
= 0,2 gam => m
O
= 3 – (1,2 + 0,2) = 1,6 gam
=> nC: nH: nO = 1: 2: 1. Công thức đơn giản nhất là CH
2
O.
Công thức phân tử: (CH
2
O)
n
=> M = 30n = 60 => n = 2.
Công thức phân tử là C
2
H
4
O
2
.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Bài 60:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
A A A B A B C D
2. Lời giải:
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A) SO
2
+ Ca(OH)
2
CaSO
3
↓ + H
2
O
C
2
H
4
không tác dụng với dung dịch Ca(OH)
2
.
Câu 2: (A) C
2
H
4
+ H
2
,°
⎯
C
2
H
6
Cứ 2 thể tích chất tham gia phản ứng tạo ra 1 thể tích sản phẩm.
=> Sau phản ứng có sự giảm thể tích hỗn hợp khí.
Câu 3: (A) CaC
2
+ 2H
2
O Ca(OH)
2
+ C
2
H
2
Câu 4: (B) Đất đèn có thành phần chính là canxi cacbua (CaC
2
)
Câu 5: (A) Trong 18 gam nước thì có 2 gam H
=> m
H
trong 5,4 gam nước =
,
= 0,6 gam.
Câu 6: (B) Đốt chất hữu cơ A (C, H, O) CO
2
, H
2
O (hơi)
3H
2
O (hơi) + P
2
O
5
2H
3
PO
4
=> khối lượng bình tăng bằng khối lượng hơi H
2
O
CO
2
+ Ca(OH)
2
CaCO
3
↓ + H
2
O =>𝑛
= 𝑛
=
= 1 mol
Khối lượng CO
2
= 44 g.
Câu 7: (C) CO
2
và C
2
H
4
đều không tác dụng với dung dịch NaCl.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 8: (D) Các nguyên tử H của CH
4
lần lượt được thay thế bởi các nguyên tử Cl.
Bài 61:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
B A B A A B D C
2. Lời giải:
II. TRẮC NGHIỆM KHÁCH QUAN (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (B) 𝑑
/
= 22 => M = 2 x 22 = 44.
Gọi công thức phân tử chất hữu cơ X là: C
x
H
y
=> 12x + y = 44
x, y nguyên, dương. Nghiệm thích hợp là C
4
H
8
.
Câu 2: (A) (II), (III) đều có công thức phân tử C
4
H
8
.
Câu 3: (B) m = m
C
+ m
H
=
,
,
+
,
= 2,3 gam.
Câu 4: (A) Khi tác dụng với nước (ẩm), khí HCl tạo ra dung dịch axit nên làm quỳ
tím hóa đỏ.
Khí clo khi ẩm có tính tẩy màu, nên bằng cách nào đó người ta loại khí clo còn, chỉ
kiểm tra sản phẩm phản ứng (khí HCl).
Câu 5: (A)
Câu 6: (B) 𝑑
/
= 13 => M = 2 x 13 = 26
m
C
=
,
= 2,4 gam; m
H
=
,
= 0,2 gam
=> m
O
= 2,6 – (2,4 + 0,2) = 0
n
C
: n
H
=
,
:
,
= 1 : 1. Công thức đơn giản nhất: CH
Công thức phân tử (CH)
n
=> M = (12+1)n = 26 => n=2
X là C
2
H
2
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 7: (D) 2C
2
H
2
+ 5O
2
4CO
2
+ 2H
2
O
𝑛
= 2,6: 26 = 0,1 mol =>𝑛
= 0,25 mol
Thể tích không khí: 0,25 x 22,4 x
= 28 lít (đktc)
Câu 8: (C) CH
3
– CH
3
tương tự CH
4
có phản ứng thế với brom khi có ánh sáng và
brom ở thể khí tương tự với khí clo.
Beznen (C
6
H
6
) khi có Fe làm xúc tác brom sẽ thế nguyên tử H của benzene tương
tự như clo.
II. TỰ LUẬN (6 điểm)
Câu 9 (2,5 điểm): Etilen và axetilen có tính chất hóa học gần giống nhau:
- Cùng có phản ứng cộng với dung dịch brom. Viết 2 phương trình hóa học
- Cùng có phản ứng cháy khi đốt cho sản phẩm là CO
2
và H
2
O
Viết 2 phương trình hóa học.
Etilen và axetilen có tính chất hóa học khác nhau:
- Etilen có phản ứng trùng hợp tạo polietilen.
Câu 10 (1,5 điểm): CaC
2
+ 2H
2
O Ca(OH)
2
+ C
2
H
2
𝑚
=
()
= 6,4 gam.
=>𝑛
= 6,4 : 64 = 0,1 mol =>𝑛
= 0,1 mol
Thể tích khí C
2
H
2
(đktc) tạo ra = 0,1 x 22,4 = 2,24 lít
Câu 11 (2 điểm): C
2
H
2
+ 2Br
2
C
2
H
2
Br
4
C
2
H
4
+ Br
2
C
2
H
2
Br
2
Gọi x, y lần lượt là số mol của C
2
H
2
và C
2
H
4
trong 5,6 lít hỗn hợp.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Ta có: x + y =
,
,
= 0,25
Dung dịch Br
2
nặng thêm = khối lượng C
2
H
2
+ khối lượng C
2
H
4
= 26x + 28y = 6,8
Giải ra ta có: x = 0,1 mol, y = 0,15 mol
Vậy: Thể tích C
2
H
2
(đktc) = 0,1 x 22,4 = 2,24 lít
Thể tích C
2
H
4
(đktc) = 0,15 x 22,4 = 3,36 lít
Bài 62:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
A A B D A B D A
2. Lời giải:
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A) Do phân tử metan chỉ có liên kết đơn, còn phân tử etilen ngoài liên kết
đơn, còn có liên kết đôi kém bền nên dễ tham gia phản ứng cộng.
Câu 2: (A) Số lượng nguyên tử của các nguyên tố ít ảnh hưởng đến tính chất hóa
học (đều là các hidrocacbon).
Câu 3: (B) Dùng dung dịch Ca(OH)
2
nhận biết được CO
2
, nhưng với O
2
không
phân biệt được CH
4
, H
2
.
Câu 4: (D) Với tỉ lệ 2: 1 về thể tích ta có phương trình:
CH
4
+ Cl
2
á á
⎯
⎯
⎯
⎯
⎯
CH
3
Cl + HCl
Câu 5: (A) Hai công thức cấu tạo của C
2
H
7
N là CH
3
–CH
2
–NH
2
và CH
3
–NH–CH
3
.
C
3
H
6
chỉ có 1 công thức cấu tạo mạch hở: CH
2
= CH – CH
3
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 6: (B) m
C
=
,
= 0,84 gam, m
H
=
,
= 0,07 gam
=> m
X
= 0,91 gam
n
X
= 0,035 mol. Vậy khối lượng phân tử M
X
= 26 đó là C
2
H
2
Câu 7: (D) Dung dịch brom không phản ứng với các chất trong phân tử chỉ có liên
kết đơn, mạch hở hay benzene C
6
H
6
.
Câu 8: (A) C
x
H
y
+ (x +
)O
2
xCO
2
+
H
2
O
Ta có:
=
,
=
,
=> x = 2, y = 6. Công thức phân tử của Y: C
2
H
6
II. TỰ LUẬN (6 điểm)
Câu 9 (2 điểm): CH
3
– CH
2
– CH
2
– NH
2
; CH
3
– CH
2
– NH – CH
3
CH
3
– CH – NH
2
; CH
3
– N – CH
3
CH
3
CH
3
Câu 10 (2 điểm): C
2
H
2
+ 2Br
2
C
2
H
2
Br
4
𝑚
= 3,9 =>𝑛
=
,
= 0,15 mol
𝑛
=
,
,
− 0,15 = 0,05 mol
2C
2
H
2
+ 5O
2
4CO
2
+ 2H
2
O
CH
4
+ 2O
2
CO
2
+ H
2
O
𝑛
= 0,15 x 2,5 + 0,05 x 2 = 0,375 + 0,1 = 0,475 mol
𝑉
= 0,475 x 22,4 = 10,64 lít
Câu 11 (2 điểm): Thành phần % theo khối lượng của C là:
100 – (70,3 + 5,94) = 23,76

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
n
C
: n
H
: n
Cl
= 1,98 : 5,94 : 1,98 = 1: 3: 1
Công thức đơn giản nhất CH
3
Cl
Công thức phân tử (CH
3
Cl)
n
Mặt khác M = 5,05 : 0,1 = 50,5
Mà M = (12 + 3 + 35,5)n => n = 1 => Z là CH
3
Cl
H
Công thức cấu tạo của Z: H – C – H
H
Bài 63:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
B C D B A C B D
2. Lời giải:
Câu 1: (B) CH
4
+ 2O
2
CO
2
+ H
2
O
CO
2
+ Ca(OH)
2
CaCO
3
↓ + H
2
O
Câu 2: (C) Công thức cấu tạo của etilen và axetilen: CH
2
= CH
2
, CH≡CH.
Câu 3: (D) Bảo toàn nguyên tố ở 2 vế của phương trình a = 1 => Z là CH
4
.
Câu 4: (B) Phương trình:
C
6
H
6
(l) + Br
2
(l)
C
6
H
5
Br (l)+ HBr (khí không màu)
Câu 5: (A) Phương trình phản ứng đốt cháy C
2
H
4
: C
2
H
4
+ 3O
2
2CO
2
+ 2H
2
O
- Khi đốt với tỉ lệ thể tích O
2
ít hơn 3 lần thể tích C
2
H
4
thì C
2
H
4
còn.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Sau đó khi tác dụng với dung dịch brom làm màu nâu dung dịch Br
2
nhạt dần.
C
2
H
4
+ Br
2
C
2
H
4
Br
2
- Khối lượng bình không đổi.
- Nhiệt độ trong bình tăng do phản ứng tỏa nhiệt.
- Khối lượng dung dịch brom không giảm đi.
Câu 6: (C) Công thức chung của một hidrocacbon mạch hở, có một liên kết ba là
C
n
H
2n-2
.
C
n
H
2n-2
+ 2Br
2
C
n
H
2n-2
Br
4
𝑛
=
,
= 0,2 mol => M =
,
,
= 26
Công thức phân tử của X: C
2
H
2
Công thức cấu tạo thu gọn của X là: HC≡CH
Câu 7: (B)
Câu 8: (D) Hỗn hợp atilen và metan khi cho qua dung dịch brom chỉ có etilen tác
dụng theo phương trình: C
2
H
4
+ Br
2
C
2
H
4
Br
2
Khí bay ra là metan có thể tích 5,6 lít.
Khối lượng etilen = 5,6 gam hay n
etilen
=
,
= 0,2 mol
Thể tích etilen = 0,2 x 22,4 = 4,48 lít (đktc)
Vậy thành phần % theo thể tích của etilen:
,
,,
x 100% = 44,44%.
II. TỰ LUẬN (6 điểm)
Câu 9 (1,5 điểm): Mạch cacbon: Những nguyên tử cacbon trong phân tử chất hữu
cơ có thể liên kết trực tiếp với nhau tạo thành mạch cacbon.
Ví dụ: - Mạch thẳng: CH
3
– CH
2
– CH
2
– CH
3
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
- Mạch nhánh: CH
3
– CH – CH
3
CH
3
- Mạch vòng: CH
2
– CH
2
CH
2
– CH
2
Câu 10 (1,5 điểm):
a) Công thức cấu tạo của butan: CH
3
– CH
2
– CH
2
– CH
3
b) Phương trình phản ứng đốt cháy butan:
C
4
H
10
+
O
2
4CO
2
+ 5H
2
O
c) Phương trình phản ứng thế với clo
C
4
H
10
+ Cl
2
á á
⎯
⎯
⎯
⎯
⎯
C
4
H
9
Cl + HCl
Câu 11 (3 điểm): a) Thành phần % khối lượng các nguyên tố:
Độ tăng khối lượng bình (1) bằng khối lượng H
2
O = 7,2 gam
=> m
H
=
,
= 0,8 gam
Thành phần % khối lượng H =
,
x 100% = 25%
CO
2
+ Ca(OH)
2
CaCO
3
↓ + H
2
O
𝑛
= 𝑛
=
= 0,2 mol
=> m
C
= 0,2 x 12 = 2,4 gam
Thành phần % khối lượng C =
,
,
x 100% = 75%
b) Công thức phân tử: Chất A chỉ có 2 nguyên tố C, H.
n
C
: n
H
= 0,2 : 0,8 = 1: 4
=> Công thức đơn giản nhất: CH
4

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Mặt khác khối lượng phân tử = 0,5517 x 29 ≈ 16
M = (12+4)n = 16 => n = 1
Vậy công thức phân tử cúa A: CH
4
.
Bài 64:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
A A B C A A A C
2. Lời giải:
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm: mỗi câu 0,5 điểm):
Câu 1: (A) Khí etilen không tác dụng với các dung dịch Ca(OH)
2
, NaOH, NaCl,
Na
2
CO
3
.
Khí SO
2
tạo kết tủa với dung dịch Ca(OH)
2
, có phản ứng với dung dịch NaOH
nhưng không có hiện tượng gì.
SO
2
+ Ca(OH)
2
CaSO
3
↓ + H
2
O
Câu 2: (A) Để biết phản ứng đã xảy ra, người ta kiểm tra sự có mặt sản phẩm phản
ứng:
Với: 2CH
4
°
⎯
⎯
⎯
C
2
H
2
+ 3H
2
Sản phẩm phản ứng là C
2
H
2
, H
2
. Chỉ có C
2
H
2
làm mất màu dung dịch Brom.
Câu 3: (B) Số công thức cấu tạo có thể có của phân tử C
3
H
8
O:
CH
3
– CH
2
– CH
2
– OH, CH
3
– CH – CH
3
, CH
3
– CH
2
– O – CH
3
OH
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 4: (C) Dãy các chất CH≡CH, CH≡C – CH
3
, CH≡C – CH
2
– CH
3
,… là những
hợp chất mạch hở, phân tử có một liên kết ba và đều thỏa mã công thức chung
C
n
H
2n-2
(n nguyên dương ≥ 2).
Câu 5: (A) Thành phần % khối lượng của O = 100 – (52,17 + 13,04) = 34,79%
n
C
: n
H
: n
O
=
,
: 13,04:
,
= 4,35: 13,04: 2,17 = 2: 6: 1
=> Công thức đơn giản nhất là C
2
H
6
O.
M = (2x12+6+16)n = 46 => n =1
Vậy công thức phân tử: C
2
H
6
O
Câu 6: (A) Dung dịch KOH dư hấp thụ hết khí CO
2
, SO
2
, H
2
SO
4
đặc giữ hết hơi
H
2
O. Dùng dung dịch KOH sau sẽ không giữ hết hơi H
2
O.
Câu 7: (A) CH
4
+ 2O
2
CO
2
+ 2H
2
O
2C
2
H
2
+ 5O
2
4CO
2
+ 2H
2
O
CO
2
+ Ca(OH)
2
CaCO
3
↓ + H
2
O
Gọi x, y lần lượt là số mol của CH
4
, C
2
H
4
x + y =
,
,
= 0,25
Số mol CO
2
= x + 2y = 0,4 => x = 0,1 mol; y = 0,15 mol
Thành phần % theo thể tích của axetilen:
,
,
x 100% = 60%.
Câu 8: (C) CaC
2
+ 2H
2
O C
2
H
2
+ Ca(OH)
2
II. TỰ LUẬN (6 điểm)
Câu 9 (2,5 điểm):
a) Phản ứng thế của benzen: C
6
H
6
+ Br
2
,°
⎯
C
6
H
5
Br+ HBr

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Phản ứng cộng của benzen: C
6
H
6
+ 3H
2
,°
⎯
C
6
H
12
b) Đốt cháy hợp chất C
n
H
2n+2
:
C
n
H
2n+2
+
O
2
°
→ nCO
2
+ (n+1)H
2
O (n ≥ 1)
Số mol H
2
O luôn luôn lớn hơn số mol CO
2
Câu 10 (1,5 điểm): nCH
2
=CH
2
ú á,á ấ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
( CH
2
– CH
2
)
n
Khối lượng etilen phải dùng =
= 1250 gam.
Số mol etilen =
= 44,64 mol
Thể tích etilen (đktc) =
,
= 1000 (lít).
Câu 11 (2 điểm): CH
4
+ xCl
2
ế á
⎯
⎯
⎯
⎯
⎯
⎯
CH
4 – x
Cl
x
+ xHCl
Thành phần % khối lượng của cacbon =
,
x 100% = 15,12%
225,92 + 487,14x = 1200 => 487,14x = 1200 – 225,92 = 974,08
Suy ra: x = 2. Công thức phân tử của X là: CH
2
Cl
2
Bài 65:
Câu 1 (3 điểm): Viết các phương trình hóa học:
a) Rượu etylic tác dụng với Na: 2C
2
H
5
OH + 2Na 2C
2
H
5
ONa + H
2
b) Đốt cháy rượu etylic trong không khí: C
2
H
5
OH + 3O
2
°
→ 2CO
2
+ 3H
2
O
c) Etilen tác dụng với nước có H
2
SO
4
: C
2
H
4
+ H
2
O
,°
⎯
⎯
⎯
⎯
C
2
H
5
OH
Câu 2 (3 điểm):
a) Rượu etylic có nhiệt độ sôi thấp hơn nước, nên bay hơi trước làm giảm nồng
độ của rượu.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
b) Dùng CuSO
4
khan (màu trắng) tác dụng với nước tạo tinh thể CuSO
4
.5H
2
O
(màu xanh).
Câu 3 (4 điểm): 𝑀
= 1,5862 x 29 = 46 => 14n + 18 = 46 => n = 2
Công thức của X = C
2
H
5
OH
Bài 66:
Câu 1 (4 điểm): Cho hỗn hợp tác dụng với dung dịch NaOH (dư), chưng cất để
ngưng tụ rượu etylic. Bã rắn đã tác dụng với dung dịch H
2
SO
4
(dư) chưng cất ta
được axit axetic.
Phương trình hóa học: CH
3
COOH + NaOH CH
3
COONa + H
2
O
2CH
3
COONa + H
2
SO
4
2CH
3
COOH + Na
2
SO
4
Câu 2(3 điểm): CH
3
COOH + C
2
H
5
OH CH
3
COOC
2
H
5
+ H
2
O
𝑛
= 𝑛
x 0,8 = 0,2 x 0,8 = 0,16 mol
Khối lượng CH
3
COOC
2
H
5
= 0,16 x 88 = 14,08 gam
Câu 3 (3 điểm): C
n
H
2n+1
COOH +
O
2
(n+1)CO
2
+ (n+1)H
2
O
𝑛
= 0,2 =
()
=> n = 1.
Bài 67:
Câu 1 (3 điểm): 2H
2
O + 2Na 2NaOH + H
2
2C
2
H
5
OH + 2Na 2C
2
H
5
ONa + H
2
Câu 2 (3 điểm): Khối lượng rượu etylic = 3000 x 0,06 x 0,8 = 144 gam
C
2
H
5
OH + O
2
ấ
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
– COOH + H
2
O
Khối lượng CH
3
– COOH theo phương trình =
x 60 = 187,82 gam

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Khối lượng CH
3
– COOH thực tế = 182,87 x 0,75 = 140,87 gam
Câu 3 (4 điểm): C
n
H
2n+1
COOH + NaOH C
n
H
2n+1
COONa + H
2
O
𝑛
= 𝑛
= 0,05 mol =>𝑀
=
,
= 60
M = 14n + 46 = 60 => n = 1
Công thức của axit: CH
3
– COOH
Bài 68:
Câu 1 (3 điểm): Phương trình hóa học: C
6
H
6
+ Br
2
,°
⎯
C
6
H
5
Br+ HBr
C
6
H
6
+ 3H
2
,°
⎯
C
6
H
12
Câu 2 (3 điểm): 2CH
3
– COOH + MgCO
3
(CH
3
COO)
2
Mg + CO
2
+ H
2
Suy ra: 𝑛
=
,
= 0,05 mol
Vậy thể tích khí CO
2
= 0,05 x 22,4 = 1,12 lít (đktc).
Câu 3 (4 điểm): Khối lượng bình 1 tăng chính là khối lượng của nước = 3,6 gam.
Khối lượng bình 2 tăng chính là khối lượng của CO
2
= 8,8 gam.
m
H
=
,
= 0,4 gam.
m
C
=
,
= 2,4 gam. Suy ra khối lượng oxi = 6 – 2,8 = 3,2 gam.
=> n
C
: n
H
: n
O
= 0,2 : 0,4 : 0,2 = 1: 2: 1
Công thức đơn giản nhất của (X) CH
2
O
Bài 69:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đáp án
D B D A A B C A
2. Lời giải:
Câu 1: (D) Công thức (1) có liên kết – O – H, Công thức (2) có liên kết C – O – C.
Câu 2: (B)
Câu 3: (D) (1) CH
3
– CH
2
– OH có nhóm – O – H nên tác dụng được với natri.
Câu 4: (A) Độ rượu là số ml rượu etylic có trong 100ml hỗn hợp rượu với nước.
Câu 5: (A) Natri tác dụng với nước mãnh liệt hơn với etanol, natri không tác dụng
với benzen.
Câu 6: (B) CH
3
– CH
2
– CH
2
OH và CH
3
– CHOH – CH
3
.
Câu 7: (C) Do chỉ có tối đa 1 nhóm OH.
Câu 8: (A) CH
3
– CH
2
–OH + 3O
2
2CO
2
+ 3H
2
O
𝑛
=
,
= 0,05 mol. Suy ra số mol O
2
= 0,05 x 3 = 0,15 mol
Vậy thể tích không khí = 0,15 x 22,4 x 5 = 16,8 lít (đktc).
Bài 70:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
D B D A A B A D
2. Lời giải:
Câu 1: (D) Nhóm tạo ra axit –COOH.
Câu 2: (B) CH
3
– COOH; CH
3
– O – CHO; CH
2
OH – CHO.
Câu 3: (D) CH
3
– COOH là chất lỏng, vị chua, tan vô hạn trong nước, không màu.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 4: (A) Khi nung dung dịch axit axetic trong nước thì CH
3
– COOH thoát ra
sau H
2
O nên nồng độ axit axetic tăng lên.
Câu 5: (A) Natri tác dụng với dung dịch rượu 90⁰ và dung dịch axit axetic.
Câu 6: (B) 2CH
3
– COOH + Mg (CH
3
COO)
2
Mg + H
2
𝑛
=
,
= 0,05 mol =>𝑉
= 0,05 x 22,4 = 1,12 lít (đktc).
Câu 7: (A) C
2
H
5
OH tác dụng với CH
3
COOH và Na.
CH
3
COOH tác dụng với NaOH và Na.
Na tác dụng với H
2
O.
Câu 8: (D) CH
3
COOH + NaOH CH
3
COONa + H
2
O
𝑛
= 𝑛
= 0,4 mol => V
dung dịch
NaOH = 0,04 lít hay 40 ml.
Bài 71:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
A D A C B D B D
2. Lời giải:
Câu 1: (A) Vị trí (1) H
2
O trong dung dịch axit. Vị trí (2) O
2
+ men giấm.
Câu 2: (D) (X) có nhóm –COOH.
Câu 3: (A) Hỗn hợp CH
3
COOH, C
2
H
5
OH tác dụng với dung dịch NaOH, chỉ có
tạo muối, khi chưng khô chỉ có C
2
H
5
OH thoát ra, đem rồi chưng cất để thu được
rượu etylic.
Câu 4: (C) Quỳ tím nhận ra được giấm, CuSO
4
khan nhận ra được nước
(CuSO
4
.5H
2
O có màu xanh). Dùng nước để nhận ra dầu ăn và rượu etylic.
Câu 5: (B) P
2
O
5
khan hút nước và không tác dụng với CH
3
COOH.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 6: (D) (RCOO)
3
C
3
H
5
. Là este của C
3
H
5
(OH)
3
với RCOOH.
Câu 7: (B) Khối lượng axit axetic = 100 x 0,05 = 5 gam.
Câu 8: (D) Phương trình: CH
3
COOH + C
2
H
5
OH ⇌CH
3
COOC
2
H
5
+ H
2
O
Phản ứng xảy ra chậm.
Bài 72:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
C D B B A B B D
2. Lời giải:
Câu 1: (C)
Câu 2: (D) Dầu mỡ bôi trơn là một hidrocacbon có nhiều nguyên tử C.
Câu 3: (B) CuSO
4
khan hút nước, không tác dụng với rượu etylic.
Câu 4: (B) Al tác dụng với CH
3
COOH và với dung dịch NaOH.
Na tác dụng với CH
3
COOH, H
2
O, etanol.
Etanol tác dụng với CH
3
COOH.
CH
3
COOH tác dụng với dung dịch NaOH.
Câu 5: (A) Quỳ tím thấm nước cho ta nhận ra axit axetic, nước phân biệt được
benzene, etanol.
Câu 6: (B) Axit axetic tác dụng với CaCO
3
cho muối, chưng cất để thu hồi etyl
axetat.
2CH
3
COOH + CaCO
3
(CH
3
COO)
2
Ca + CO
2
+ H
2
O
Dùng H
2
SO
4
loãng để tái tạo axit axetic

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
(CH
3
COO)
2
Ca + H
2
SO
4
2CH
3
COOH + CaSO
4
Câu 7: (B) C
2
H
4
C
2
H
5
OH CH
3
COOH CH
3
COOC
2
H
5
Câu 8: (D) Trong phân tử X, Y có 3 nguyên tử C. Phân tử chất X có cấu tạo giống
C
2
H
4
, Y là một axit. Đó là CH
2
= CH – CH
3
, CH
3
– CH
2
– COOH.
Bài 73:
Câu 1 (4 điểm):
CaC
2
+ 2H
2
O C
2
H
2
+ Ca(OH)
2
C
2
H
2
+ H
2
,°
⎯
C
2
H
4
C
2
H
4
+ H
2
O
,°
⎯
⎯
⎯
⎯
C
2
H
5
OH
C
2
H
5
OH + O
2
ấ
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOH + H
2
O
C
2
H
5
OH +CH
3
COOH
đặ
CH
3
COOC
2
H
5
+ H
2
O
Viết mỗi phương trình 1 điểm.
Câu 2 (3 điểm): m
C
=
,
,
= 4,8 gam; m
H
=
,
= 1,2 gam
m
O
= 9,2 – 6 = 3,2 gam
n
C
: n
H
: n
O
= 0,4 : 1,2 : 0,2 = 2 : 6 : 1
=> a) Công thức đơn giản nhất: C
2
H
6
O
b) Công thức phân tử: M = 2,054 x 22,4 = 46.
CTPT: C
2
H
6
O.
c) Công thức cấu tạo: CH
3
– CH
2
– OH (rượu etylic) và CH
3
– O – CH
3
Câu 3 (3 điểm): 𝑛
= 0,05 mol; 𝑛
=0,05 mol
CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Khối lượng CH
3
COOC
2
H
5
= 0,05 x 88 = 4,4 gam.
Bài 74:
Câu 1 (3 điểm): a) % theo khối lượng oxi là m
O
= 34,79%
n
C
: n
H
: n
O
= 4,3 : 13,04 : 2,174 = 2 : 6 : 1
Công thức đơn giản nhất: C
2
H
6
O. Công thức phân tử: C
2
H
6
O.
b) Công thức cấu tạo: CH
3
– CH
2
– OH và CH
3
– O – CH
3
câu 2 (3 điểm): Ví dụ metan dùng làm nhiên liệu, etilen dùng sản xuất nhựa PE
(sản xuất một số vật dụng như chai lọ, bao bì,…).
Khi đốt có khí CO
2
tạo ra.
Câu 3 (4 điểm): a) X là hợp chất hữu cơ. Có nguyên tố C, H có thể có O.
b) 𝑚
= 3, gam.
CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O
CaCO
3
°
→ CaO + CO
2
m
CaO
= 11,2 gam =>𝑛
= 𝑛
=
,
= 0,2 mol
% khối lượng cacbon =
,
x 100% = 40%
% khối lượng hidro =
,
x 100% = 6,67%
% khối lượng oxi = 100 – (40+6,67) = 53,33%
Bài 75:
Câu 1 (3 điểm): Tách hỗn hợp gồm rượu etylic và axit axetic:
Cho hỗn hợp tác dụng với NaOH dư
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
CH
3
COOH + NaOH CH
3
COONa + H
2
O
Chưng cất để ngưng tụ hơi rượu. Bã rắn cho tác dụng với dung dịch H
2
SO
4
loãng.
2CH
3
COONa + H
2
SO
4
2CH
3
COOH + Na
2
SO
4
Chưng cất để lấy axit axetic.
(Cách thực hiện 1 điểm, phương trình 2 điểm).
Câu 2 (3 điểm): CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O
Rượu etylic dư, nếu phản ứng hoàn toàn thì số mol este là 0,1 mol.
Hiệu suất phản ứng là =
,
,
x 100% = 50%.
Câu 3 (4 điểm): a) Công thức đơn giản nhất:
m
C
=
,
,
= 7,2 gam; m
H
=
,
= 0,6 gam
m
O
= 7,8 – (7,2 + 0,6) = 0
n
C
: n
H
=
,
: 0,6 = 1 : 1 => Công thức đơn giản nhất: CH
b) Công thức phân tử: M = 3,482 x 22,4 = 78
(CH)
n
M =13n = 78 => n = 6. Ta có: C
6
H
6
.
Bài 76:
Câu 1 (4 điểm): 2K + 2C
2
H
5
OH 2C
2
H
5
OK + H
2
2K + 2CH
3
COOH 2CH
3
COOK + H
2
CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O
2CH
3
COOH + FeO (CH
3
COO)
2
Fe + H
2
O
Câu 2 (3 điểm): 2CH
3
COOH + CaCO
3
(CH
3
COO)
2
Ca + CO
2
+ H
2
O

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
𝑛
= 0,1 mol; 𝑛
= 0,1 x 2 = 0,2 mol
𝑚
= 0,2 x 60 = 12 gam
Thành phần % theo khối lượng của axit axetic =
x 100% = 60%.
CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O
Rượu etylic dư, nếu phản ứng hoàn toàn thì số mol este là 0,1 mol
Hiệu suất phản ứng là =
,
,
x 100% = 75%.
Bài 77:
1. Đáp án: ( mỗi câu 1 điểm)
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
A B A D B C A A D D
2. Lời giải:
Câu 1: (A)
CH
3
– CH
2
– CHO, CH
3
– CO – CH
3
, CH
2
=CH – CH
2
OH, CH
2
=CH – O – CH
3
.
Câu 2: (B) CH
3
COOH có tính axit còn C
2
H
5
OH thì không.
Câu 3: (A) CH
3
COOC
2
H
5
+ NaOH CH
3
COONa + C
2
H
5
OH
Câu 4: (D) Thể tích rượu etylic = 10 x 0,08 + 20 x 0,12 = 3,2 ml.
Thể tích dung dịch = 10 + 20 = 30.
Độ rượu =
,
x 100⁰ = 10,66⁰
Câu 5: (B) CuSO
4
(màu trắng) + 5H
2
O CuSO
4
.5H
2
O
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 6: (C) 2CH
3
COOH + 2Na 2CH
3
COONa + H
2
2C
2
H
5
OH + 2Na 2C
2
H
5
ONa + H
2
Gọi số mol CH
3
COOH và C
2
H
5
OH lần lượt là x, y.
60x + 46y = 10,6 và x + y = 0,2 => x = y = 0,1 mol.
𝑚
= 60 x 0,1 = 6 gam
Câu 7: (A) CH
3
COOH + NaHCO
3
CH
3
COONa + CO
2
+ H
2
O
𝑚
= 6 gam =>𝑚
= 8,4 gam.
Câu 8: (A) 2CH
3
COOH + CaCO
3
(CH
3
COO)
2
Ca + CO
2
+ H
2
O
𝑛
= 0,01; 𝑛
= 0,08 x 0,5 = 0,04 mol.
CH
3
COOH dư =>𝑉
= 0,01 x 22,4 = 0,224 lít = 224 ml.
Câu 9: (D) 2H
2
O + 2Na NaOH + H
2
2C
2
H
5
OH + 2Na 2C
2
H
5
ONa + H
2
Câu 10: (D) Na, quỳ tím, NaHCO
3
không tác dụng với benzene.
Bài 78:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
B A A B D B A A C D
2. Lời giải:
Câu 1: (B)
Câu 2: (A)
Câu 3: (A) 2CH
3
COOH + Na
2
CO
3
2CH
3
COONa + CO
2
+ H
2
O
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
CH
3
COOH + NaOH CH
3
COONa + H
2
O
2CH
3
COOH + Cu(OH)
2
(CH
3
COO)
2
Cu + 2H
2
O
2CH
3
COOH + Fe (CH
3
COO)
2
Fe + H
2
Câu 4: (B) 2CH
3
COOH + MgO (CH
3
COO)
2
Mg + 2H
2
O
𝑛
=
= 0,65 mol => n
MgO
= 0,325 mol.
Khối lượng MgO = 0,325 x 40 = 13 gam.
Câu 5: (D) Thể tích rượu etylic = 10 x 0,1 + V x 0,16
,
x 100 = 13 => 1 + 0,16V = 1,3 + 0,13V => V = 10ml.
Câu 6: (B) Phản ứng: CH
3
COOH + Na
2
CO
3
CH
3
COONa + NaHCO
3
.
Câu 7: (A) Rượu etylic tan trong nước còn etyl axetat ít tan nên dùng cách chiết.
Câu 8: (A) CH
3
– CH
2
– COOH.
Câu 9: (C) 2CH
3
COOH + Fe (CH
3
COO)
2
Fe + H
2
Câu 10: (D) Phương pahps đốt cháy các chất trong không khí:
Benzen khi cháy cho nhiều muội than.
Rượu etylic 90⁰ cháy cho ngọn lửa màu xanh, tỏa nhiều nhiệt.
Nước không cháy.
Bài 79:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
B A A B C D B C D B
2. Lời giải:

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 1: (B) C
2
H
4
+ H
2
O
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
C
2
H
5
OH
CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O
Câu 2: (A) C
3
H
5
(OH)
3
: 3C
17
H
35
COONa
Câu 3: (A) C
n
H
2n+1
COOH +
O
2
°
→ (n+1)CO
2
+ (n+1)H
2
O
Cau 4: (B) Tên các hợp chất sau: CH
2
OH – CHOH – CH
2
OH, CH
3
COOK,
CH
3
– COO – CH
2
– CH
3
lần lượt là: glixerol, kali axetat, etyl axetat.
Câu 5: (C) Khối lượng CH
3
– CH
2
OH = 100 x 0,12 x 0,8 = 96 gam.
Câu 6: (D) 2CH
3
COOH + 2Na 2CH
3
COONa + H
2
2CH
3
– CH
2
OH + 2Na 2CH
3
– CH
2
ONa + H
2
Câu 7: (B) C
2
H
5
OH + 3O
2
°
→ 2CO
2
+ 3H
2
O
Thể tích không khí (đktc) = 0,1 x 3 x 22,4 x 5 = 33,6 lít
Câu 8: (C) C
4
H
10
+ 2O
2
,°
⎯
2CH
3
– COOH
Câu 9: (D) CH
3
– COOH + NaOH CH
3
– COONa + H
2
O
𝑛
= 𝑛
. Suy ra thể tích dung dịch NaOH 1M = 25 ml.
Câu 10: (B) Khi nung khô chỉ thu được các chất rắn: CH
3
COONa, NaCl, NaOH.
Bài 80:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
C C D A D D B A A B
2. Lời giải:

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 1: (C) Các công thức cấu tạo cúa C
3
H
8
O:
CH
3
– CH
2
– CH
2
OH, CH
3
– CHOH – CH
3
, CH
3
– CH
2
– O – CH
3
.
Câu 2: (C) Thể tích khí oxi (đktc): CH
4
O + 2O
2
°
→ CO
2
+ 2H
2
O
𝑛
=
,
= 0,1 mol =>𝑉
= 0,1 x 2 x 22,4 = 4,48 lít
Câu 3: (D) Chỉ có CH
3
– COOH là có nhóm axit –COOH.
Câu 4: (A) Dung dịch rượu etylic 50⁰ tức có nước. Natri tác dụng với nước tạo ra
NaOH làm phenolphthalein có màu hồng. Na tác dụng với rượu và nước tỏa nhiệt
làm Na nóng chảy vo tròn, nhẹ hơn nước nên nổi trên bề mặt dung dịch.
Câu 5: (D) C
2
H
5
OH + 3O
2
°
→ 2CO
2
+ 3H
2
O
CH
3
COOH + 2O
2
°
→ 2CO
2
+ 2H
2
O
Suy ra:
=
.
Câu 6: (D) Quỳ tím, benzene, rượu etylic tạo hỗn hợp đồng nhất và không đổi màu
của quỳ tím.
Câu 7: (B) CH
3
COOH tác dụng với: NaOH, CuO, NaHCO
3
, Mg cho CH
3
COONa,
(CH
3
COO)
2
Cu, (CH
3
COO)
2
Mg, CO
2
, H
2
.
Câu 8: (A) CH
3
COOH không tác dụng với NaCl.
Câu 9: (A) C
n
H
2n+1
COOH +
O
2
°
→ (n+1)CO
2
+ (n+1)H
2
O
Tỉ lệ số mol của CO
2
và H
2
O là 1: 1.
Câu 10: (B) 𝑚
=
= 12 gam
Suy ra số 𝑛
=
= 0,2 mol
2CH
3
COOH + Mg (CH
3
COO)
2
Mg + H
2

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Vậy số mol của H
2
= 0,1 mol.
Thể tích khí H
2
thoát ra (đktc): 0,1 x 22,4 = 2,24 (lít).
Bài 81:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
A D A C B D C B A B
2. Lời giải:
Câu 1: (A) Công thức phân tử của glucozo, saccarozo, axit gluconic, tinh bột lần
lượt là: C
6
H
12
O
6
, C
12
H
22
O
11
, C
6
H
12
O
7
, ( C
6
H
10
O
5
)
n
Câu 2: (D) Phân tử chất X có 6 nguyên tử C phải là C
6
H
12
O
6
.
Câu 3: (A) Glucozo
()
rượu etylic
()
axit axetic.
Điều kiện ở các quá trình (1), (2) lần lượt là: men rượu, men giấm.
Câu 4: (C) Glucozo tác dụng với dung dịch Ag
2
O/NH
3
cho Ag.
Saccarozo không tác dụng với dung dịch Ag
2
O/NH
3
Câu 5: (B) Glucozo lên men cho C
2
H
5
OH và CO
2
có số mol bằng nhau.
𝑛
=
,
= 0,1 mol. Thể tích khí CO
2
thoát ra (đktc) = 2,24 lít.
Câu 6: (D) Những chất có phản ứng thủy phân:
(C
17
H
35
COO)
3
C
3
H
5
, CH
3
– COO – C
2
H
5
Câu 7: (C) Công thức phân tử (CH
2
O)
n
. Khối lượng mol phân tử trong khoảng 175
< 30n < 190 => 5,8 < n < 6,33 => n = 6. CTPT: C
6
H
12
O
6
.
Câu 8: (B) AgNO
3
trong NH
3
nhận ra glucozo. CaCO
3
nhận ra axit axetic.
Câu 9: (A) C
6
H
12
O
6
2C
2
H
5
OH + 2CO
2

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
𝑉
=
,
x 0,4 x 2 x 46 = 4,6 (ml) =>𝑉
(10⁰) = 4,6 x 10 = 46 ml.
Câu 10: (B) Khối lượng dung dịch C
6
H
12
O
6
= 150 gam.
=> Khối lượng C
6
H
12
O
6
= 150 x 0,03 = 4,5 gam.
Bài 82:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
A D C A B B A C B B
2. Lời giải:
Câu 1: (A)
Câu 2: (D) Saccarozo không tác dụng với dung dịch AgNO
3
trong NH
3
.
Glucozo tác dụng với dung dịch AgNO
3
trong NH
3
cho Ag.
Câu 3: (C) Glucozo, fructozo, saccarozo (còn), H
2
SO
4
(xúc tác).
Câu 4: (A) C
12
H
22
O
11
()
C
6
H
12
O
6
()
C
2
H
5
OH.
H
2
O và axit nung nóng (1); man rượu (2).
Câu 5: (B) C
12
H
22
O
11
()
C
6
H
12
O
6
()
C
2
H
5
OH
()
CH
3
COOH
()
CH
3
COOC
2
H
5
Câu 6: (B) Khối lượng saccarozo = 100 x 0,12 x 0,85 = 10,2 kg.
Câu 7: (A) C
12
H
22
O
11
,đặ
⎯
⎯
⎯
⎯
⎯
11H
2
O + 12C (làm hỗn hợp có màu đen)
Câu 8: (C) Dung dịch axit có độ pH bé nhất.
Câu 9: (B) 1 mol C
4
H
10
cho 2 mol CH
3
COOH, 1 mol C
2
H
4
cho 1 mol CH
3
COOH.
Câu 10: (B) C
6
H
12
O
6
2C
2
H
5
OH + 2CO
2
CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
𝑛
= 𝑛
= 0,25 mol. Suy ra 𝑛
=
,
x 100 = 0,179 mol.
𝑚
= 0,179 x 180 = 32,14 gam.
Bài 83:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
A C D A D A A A B B
2. Lời giải:
Câu 1: (A). Tinh bột và xenlulozo có đặc điểm: cùng có công thức phân tử
( C
6
H
10
O
5
)
n
Câu 2: (C) Nhóm –C
6
H
10
O
5
– là mắt xích của phân tử (C
6
H
10
O
5
)
n
Câu 3: (D) Axit aminoaxetic.
Câu 4: (A) (1) Sai: tinh bột, xenlulozo, protein bị thủy phân không cho cùng một
sán phẩm.
Câu 5: (D) Polime là những chất có phân tử khối rất lớn do nhiều mắt xích liên kết
với nhau tạo nên.
Câu 6: (A) Tinh bột nhận biết nhờ iot. Chất tan trong nước là saccarozo. Chất
không tan trong nước là xenlulozo.
Câu 7: (A) 194400 < 162n < 972000 => 1200 < n < 6000
Câu 8: (A) Thành phần nguyên tố chủ yếu trong protein: C, H, O, N.
Câu 9: (B) (C
6
H
10
O
5
)
n
+ 6nO
2
°
→ 6nCO
2
+ 5nH
2
O.
Tổng hệ số cân bằng phương trình là: 17n + 1.
Câu 10: (B) H
2
N – C
n
H
2n
– COOH + NaOH H
2
N – C
n
H
2n
– COONa + H
2
O
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
n
X
= n
NaOH
= 0,2 mol => M
X
=
,
= 75 = 16 + 14n + 45 => n = 1.
Công thức của X: H
2
N – CH
2
– COOH.
Bài 84:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
C D A D B B A A D A
2. Lời giải:
Câu 1: (C) Phân tử polietilen được biểu diễn như sau: ( CH
2
– CH )
n
CH
3
Câu 2: (D) (2), (3) sai.
Câu 3: (A) 4H
2
N – CH
2
– COOH + 9O
2
°
→ 8CO
2
+ 10H
2
O + 2N
2
Câu 4: (D) ( C
6
H
10
O
5
)
n
+ nH
2
O
⎯
nC
6
H
12
O
6
Câu 5: (B) Thể tích O
2
thoát ra (đktc) =
,
x 6 x 22,4 = 13,44 lít.
Câu 6: (B) Các polime mạch thẳng: xenlulozo, polietilen, poli(vinyl clorua).
Câu 7: (A) Da thật là các protein, da giả là các chất dẻo, ví dụ: PVC,… Đem đốt
cháy protein có mùi khét như tóc cháy.
Câu 8: (A) C
6
H
12
O
6
ượ
⎯
⎯
⎯
⎯
⎯
⎯
2C
2
H
5
OH + 2CO
2
CO
2
+ 2NaOH Na
2
CO
3
+ H
2
O
𝑚
= 600 x 0,96 x 0,8kg = 460,8 (kg) =>𝑚
= 440,765 kg
Suy ra khối lượng Na
2
CO
3
=
,
x 106 = 1061,84 (kg).

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 9: (D) Có các chất hữu có có nhóm: -COOH. Tác dụng được với C
2
H
5
OH
trong môi trường axit.
Câu 10: (A) m
H
= 0,1 gam, m
C
=
,
,
x 12= 0,48 gam, m
N
= 0,28 gam
m
O
= 1,5 – (0,1 + 0,48 + 0,28) = 0,64 gam
n
C
: n
H
: n
N
: n
O
= 0,04 : 0,1 : 0,02 : 0,04 = 2 : 5 : 1 : 2
Công thức đơn giản nhất cúa X: C
2
H
5
NO
2
.
Bài 85:
Câu 1 (1,5 điểm): Từ saccarozo: C
12
H
22
O
11
+ H
2
O
,°
⎯
⎯
⎯
⎯
2C
6
H
12
O
6
Từ tinh bột: (C
6
H
10
O
5
)
n
+ nH
2
O
,°
⎯
⎯
⎯
⎯
nC
6
H
12
O
6
Từ xenlulozo: (C
6
H
10
O
5
)
n
+ nH
2
O
,°
⎯
⎯
⎯
⎯
nC
6
H
12
O
6
Câu 2 (1,5 điểm): Dung dịch AgNO
3
trong NH
3
Ag
2
O + C
6
H
12
O
6
⎯
C
6
H
12
O
7
+ 2Ag
Câu 3 (2 điểm): 2CH
4
+ 2O
2
°
→ CO
2
+ 2H
2
O
C
2
H
4
+ 3O
2
°
→ 2CO
2
+ 2H
2
O
C
3
H
4
+ 4O
2
°
→ 3CO
2
+ 2H
2
O
C
4
H
4
+ 5O
2
°
→ 4CO
2
+ 2H
2
O
Tỉ lệ thể tích oxi cần dùng lần lượt: 2:3:4:5.
Câu 4 (2,5 điểm): (RCOO)
3
C
3
H
5
+ 3NaOH
°
→ C
3
H
5
(OH)
3
+ 3RCOONa
Khối lượng C
3
H
5
(OH)
3
=
x 92 = 99,67 gam.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Dùng định luật bảo toàn khối lượng:
Khối lượng chất béo + khối lượng NaOH = Khối lượng C
3
H
5
(OH)
3
+ khối lượng
muối của axit hữu cơ.
=> Khối lượng muối = 964,2 + 130 – 99,67 = 994,5 gam.
Câu 5 (2,5 điểm): Fe + CuSO
4
Cu + FeSO
4
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi
dung dịch. Thành Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng
bằng khối lượng thành Fe tăng lên.
Bài 86: (Mỗi câu 2 điểm)
Câu 1: 𝑛
ban đầu = 0,01 mol.
n
Ag
tạo ra =
,
= 0,008 mol
Hiệu suất phản ứng =
,
,
x 100% = 80%.
Câu 2: Viết phương trình hóa học:
H
2
N – CH
2
– COOH + NaOH H
2
N – CH
2
– COONa + H
2
O
H
2
N – CH
2
– COOH + C
2
H
5
OH
,°
⎯
H
2
N – CH
2
– COOC
2
H
5
+ H
2
O
Câu 3: HO – CH
2
– COOH + 2Na NaO – CH
2
– COONa + H
2
2H
2
N – CH
2
– COOH + 2Na 2H
2
N – CH
2
– COONa + H
2
Câu 4: Chỉ có 6 sai (S).
Câu 5: Khối lượng axit axetic = 50 x 1,03 = 51,5 gam
Khối lượng nước = 50 gam
Nồng độ % của axit axetic =
,
,
x 100% = 50,74%.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Bài 87: (Mỗi câu 2 điểm)
Câu 1: SO
2
+ NaOH NaHSO
3
SO
2
+ 2NaOH Na
2
SO
3
+ H
2
O
Câu 2: CH
3
– COOH + NaOH CH
3
– COONa + H
2
O
n
NaOH
= 0,06 x 0,75 = 0,045 mol = 𝑛
Thể tích dung dịch CH
3
– COOH cần dùng =
,
,
= 0,036 (lít) hay 36ml.
Câu 3: 2Al + 3CuSO
4
(dd màu xanh) 3Cu + Al
2
(SO
4
)
3
- Dây nhôm nhuốm màu đỏ.
- Màu xanh của dung dịch phai dần.
Câu 4: C
6
H
12
O
6
+ Ag
2
O
⎯
C
6
H
12
O
7
+ 2 Ag
n
Ag
= 2 x 0,1 x 0,1 = 0,02 mol => m
Ag
= 0,02 x 108 = 2,16 gam
Câu 5: C
2
H
5
OH + 3O
2
°
→ 2CO
2
+ 3H
2
O
CH
3
– COOH + 2O
2
°
→ 2CO
2
+ 2H
2
O
C
6
H
12
O
6
+ 6O
2
°
→ 6CO
2
+ 6H
2
O
Từ các phản ứng suy ra: V
2
< V
1
< V
3
.
Bài 88: (Mỗi câu 2 điểm)
Câu 1: 2CuO + C
°
→ 2Cu + CO
2
2Fe
2
O
3
+ 3C
°
→ 4Fe + 3CO
2
O
2
+ C
°
→ CO
2
Câu 2: Có thể dùng BaCO
3
:
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
BaCO
3
+ H
2
SO
4
BaSO
4
↓ + CO
2
↑ + H
2
O
BaCO
3
+ CH
3
COOH (CH
3
COO)
2
Ba + CO
2
↑ + H
2
O
Chất vừa có hiện tượng sủi bọt vừa có kết tủa trắng là axit sunfuric loãng.
Chất chỉ có hiện tượng sủi bọt: axit axetic.
Chất không có hiện tượng: rượu etylic.
Câu 3: C
15
H
31
COO – CH(CH
2
– OOCC
17
H
35
)
2
+ 3NaOH
°
→ C
3
H
5
(OH)
3
+ C
15
H
31
COONa + 2C
17
H
35
COONa
Câu 4: CO
2
+ 2NaOH Na
2
CO
3
+ H
2
O.
Trong dung dịch sau phản ứng có: Na
2
CO
3
, NaOH (dư).
Câu 5: Trong 100ml dung dịch rượu etylic 70⁰ có 70ml rượu etylic và 30ml nước.
Khối lượng rượu etylic = 70 x 0,8 = 56 gam, khối lượng nước = 30 gam.
Khối lượng dung dịch = 56 + 30 = 86 gam.
Nồng độ % dung dịch rượu etylic =
x 100% = 65,11%.
Bài 89:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
C B C C D A B C
2. Lời giải:
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (C) Phân tử của chúng có liên kết ba và liên kết đôi.
Câu 2: (B) 𝑛
= 0, 025 mol ; 𝑛
= 0,04 lớn hơn số mol C
2
H
4
.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Nên còn màu da cam của dung dịch brom chỉ nhạt đi, không mất màu hẳn.
Câu 3: (C) NaNO
3
không tác dụng với KHCO
3
.
Câu 4: (C) Dung dịch brom dư đã tác dụng và giữ hết axetilen.
Câu 5: (D) C
2
H
5
OH, ( C
6
H
10
O
5
)
n
không phản ứng với dung dịch NaOH.
Câu 6: (A) 2C
2
H
5
OH + 2Na 2CH
3
CH
2
ONa + H
2
Câu 7: (B) Thể tích C
2
H
5
OH = 1000.0,15 = 150 ml.
Câu 8: (C) Dùng dung dịch iot nhận ra được hồ tinh bột. dung dịch AgNO
3
trong
NH
3
có thể phân biệt được rượu etylic và glucozo.
II. TỰ LUẬN (6 điểm)
Câu 9 (2 điểm):
1. Trùng hợp etilen: nCH
2
=CH
2
ú á,á ấ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
( CH
2
-CH
2
)
n
2. Axit axetic tác dụng với magie: 2CH
3
COOH + Mg (CH
3
COO)
2
Mg + H
2
3. Oxi hóa rượu etylic thành axit axetic:
C
2
H
5
OH + O
2
ấ
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOH + H
2
O
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc
tác.
CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O
Câu 10 (2 điểm): Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những
chuyển hóa sau:
4FeS
2
+ 11O
2
°
→ 8SO
2
+ 2Fe
2
O
3
2SO
2
+ O
2
,°
⎯
⎯
⎯
⎯
⎯
⎯
2SO
3
SO
3
+ H
2
O H
2
SO
4
H
2
SO
4
+ 2CH
3
COONa 2CH
3
COOH + Na
2
SO
4
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 11 (2 điểm): Dung dịch brom (dư) nên khối lượng dung dịch tăng bằng khối
lượng C
2
H
2
bị giữ lại tức bằng 1,3 gam.
C
2
H
2
+ 2Br
2
C
2
H
2
Br
4
𝑛
=
,
= 0,05 mol. Suy ra 𝑛
= 0,05 x 2 = 0,1 mol.
Khối lượng brom tham gia phản ứng: 0,1 x 189 = 18 (gam).
Thành phần % về thể tích của C
2
H
2
là 50%.
Bài 90:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
A C A B C D C B
2. Lời giải:
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A) Ca(HCO
3
)
2
+ H
2
SO
4
CaSO
4
+ 2CO
2
+ 2H
2
O
Ba(OH)
2
+ H
2
SO
4
BaSO
4
+ 2H
2
O
Câu 2: (C) 2Fe + 3Cl
2
°
→ 2FeCl
3
FeCl
3
+ 3NaOH Fe(OH)
3
(kết tủa màu nâu đỏ) + 3NaCl
Câu 3: (A) CH
4
, C
6
H
6
, CH
3
COONa đều không tác dụng với dung dịch brom.
Câu 4: (B) Chất béo là hỗn hợp nhiều este: sai.
Câu 5: (C) KNO
3
và Na
2
CO
3
không tác dụng với nhau.
Câu 6: (D) CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O
Câu 7: (C) Trong 1 lít rượu etylic 15⁰ có 0,15 lít rượu etylic và 0,85 lít nước.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 8: (B) Zn + CuCl
2
ZnCl
2
+ Cu.
II. TỰ LUẬN (6 điểm)
Câu 9 (2 điểm): (1) Dùng quỳ tím: dung dịch làm đỏ quỳ tím là axit axetic.
(2) Dùng AgNO
3
trong NH
3
: dung dịch cho Ag là glucozo.
Phương trình hóa học: C
6
H
12
O
6
+ Ag
2
O
⎯
C
6
H
12
O
7
+ 2Ag
Câu 10: CH
2
– OOC – C
17
H
35
CH – OOC – C
17
H
35
+ 3H
2
O
⎯
⎯
C
3
H
5
(OH)
3
+ 3C
17
H
35
COOH
CH
2
– OOC – C
17
H
35
(C
17
H
35
COO)
3
C
3
H
5
+ 3NaOH
°
→ C
3
H
5
(OH)
3
+ 3C
17
H
35
COONa
Viết công thức cấu tạo thu gọn:
Viết phản ứng với dung dịch H
2
SO
4
và với dung dịch NaOH:
Câu 11: (2 điểm): Cho 100ml etanol 96⁰.
a) Thể tích rượu nguyên chất = 100 x 0,96 = 96 ml
b) Thể tích khí H
2
(ở đktc): 2H
2
O + 2Na 2NaOH + H
2
2C
2
H
5
OH + 2Na 2NaOH + H
2
𝑉
= 10 – 9,6 = 0,4 mol =>𝑚
= 0,4 gam
=>𝑛
=
,
= 0,0111 𝑚𝑜𝑙
𝑚
= 9,6 x 0,8 = 7,68 gam =>𝑛
=
,
= 0,0834 (mol)
𝑉
= 0,0945 x 22,4 = 2,1168 (lít).
Bài 91:

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
A C B A D C D C
2. Lời giải:
I.TRẮC NGHIỆM KHÁCH QUAN (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A) HCl + NaHCO
3
NaCl + CO
2
+ H
2
O
Câu 2: (C) CO không phản ứng với các axit của kim loại hoạt động mạnh hay với
kim loại.
Câu 3: (B) Chỉ có C
2
H
4
là thỏa mãn.
Câu 4: (A) Mọi chất hữu cơ đều có mặt nguyên tố cacbon.
Câu 5: (D) Benzen không phản ứng với dung dịch Br
2
.
Câu 6: (C) Axit axetic, nước, rượu etylic đều phản ứng với kim loại K.
Câu 7: (D) Tinh bột, saccarozo, xenlulozo bị thủy phân trong môi trường axit.
Câu 8: (C) Dung dịch KOH hấp thụ khí CO
2
, SO
2
do tạo các muối KHCO
3
,
KHSO
3
,…
II. TỰ LUẬN (6 điểm)
Câu 9 (2 điểm):Viết phương trình hóa học thể hiện những chyển hóa sau:
C
12
H
22
O
11
+ H
2
O
⎯
⎯
2C
6
H
12
O
6
C
6
H
12
O
6
ượ
⎯
⎯
⎯
⎯
⎯
⎯
2C
2
H
5
OH + 2CO
2
C
2
H
5
OH + O
2
ấ
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOH + H
2
O
CH
3
COOH + NaOH CH
3
COONa + H
2
O
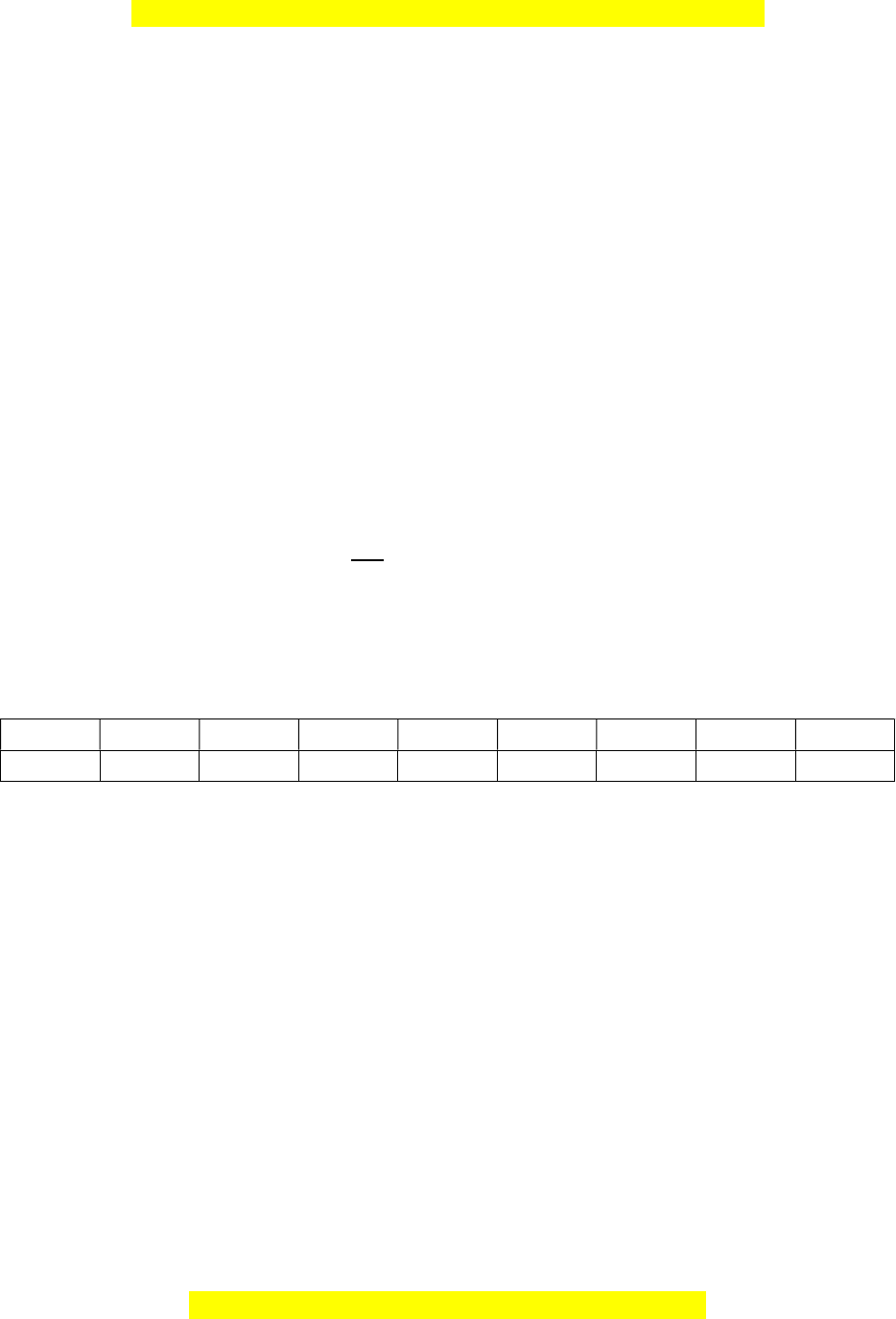
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 10 (2 điểm): Trích mẫu thử lần lượt thử với chất có màu ẩm, khí làm phai màu
là clo.
Hai khí còn lại thử với dung dịch brom, khí làm phai màu brom là C
2
H
4
.
Khí còn lại là CH
4
.
Câu 11 (2 điểm):
a) Thể tích rượu etylic nguyên chất = 1500 x 0,1 = 150 ml
b) Tính khối lượng axit axetic:
C
2
H
5
OH + O
2
ấ
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOH + H
2
O
Khối lượng C
2
H
5
OH = 150 x 0,8 = 120 gam.
Khối lượng CH
3
COOH =
x 60 x 0,8 = 125,5 gam.
Bài 92:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8
Đáp án
B D B A B A C A
2. Lời giải:
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (B) Xem bảng tuần hoàn các nguyên tố hóa học.
Câu 2: (D) CO
2
, Na
2
CO
3
, CO không phải là các hợp chất hữu cơ.
Câu 3: (B) Dãy các chất đều làm mất màu dung dịch brom:
C
2
H
4
+ Br
2
C
2
H
4
Br
2
C
2
H
2
+ 2Br
2
C
2
H
2
Br
4
SO
2
+ 2Br
2
+ 2H
2
O 2HBr + H
2
SO
4

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 4: (C) 2CuO + C
°
→ CO
2
+ 2Cu
CO
2
+ Ca(OH)
2
CaCO
3
(↓ trắng) + H
2
O
Câu 5: (B) NaHCO
3
+ CH
3
COOH CH
3
COONa + CO
2
↑ + H
2
O
Câu 6: (A) Polietilen, rượu etylic, poli(vinyl clorua) không bị thủy phân trong môi
trường axit.
Câu 7: (C) Nước vôi trong nhận biết CO
2
, dung dịch brom nhận biết C
2
H
4
, còn lại
là CH
4
.
Câu 8: (A) 𝑛
= 0,05 mol <𝑛
= 0,2 mol nên Br
2
còn, dung dịch chỉ nhạt màu.
II. TỰ LUẬN (6 điểm)
Câu 9 (2 điểm): Hoàn thành các phương trình hóa học sau:
a) 2C
2
H
5
OH + 2K 2C
2
H
5
OK + H
2
↑
b) 2CH
3
COOH + CaCO
3
(CH
3
COO)
2
Ca + CO
2
↑ + H
2
O
c) 2CH
3
COOH + ZnO (CH
3
COO)
2
Zn + H
2
O
d) CH
3
COOH + KOH CH
3
COOK + H
2
O
Câu 10 (2 điểm): m
C
=
,
x 12 = 2,4 gam; m
H
=
,
= 0,4 gam
=> m
O
= 6 – 2,8 = 3,2 gam
a) Trong chất hữu cơ A có những nguyên tố: C, H, O.
b) n
C
: n
H
: n
O
= 0,2 : 0,4 : 0,2 = 1 : 2 : 1
Công thức đơn giản nhất: CH
2
O
Công thức phân tử: (CH
2
O)
n
M = 30n => 55 < 30n < 65 => 1,8 < n < 2,1 => n = 2
C
2
H
4
O
2
.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 11 (2 điểm): 2CH
3
COOH + 2Na 2CH
3
COONa + H
2
2C
2
H
5
OH + 2Na 2C
2
H
5
ONa + H
2
Gọi x, y lần lượt là số mol của CH
3
COOH và C
2
H
5
OH trong hỗn hợp A.
60x + 46y = 21,2 và x + y = 0,4
Giải ra ta có: x = y = 0,2
Khối lượng CH
3
COOH = 0,2 x 60 = 12 (gam)
Phần trăm khối lượngCH
3
COOH =
,
x 100% = 56,6%
Phần trăm khối lượng C
2
H
5
OH = 100% - 56,6% = 34,4%
Bài 93:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
D D B D C A A D A D
Câu 11 12 13 14 15 16 17 18 19 20
Đáp án
A B D A C D D D D C
2. Lời giải:
Câu 1: (D) CH
3
COOH, CH
3
COOC
2
H
5
đều tác dụng được với NaOH.
Câu 3: (B) Al, Fe, Mg đứng trước Cu trong dãy hoạt động của kim loại, nên tác
dụng với dung dịch CuSO
4
.
Câu 4: (D) Rượu etylic không tác dụng được với NaOH.
Câu 5: (C) KOH, Fe, Al phản ứng với khí clo cho các muối: KCl, KClO, FeCl
3
,
AlCl
3
.
Câu 6: (A) n
C
= 0,1; n
H
= 0,3; n
O
=
,(,,)
= 0,05
Công thức phân tử của X: C
2
H
6
O
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 7: (A) C
2
H
6
O + 3O
2
°
→ 2CO
2
+ 3H
2
O
Câu 8: (D) CH
3
OH, C
2
H
5
OH tác dụng được với Na cho CH
3
ONa, C
2
H
5
ONa và khí
hidro.
Câu 9: (A) Độ rượu là số ml rượu etylic có trong 100ml dung dịch rượu.
Câu 10: (D) Chất béo. Ví dụ:
(RCOO)
3
C
3
H
5
+ 3NaOH
°
→ C
3
H
5
(OH)
3
+ 3RCOONa
Câu 11: (A) BaO + H
2
O Ba(OH)
2
. Khối lượng Ba(OH)
2
= 17,1 gam.
Khối lượng dung dịch Ba(OH)
2
= 15,3 + 84,7 = 100(gam).
C% dung dịch Ba(OH)
2
= 17,1%.
Câu 12: (B) C
2
H
4
+ Br
2
C
2
H
4
Br
2
.
Câu 13: (D) Khi đun nóng chất béo tự nhiên với dung dịch kiềm thu được glixerol
và hỗn hợp các muối của axit béo.
Câu 14: (A) H
2
SO
4
+ 2NaOH Na
2
SO
4
+ 2H
2
O
𝑛
=
,
= 0,1 mol.
Thể tích dung dịch H
2
SO
4
1M cần = 0,1 lít hay 100ml.
Câu 15: (C) Khối lượng glixerol =
x 92 = 184 gam.
Câu 16: (D) C
3
H
7
– OH, C
6
H
6
, ( C
6
H
10
O
5
)
n
không tác dụng với NaOH.
Câu 17: (D) Rượu etylic, axit axetic, phenolphthalein tạo dung dịch hỗn hợp đồng
nhất và không phải là môi trường bazo nên phenolphthalein không màu.
Câu 18: (D) nCH
2
=CH
2
ú á,á ấ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
( CH
2
– CHCl )
n
Lượng vinyl clorua cần dùng =
,
= 117,65 (kg).

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 19: (D) Chất béo cung cấp nhiều năng lượng nhất.
Câu 20: (C) SO
2
+ CaO CaSO
3
.
Bài 94:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
A B D B D C B A C A
Câu 11 12 13 14 15 16 17 18 19 20
Đáp án
D A C A C B D C A A
2. Lời giải:
Câu 1: (A) AgCl, CuO, BaSO
4
không tan trong nước.
Câu 2: (B) Khí C
2
H
2
bị dung dịch Br
2
hấp thụ nên khối lượng dung dịch tăng.
Câu 3: (D) Al
2
(SO
4
)
3
+ 6NaOH 2Al(OH)
3
↓ + 3Na
2
SO
4
𝑛
(
)
= 0,01 mol => n
NaOH
= 0,06 mol
=> V
dung dịch
NaOH = 0,06 lít hay 60 ml.
Câu 4: (B) PVC, PE không có phản ứng thủy phân.
Câu 5: (D) Metan, etilen không thuộc loại polime.
Câu 6: (C) Xenlulozo, tinh bột, poli(vinyl clorua) không chưa nguyên tố nito.
Câu 7: (B)
Câu 8: (A) 𝑛
= 0,0125 mol =>𝑚
= 0,0125 x 160 = 2 (gam).
Câu 9: (C)
Câu 10: (A) 2C
2
H
5
OH + 2K 2C
2
H
5
OK + H
2
𝑛
=
,
= 0,15 mol =>𝑛
=
,
= 0,075 mol.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Thể tích khí hidro thu được (ở đktc) = 0,075 x 22,4 = 1,68 lít.
Câu 11: (D)
Câu 12: (A) 2C
n
H
2n+1
OH + 2K 2C
n
H
2n+1
OK + H
2
1 mol C
n
H
2n+1
OH 1 mol C
n
H
2n+1
OK. Khối lượng tăng = 39 – 1 = 38 (gam).
Suy ra số mol C
n
H
2n+1
OH =
,,
= 0,075 mol
Khối lượng mol C
n
H
2n+1
OH =
,
,
= 60 = 14n + 18 => n = 3.
Công thức chất X = C
3
H
7
OH.
Câu 13: (C)
Câu 14: (A) Clo tác dụng với nước tạo ra HClO có tính tẩy màu.
Câu 15: (C) 𝑚
= 0,9 gam; 𝑚
= 1,76 gam.
m
H
= 0,1 gam; m
C
= 0,48 gam => m
O
= 0,74 – (0,1 + 0,48) = 0,16 gam
n
C
: n
H
: n
O
= 1 : 4 : 1. Công thức của Y: CH
4
O.
Câu 16: (B)
Câu 17: (D) Phân tử chất X có 6 nguyên tử C.
Câu 18: (C) Rượu etylic
()
axit axetic: Phải là men giấm.
Câu 19: (A) 1 mol glucozo (180gam) khi oxi hóa hoàn toàn cho 239kJ.
Vậy khi oxi hóa 500g glucozo nhiệt lượng tỏa ra =
x 239 = 663,9 (kJ)
Câu 20: (A) Năng lượng mà cây xanh hấp thụ =
x 2816 = 28160 (kJ).
Bài 95:
1. Đáp án:

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
D B A C A B A A A A
Câu 11 12 13 14 15 16 17 18 19 20
Đáp án
A A B B C B D C C C
2. Lời giải:
Câu 1: (D) CH
4
+ 2O
2
°
→ CO
2
+ H
2
O
𝑛
=
= 2 mol =>𝑛
= 2 mol
Thể tích CO
2
sinh ra (ở đktc) là = 2 x 22,4 = 44,8 (lít)
Câu 2: (B) MnO
2
+ 4HCl
°
→ MnCl
2
+ Cl
2
+ H
2
O
Câu 3: (A)
Câu 4: (C) 1mol khí etilen (28g) chiếm thể tích 22,4 lít (ở đktc)
Thể tích của 14g khí (ở đktc) etilen =
x 22,4 = 11,2 lít
Câu 5: (A) CH
3
COOH tác dụng lần lựt với: CuO, CaCO
3
, C
2
H
5
– OH, Ca(OH)
2
.
Câu 6: (B)
Câu 7: (A) Axit axetic làm quỳ tím hóa đỏ. Rượu etylic tác dụng với Na.
Câu 8: (A) 𝑛
=
,
= 0,1 mol; 𝑛
= 0,3 mol.
2CH
3
COOH + Na
2
CO
3
2CH
3
COONa + CO
2
+ H
2
O
CO
2
+ Ba(OH)
2
BaCO
3
+ H
2
O
CH
3
COOH dư; 𝑛
= 0,1 mol = 𝑛
=> 𝑚
= 197 x 0,2 = 19,7g.
Câu 9: (A)
Câu 10: (A) 𝑛
=
= 0,05 mol, 𝑛
=
,
= 0,1 mol
CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O
Rượu etylic dư, nếu phản ứng hoàn toàn thì số gam este = 0,05 x 88 = 4,4 g.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Hiệu suất phản ứng là:
,
,
x 100% = 75%.
Câu 11: (A) C
n
H
2n
+ 3n/2O
2
°
→ nCO
2
+ nH
2
O
𝑛
: 𝑛
= 1,5 : 1.
Câu 12: (A)
( C
6
H
10
O
5
)
n
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
nC
6
H
12
O
6
ượ
⎯
⎯
⎯
⎯
⎯
⎯
2nCO
2
2nCaCO
3
𝑛
=
= 0,5 mol => 𝑛
=
,
= 0,25 mol
Khối lượng ( C
6
H
10
O
5
)
n
= 0,25 x 162 = 40,5g.
Khối lượng ( C
6
H
10
O
5
)
n
trong ngũ cốc:
,
x 100 = 50,625g.
Tỉ lệ tinh bột trong loại ngũ cốc đó =
,
x 100% = 77,88%.
Câu 13: (B)
Câu 14: (B) Lượng nhiệt tỏa ra khi oxi hóa hoàn toàn 100g glucozo =
,
x 100 = 292,6 kJ.
Câu 15: (C) Dung dịch bazo có độ pH lớn hơn dung dịch trung tính hay dung dịch
axit.
Câu 16: (B) Năng lượng tỏa ra khi oxi hóa hoàn toàn 50g chất béo = 50x38 =
1900kJ.
Câu 17: (D)
Câu 18: (C) Fe + CuSO
4
(dd màu xanh) Cu + FeSO
4
(dd không màu)
Câu 19: (C) 2SO
2
+ O
2
ú á,°
⎯
⎯
⎯
⎯
⎯
2SO
3
Câu 20: (C) 𝑛
=
= 0,075 + 0,05 = 0,125 mol.
Thể tích dung dịch bằng 75 + 25 = 100 (ml).
Nồng độ mol =
,
,
= 1,25M.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Bài 96:
1. Đáp án:
Câu 1 2 3 4 5 6 7 8 9 10
Đáp án
B C D B A A A C C C
Câu 11 12 13 14 15 16 17 18 19 20
Đáp án
A A C C C D A B A A
2. Lời giải:
Câu 1: (B) Khí C
2
H
4
bị dung dịch Br
2
hấp thụ.
Câu 2: (C) Trong liên kết đôi có một liên kết bền hơn liên kết đơn.
Câu 3: (D) Benzen có phản ứng thế với Br
2
khan khi có bột Fe xúc tác, cháy được
và có phản ứng cộng với H
2
khi có Ni nung nóng. Benzen không phản ứng với Na.
Câu 4: (B) Công thức cấu tạo của rượu etylic: CH
3
– CH
2
– OH.
Câu 5: (A) 2CH
3
COOH + 2Na 2CH
3
COONa + H
2
2C
2
H
5
OH + 2Na 2C
2
H
5
ONa + H
2
CH
3
COOH + NaOH CH
3
COONa + H
2
O
𝑛
= 0,04 mol. Gọi x là số mol của C
2
H
5
OH.
Ta có: x + 0,04 = 2 x 0,03 = > x = 0,02 mol
Khối lượng rượu etylic trong hỗn hợp: 0,02 x 46 = 0,92g.
Câu 6: (A) CH
3
COOC
2
H
5
+ NaOH
°
→ CH
3
COONa + C
2
H
5
OH
CH
3
COONa và C
2
H
5
OH tan trong nước, benzen không tan nhẹ hơn nước nên nổi
lên trên.
Câu 7: (A) Phân tử X và Y phải có nhóm OH. Y là một axit.
Câu 8: (C) Ý sai: dầu mỡ dùng làm thwujc phẩm và dầu mỡ dùng để bôi trơn đều
không tan trong nước.
Câu 9: (C) Rượu etylic hòa tan được dầu mỡ hay chất béo, không làm bẩn hay gây
độc và tan được trong nước.
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Câu 10: (C)
Câu 11: (A) C
12
H
22
O
11
+ H
2
O
,°
⎯
⎯
⎯
⎯
C
6
H
12
O
6
+ C
6
H
12
O
6
Khối lượng fructozo =
x 180 = 5,3g.
Câu 12: (A)
Câu 13: (C) CH
3
COOH + NaOH CH
3
COONa + H
2
O
𝑛
= 𝑛
= 0,2 x 0,5 = 0,1 mol
𝑚
= 0,1 x 60 = 6 (g) => 𝑚
= 14,8 – 6 = 8,8 (g)
Thành phần % theo khối lượng của CH
3
COOC
2
H
5
=
,
,
x 100% = 59,45%.
Câu 14: (C) CO
2
bị NaOH tác dụng tạo ra muối không thoát ra khỏi dung dịch.
Câu 15: (C) Dung dịch axit luôn có độ pH bé hơn dung dịch trung hòa hay dung
dịch kiềm.
Câu 16: (D) C
2
H
5
OH + 3O
2
°
→ 2CO
2
+ 3H
2
O
CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O
𝑛
= 0,626 mol = 𝑛
=> 𝑛
= 0,313 mol.
Khối lượng C
2
H
5
OH = 0,313 x 46 = 14,398 g.
Thể tích C
2
H
5
OH =
,
,
≈ 18 ml.
Độ rượu:
x 100 = 90°.
Câu 17: (A)
Câu 18: (B)
2CH
3
COOH + 2Na 2CH
3
COONa + H
2
2C
2
H
5
OH + 2Na 2C
2
H
5
ONa + H
2
Gọi x, y lần lượt là số mol của CH
3
COOH và C
2
H
5
OH
Ta có: 60x + 46y = 10,6

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
x + y = 0,2 => x = y = 0,1 mol
CH
3
COOH + C
2
H
5
OH
đặ,°
⎯
⎯
⎯
⎯
⎯
⎯
⎯
CH
3
COOC
2
H
5
+ H
2
O
Nếu phản ứng hoàn toàn thì số gam este = 0,1 x 88 = 8,8g.
Hiệu suất phản ứng 70% nên khối lượng este thu được: 8,8 x 0,7 = 6,16g.
Câu 19: (A) Cl
2
không phản ứng với chất: Fe
2
O
3
, Na
2
O, CaO, CuO, Al
2
O
3
.
Câu 20: (A) H
2
SO
4
+ 2NaOH Na
2
SO
4
+ 2H
2
O
n
NaOH
= 0,02 mol => 𝑛
= 0,01 mol.
Thể tích dung dịch H
2
SO
4
0,5M cần dùng =
,
,
= 0,02 lít = 20ml.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85