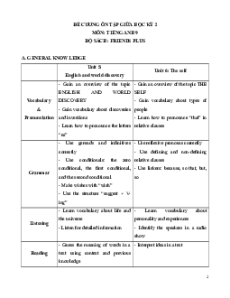
UBND QUẬN 1
ĐỀ KIỂM TRA HỌC KÌ I
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO MÔN: Hóa – Lớp 9
Thời gian làm bài: 45 phút; không kể thời gian phát đề
Câu 1 (VD): Thực hiện chuỗi chuyển hóa sau (ghi rõ điều kiện nếu có):
Câu 2 (VD): Có 4 lọ hóa chất mất nhãn, mỗi lọ đựng riêng biệt một dung dịch sau: KOH, KCl, Na 2SO4,
H2SO4. Em hãy trình bày cách nhận biết các dung dịch trên và viết phương trình hóa học xảy ra.
Câu 3 (TH): Nêu hiện tượng các phản ứng hóa học sau:
a. Nhỏ từ từ dung dịch HCl vào ống nghiệm có chứa dung dịch NaOH và vài giọt phenophtalein.
b. Cho mảnh đồng vào ống nghiệm có chứa AgNO3.
Câu 4 (VD): Hòa tan hết 10 gam hỗn hợp Fe và Cu trong 200 ml dung dịch HCl thu được 2,24 lít H2 ở điều kiện tiêu chuẩn.
a. Viết phương trình phản ứng xảy ra.
b. Tính phần trăm theo khối lượng của mỗi kim loại có trong hỗn hợp.
c. Tính nồng độ mol của dung dịch HCl đã dùng và của chất trong dung dịch sau phản ứng. Biết sau phản
ứng thể tích dung dịch thay đổi không đáng kể.
Câu 5 (TH): Viết phương trình hóa học điều chế khí Cl2 trong công nghiệp và trong phòng thí nghiệm. Đáp án 1- 2- 3- 4- 5- 6- 7- 8- 9- 10- 11- 12- 13- 14- 15- 16- 17- 18- 19- 20- 21- 22- 23- 24- 25- 26- 27- 28- 29- 30- 31- 32- 33- 34- 35- 36- 37- 38- 39- 40- LỜI GIẢI CHI TIẾT
Câu 1: Đáp án (1) 4K + O2 2K2O (2) K2O + H2O → 2KOH (3) 2KOH + CO2 → K2CO3 + H2O
(4) K2CO3 + 2HCl → 2KCl + H2O + CO2↑ (5) CO2 + CaO → CaCO3 (6) CaCO3 CaO + CO2
Câu 2: Đáp án Trang 1
Phương pháp giải:
- Dùng quỳ tím nhận biết ra H2SO4 và KOH
- Dùng dd BaCl2 nhận biết ra Na2SO4 - Còn lại là KCl Giải chi tiết:
Trích mỗi chất ra 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng
- Cho quỳ tím lần lượt vào các ống nghiệm trên:
+ Quỳ tím chuyển sang màu đỏ là: H2SO4
+ Quỳ tím chuyển sang màu xanh là: KOH
+ Quỳ tím không chuyển màu là: KCl và Na2SO4 (dãy I)
- Cho dung dịch BaCl2 lần lượt các chất ở dãy I
+ ống nghiệm nào xuất hiện kết tủa trắng là: Na2SO4
BaCl2 + Na2SO4 → BaSO4↓ trắng + 2NaCl
+ ống nghiệm còn lại không có hiện tượng gì là: KCl
Câu 3: Đáp án Phương pháp giải:
Nêu những gì quan sát được như: màu sắc dung dịch, có kết tủa hay khí thoát ra không , màu sắc kết tủa, mùi khí… Giải chi tiết:
a. hiện tượng: NaOH có vài giọt phenophtalein dung dịch có màu hồng, khi nhỏ từ từ dd HCl vào thì màu
hồng của dung dịch nhạt dần đến mất màu => dung dịch thu được trong suốt.
Do có phản ứng hóa học sau: HCl + NaOH → NaCl + H2O
Dung dịch thu được là muối NaCl có thể có HCl dư nên không làm phenophtalein chuyển màu.
b. hiện tượng: mảnh đồng tan dần, dung dịch thu được có màu xanh lam, đồng thời xuất hiện kim loại
trắng bạc bám vào mảnh đồng.
PTHH: Cu + 2AgNO3 → Cu(NO3)2 (màu xanh lam) + 2Ag↓
Câu 4: Đáp án Phương pháp giải: a.
PTHH: Fe + 2HCl → FeCl2 + H2↑ b. Theo PTHH: nFe = nH2 = ? (mol)
Khối lượng của Fe là: mFe = ?(g) Trang 2
Đề thi cuối kì 1 Hóa học 9 Phòng GD&ĐT Quận 1
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ 29 Đề thi học kì 1 Hóa học năm 2023 chọn lọc từ các trường bản word có lời giải chi tiết gồm:
+ Đề thi học kì 1 Hóa học năm 2023 trường THCS Trần Quốc Toản – Quận Bình Tân;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Nguyễn Trãi - Thành phố Châu Đốc;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Trường Sa - Thành phố Biên Hòa;
+Đề thi học kì 1 Hóa học năm 2023 Sở GD_ĐT Lạng Sơn.
…..……………………
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(533 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 9
Xem thêmTài liệu bộ mới nhất