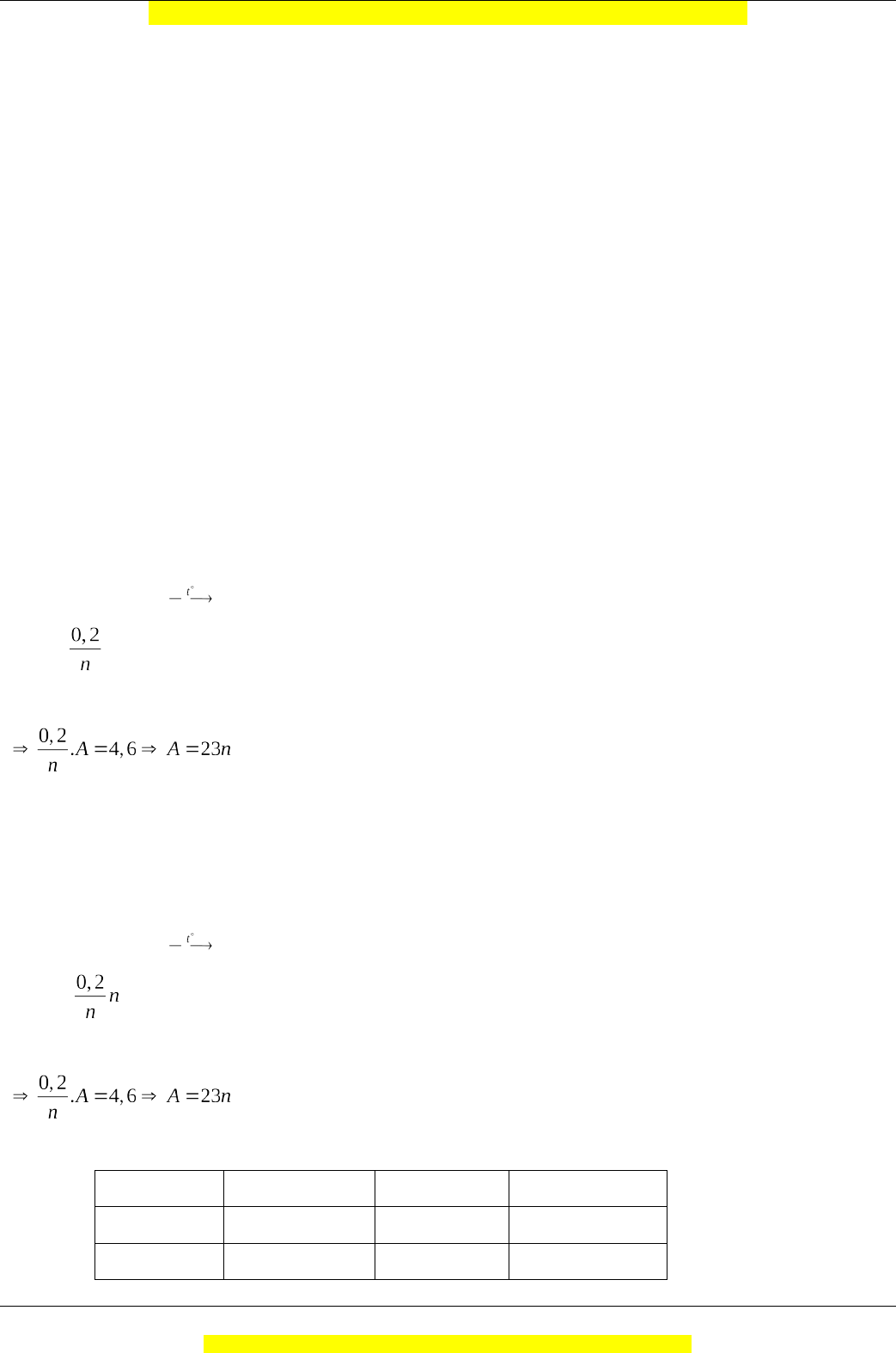SỞ GD&ĐT KẾ SÁCH
ĐỀ KIỂM TRA HỌC KÌ I
TRƯỜNG PTDTNT THCS H.KẾ MÔN: Hóa – Lớp 9 SÁCH
Thời gian làm bài: 45 phút; không kể thời gian phát đề A. TRẮC NGHIỆM
Câu 1 (NB): Chất tác dụng với nước tạo ra dung dịch làm quỳ tím chuyển màu xanh là: A. Na2O B. CO2 C. SO2 D. CuO
Câu 2 (NB): Dãy hợp chất nào sau đây gồm các muối?
A. Mg(HCO3)2, Ba(OH)2, CuSO4, HCl.
B. Mg(HCO3)2, NH4NO3, CuSO4, Fe(NO3)2
C. H2SO4, Na2CO3, NaOH, CaSO4.
D. CaO, Ba(OH)2, MgSO4, BaSO4
Câu 3 (TH): Axit H2SO4 loãng không tác dụng với kim loại nào sau đây? A. Al B. Fe. C. Mg. D. Ag
Câu 4 (NB): Nguyên liệu chính để sản xuất nhôm là: A. criolit B. quặng boxit C. quặng pirit. D. đá vôi
Câu 5 (TH): Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần:
A. K, Al, Mg, Cu, Fe. B. Cu, Fe, Mg, Al, K. C. Cu, Fe, Al, Mg, K. D. K, Cu, Al, Mg, Fe B. TỰ LUẬN
Câu 6 (VD): Có 3 lọ hóa chất không nhãn chứa lần lượt một trong ba dung dịch CaCl2, H2SO4 và Na2SO4.
Trình bày phương pháp hóa học nhận biết ba lọ hóa chất trên?
Câu 7 (VD): Viết phương trình hóa học hoàn thành dãy chuyển hóa sau
Câu 8 (VD): Cho 1 lượng kẽm (Zn) dư tác dụng với 100 ml dung dịch axit HCl, phản ứng kết thúc thu
được 3,36 lít khí (đktc)
a) Tính khối lượng kẽm đã phản ứng
b) Tính nồng độ mol của dung dịch HCl đã dùng?
Câu 9 (VDC): Cho 4,6 g kim loại A chưa biết, có hóa trị không đổi phản ứng vừa đủ với 2,24 lít khí clo
(đktc). Xác định tên kim loại A? LỜI GIẢI CHI TIẾT
Câu 1: Đáp án Phương pháp giải:
Oxit bazo của các bazo tan tác dụng với nước tạo thành dd bazo
Đó là các oxit của kim loại kiềm và 1 số kiềm thổ Giải chi tiết:
Na2O + H2O → NaOH (dd bazo tan)
Câu 2: Đáp án Phương pháp giải: Trang 1
Dựa vào khái niệm về muối: Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit Giải chi tiết: A. Loại HCl là axit
B. Thỏa mãn tất cả đều là muối
C. Loại H2SO4 là axit còn NaOH là bazo
D. Loại CaO là oxit bazo, Ba(OH)2 là bazo
Câu 3: Đáp án Phương pháp giải:
Điều kiện kim loại phản ứng được với dd H2SO4 loãng là Kl đứng trước H trong dãy điện hóa Giải chi tiết:
Ag là kim loại đứng sau H trong dãy điện hóa nên không phản ứng được với dd H2SO4 loãng
Câu 4: Đáp án Phương pháp giải:
Dựa vào kiến thức học về nhôm SGK hóa 9 – trang 56 Giải chi tiết:
Nguyên liệu chính để sản xuất nhôm là quặng boxit 2Al2O3 4Al + 3O2↑
Câu 5: Đáp án Phương pháp giải:
Câu 6: Đáp án Phương pháp giải:
Nhận thấy CaCl2, H2SO4 và Na2SO4 thuộc hợp chất muối và axit => dùng quỳ tím để nhận ra được axit Còn lại muối CaCl 2-
2; Na2SO4 chọn thuốc thử đặc trưng nhận biết gốc SO4 là muối hoặc dd bazo của ion Ba2+ Giải chi tiết:
Bước 1: Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng
Bước 2: Cho quỳ tím lần lượt vào các dung dịch
+ Dung dịch nào làm quỳ tím chuyển sang màu đỏ là: H2SO4
+ Dung dịch nào quỳ tím không chuyển màu là: CaCl2 và Na2SO4 (dãy I)
Bước 3: Cho dung dịch BaCl2 lần lượt vào các chất ở dãy (I)
+ Chất nào xuất hiện kết tủa trắng là Na2SO4 Trang 2
BaCl2 + Na2SO4 → BaSO4↓ +2NaCl
+ Chất còn lại không có hiện tượng gì là CaCl2
Câu 7: Đáp án
nH2(ĐKTC) = 3,36 :22,4= 0,15 (mol)
a) PTHH: Zn + 2HCl → ZnCl2 + H2↑ 0,15 0,3 ← 0,15 (mol)
Theo PTHH: nZn = nH2 = 0,15 (mol)
=> Khối lượng Zn đã phản ứng là: mZn = nZn. MZn = 0,15×65 = 9,75 (g)
b) Theo PTHH: nHCl pư = 2nH2 = 2.0,15 = 0,3 (mol) 100 ml = 0,1 (lít)
Nồng độ HCl đã dùng là: CM HCl = nHCl : VHCl = 0,3 :0,1 = 3 (M)
Câu 8: Đáp án Phương pháp giải:
Đổi số mol H2: nH2(ĐKTC) = VH2 :22,4= 0,1 (mol)
Gọi hóa trị của kim loại A là n (n € N*) PTHH: 2A + nCl2 2ACln ←0,1 (mol) Ta có: nA. MA = mA
Chạy giá trị n= 1, 2, 3 sẽ tìm được giá trị A thỏa mãn Giải chi tiết:
nCl2(đktc) = 2,24 :22,4 = 0,1 (mol)
Gọi hóa trị của kim loại A là n (n € N*) PTHH: 2A + nCl2 2ACln ←0,1 (mol) Ta có: nA. MA = mA
Vì n thường nhận giá trị 1,2,3 nên ta có bảng sau n 1 2 3 A 23 46 69 Nhận (Na) Loại Loại Vậy A là kim loại Natri Trang 3
Đề thi cuối kì 1 Hóa học 9 Phòng GD&ĐT Tam Dương
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ 29 Đề thi học kì 1 Hóa học năm 2023 chọn lọc từ các trường bản word có lời giải chi tiết gồm:
+ Đề thi học kì 1 Hóa học năm 2023 trường THCS Trần Quốc Toản – Quận Bình Tân;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Nguyễn Trãi - Thành phố Châu Đốc;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Trường Sa - Thành phố Biên Hòa;
+Đề thi học kì 1 Hóa học năm 2023 Sở GD_ĐT Lạng Sơn.
…..……………………
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(639 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 9
Xem thêmTài liệu bộ mới nhất