TRƯỜNG LIÊN CẤP THCS,
ĐỀ KIỂM TRA HỌC KÌ I
TIỂU HỌC NGÔI SAO HÀ NỘI MÔN: Hóa – Lớp 9
Thời gian làm bài: 45 phút; không kể thời gian phát đề
Câu 1 (NB): Công thức hóa học của nhôm là: A. Al. B. Cu. C. Fe. D. Zn.
Câu 2 (NB): Công thức hóa học của axit sunfuric là: A. HCl. B. H2SO3. C. H2SO4. D. HClO.
Câu 3 (TH): Tên gọi của Al2O3 và Al(OH)3 lần lượt là:
A. Nhôm oxit và nhôm (III) hidroxit.
B. Nhôm (III) oxit và nhôm hidroxit.
C. Nhôm oxit và nhôm hidroxit.
D. Nhôm (III) oxit và nhôm (III) hidroxit.
Câu 4 (TH): Sản phẩm khi đốt cháy nhôm trong khí oxi (O2) là: A. AlO. B. Al2O3. C. Al3O2. D. Al2O2.
Câu 5 (TH): Cho phản ứng: Al + Cl2
…. Tổng hệ số tối giản của phương trình là: A. 4. B. 3. C. 7. D. 9.
Câu 6 (NB): Nhôm không tác dụng được với: A. HCl. B. H2SO4 loãng. C. NaOH. D. NaCl.
Câu 7 (TH): Nhúng một thanh sắt vào dung dịch đồng (II) sunfat. Phản ứng hóa học xảy ra là:
A. Fe + CuSO4 15→"> FeSO4 + Cu.
B. Fe + Cu2SO4 15→"> FeSO4 + 2Cu.
C. 2Fe + 3CuSO4 15→"> Fe2(SO4)3 + 3Cu. D. 2Fe + 3Cu2SO4 15→"> Fe2(SO4)3 + 6Cu.
Câu 8 (NB): Nhiệt phân sắt (III) hidroxit thu được sản phẩm là: A. Fe2O3. B. Fe. C. Fe2O3 và H2O. D. Fe và H2O.
Câu 9 (TH): Thêm vài giọt kali hidroxit vào dung dịch đồng (II) clorua. Sản phẩm thu được là: A. Cu(OH)2 và KCl.
B. Cu(OH)2 và NaCl. C. CuOH và KCl D. CuOH và NaCl.
Câu 10 (VD): Cho phản ứng hóa học: x… + H2SO4 → FeSO4 + y… . Tổng (x + y) có thể là: A. 1. B. 2. C. 3. D. 4.
Câu 11 (TH): Phản ứng hóa học nào sau đây không chính xác:
A. Fe + CuSO4 → FeSO4 + Cu.
B. Fe + 2AgNO3 → Fe(NO3)2 + 2Ag. C.
Cu + MgSO4 → CuSO4 + Mg.
D. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
Câu 12 (TH): Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
A. Xuất hiện kết tủa hồng.
B. Xuất hiện kết tủa trắng.
C. Xuất hiện kết tủa xanh lam.
D. Xuất hiện kết tủa nâu đỏ.
Câu 13 (NB): Hiện tượng khi nhúng quỳ tím vào dung dịch NaOH là:
A. Quỳ chuyển đỏ. B. Quỳ chuyển xanh. C. Quỳ chuyển đen.
D. Quỳ không chuyển màu.
Câu 14 (TH): Có thể phân biệt Fe và Al bằng dung dịch: A. NaOH. B. HCl.
C. H2SO4 (loãng). D. CuSO4. Trang 1
Câu 15 (TH): Có thể phân biệt BaCl2 và NaCl bằng dung dịch: A. H2SO4. B. KOH. C. NaOH. D. KNO3.
Câu 16 (NB): Quặng nào sau đây chứa thành phần chính là Al2O3: A. Boxit. B. Pirit. C. Dolomit. D. Apatit.
Câu 17 (TH): Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được
chất rắn T không tan. Vậy T là: A. Al. B. Fe. C. Mg. D. Cu.
Câu 18 (NB): Khí X là nguyên nhân gây hiệu ứng nhà kính, đồng thời khí X cũng một nguyên nhân gây
mưa axit. Vậy công thức hóa học của X là: A. CO2 B. N2. C. O2. D. SO2.
Câu 19 (NB): Ăn mòn kim loại do ma sát được gọi là: A. Ăn mòn vật lý.
B. Ăn mòn hóa học. C. Ăn mòn sinh học.
D. Ăn mòn toán học.
Câu 20 (NB): Kim loại có nhiệt độ nóng chảy thấp nhất là: A. Hg. B. Al. C. Fe. D. W.
Câu 21 (TH): Nước clo thường được dùng phổ biến để diệt trùng trong bể bơi. Vậy nước clo là: A. HCl. B. HClO. C. HCl và HClO. D. H2O.
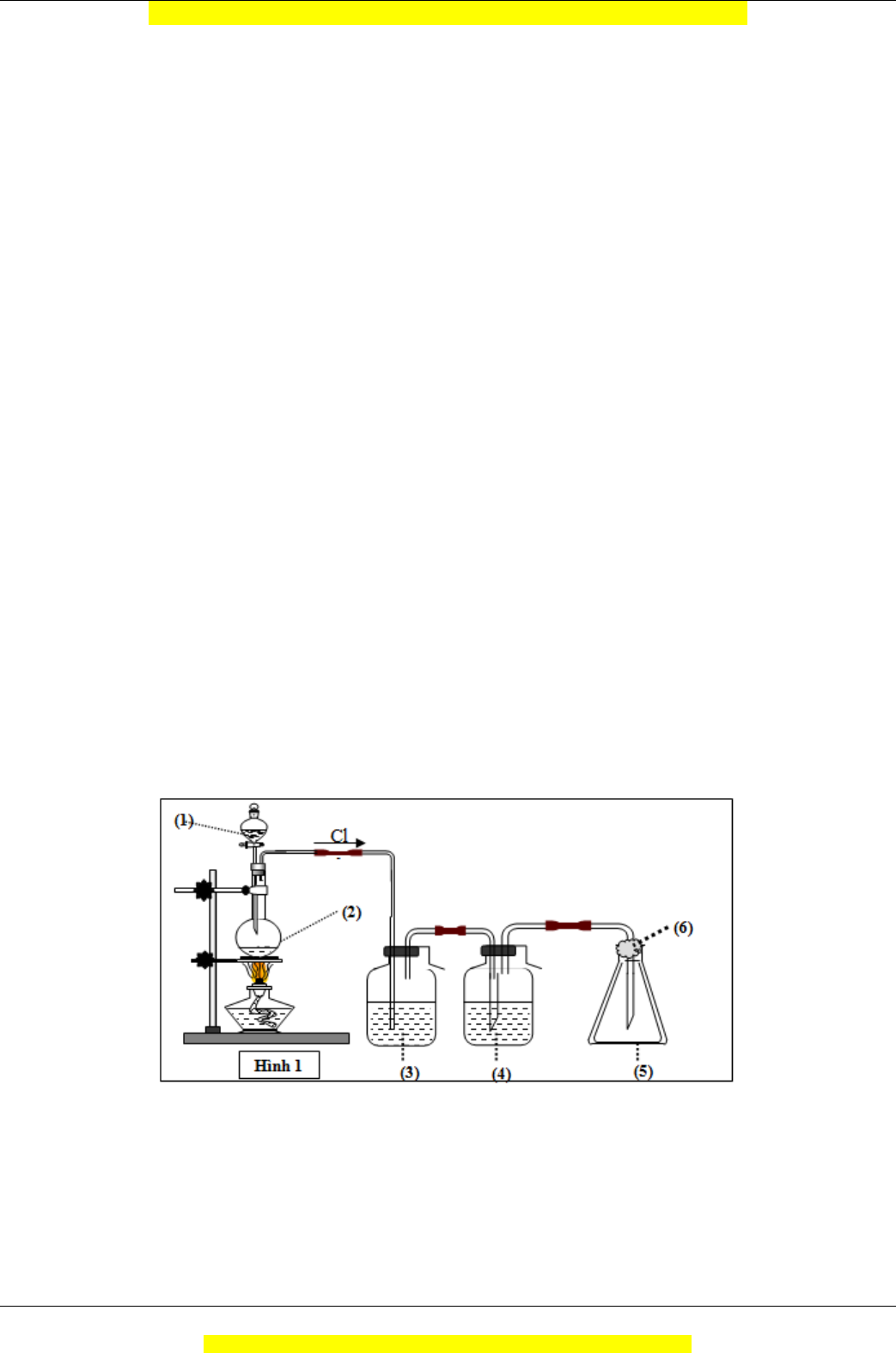
Câu 22 (TH): Mô hình điều chế khí clo trong phòng thí nghiệm được cho như hình vẽ bên (Hình 1). Quy
trình thí nghiệm xảy ra như sau: Nhỏ từ từ dung dịch (1) xuống bình cầu có chứa chất rắn màu đen (2).
Đun nóng hỗn hợp thì thoát ra khí clo (màu vàng lục). Khí clo sinh ra di chuyển theo hệ thống bình (3);
(4); (5). Tại bình số (5), khí clo được giữ lại. Để tránh việc clo thoát ra ngoài không khí, người ta tẩm vào
(6) dung dịch T. Vậy (1) là: A. HCl. B. NaOH. C. H2SO4. D. NaCl.
Câu 23 (VD): Hòa tan hoàn toàn 5,6 gam Fe bằng dung dịch HCl, sau phản ứng thu được V lít H2 (đktc). Giá trị của V là: A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Câu 24 (VD): Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là: A. 100. B. 200. C. 300. D. 400. Trang 2
Câu 25 (VD): Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn
tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là: A. 0,1 mol. B. 0,2 mol. C. 0,3 mol. D. 0,4 mol.
Câu 26 (VD): Hỗn hợp X gồm Fe và Al (với tỉ lệ mol 1 : 1). Hòa tan hoàn toàn m gam X bằng dung dịch
HCl dư, sau phản ứng thu được 5,6 lít H2 (đktc). Giá trị của m là: A. 10,2 gam. B. 8,3 gam. C. 2,7 gam D. 16,6 gam.
Câu 27 (VD): Để trung hòa hoàn toàn 100ml dung dịch NaOH 1M cần vừa đủ V ml dung dịch H2SO4 2M. Giá trị của V là: A. 25ml. B. 50ml. C. 100ml. D. 200ml.
Câu 28 (VDC): Điện trở đặc trưng cho khả năng cản trở dòng điện. Điện trở càng lớn thì khả năng dẫn
điện của kim loại càng giảm. Cho 4 kim loại X, Y, Z, T ngẫu nhiên tương ứng với Ag, Al, Fe, Cu. Cho
bảng giá trị điện trở của các kim loại sau: Kim loại X Y Z T Điện trở X là kim loại: A. Fe. B. Ag. C. Cu. D. Al.
Câu 29 (VDC): Hòa tan 5,6 gam Fe bằng 250ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X
có chứa chất tan T. Chất T có khả thể tác dụng với Na2CO3 tạo khí. Coi thể tích dung dịch thay đổi không
đáng kể. Nồng độ mol của T là: A. 0,2M. B. 0,4M. C. 0,6M. D. 0,8M.
Câu 30 (VDC): Hòa tan hoàn toàn một kim loại R có hóa trị II bằng dung dịch H2SO4 9,8% (loãng) vừa
đủ, sau phản ứng thu được dung dịch X chứa muối Y với nồng độ phần trăm là 14,394%. Kim loại R là: A. Mg. B. Fe. C. Zn. D. Cu. Đáp án 1-A 2-C 3-C 4-B 5-D 6-D 7-A 8-C 9-A 10-B 11-C 12-B 13-B 14-C 15-A 16-A 17-D 18-A 19-A 20-A 21-C 22-B 23-B 24-B 25-B 26-B 27-A 28-A 29-A 30-B LỜI GIẢI CHI TIẾT
Câu 1: Đáp án A Phương pháp giải:
Học thuộc tên và kí hiệu hóa học tương ứng của kim loại Giải chi tiết: CTHH của nhôm là Al Trang 3
Câu 2: Đáp án C Phương pháp giải:
Học thuộc tên và kí hiệu hóa học tương ứng của axit Giải chi tiết:
CTHH của axit sunfuric là: H2SO4
Câu 3: Đáp án C Phương pháp giải:
Học thuộc tên gọi tương ứng của các oxit, hiđroxit (sgk hóa 8 trang 89) Giải chi tiết: Al2O3: nhôm oxit Al(OH)3: nhôm hiđroxit
Câu 4: Đáp án B Phương pháp giải: Nhôm + oxi → Nhôm oxit Giải chi tiết: 4Al + 3O2 2Al2O3
Câu 5: Đáp án D Phương pháp giải:
Viết phương trình phản ứng, cân bằng phương trình theo phương pháp chẵn lẻ aAl + bCl2 cAlCl3
=> tổng hệ số tối giản của phương trình là: a+b+c Giải chi tiết: 4Al + 3Cl2 2AlCl3
Tổng hệ số tối giản = 4 + 3 + 2 = 9
Câu 6: Đáp án D Phương pháp giải:
Dựa vào tính chất hóa học của Al
+ Tác dụng với dd axit, dd bazo
+ Tác dụng với dd muối của kim loại đứng sau nó trong dãy điện hóa Giải chi tiết:
Al không phản ứng được với NaCl
Câu 7: Đáp án A Phương pháp giải:
Dựa vào tính chất hóa học của kim loại: Từ Mg trở về sau trong dãy điện hóa, kim loại đứng trước đẩy
kim loại đứng sau ra khỏi dung dịch muối của chúng Trang 4
Đề thi cuối kì 1 Hóa học 9 trường Liên cấp THCS, Tiểu học Ngôi Sao
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ 29 Đề thi học kì 1 Hóa học năm 2023 chọn lọc từ các trường bản word có lời giải chi tiết gồm:
+ Đề thi học kì 1 Hóa học năm 2023 trường THCS Trần Quốc Toản – Quận Bình Tân;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Nguyễn Trãi - Thành phố Châu Đốc;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Trường Sa - Thành phố Biên Hòa;
+Đề thi học kì 1 Hóa học năm 2023 Sở GD_ĐT Lạng Sơn.
…..……………………
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(525 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 9
Xem thêmTài liệu bộ mới nhất