Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Ấ T N Ỉ H QU N Ả G BÌNH Năm h c ọ 2022 – 2023
Khoá thi ngày 13 tháng 12 năm 2022 Môn thi: Hoá h c ọ – THCS ĐỀ CHÍNH TH C Ứ Th i
ờ gian: 150 phút (không k t ể h i ờ gian giao đ ) ề (Đề thi g m
ồ có 05 câu 02 trang)
Câu 1. (2,0 điểm) Nêu hi n ệ tư ng ợ và vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra trong các thí nghi m ệ sau: a. Cho Na vào dung d c ị h CuSO4. b. Cho dung d c ị h có ch a ứ a mol KOH vào dung d c ị h có ch a ứ a mol Ba(HSO3)2. c. S c ụ khi H2S vào dung d c ị h Pb(NO3)2. d. Cho dung d c ị h KMnO4 vào dung d c ị h ch a ứ FeSO4 và H2SO4 loãng e. Dẫn khi H2S vào dung d c ị h FeCl3. f. Cho FeO vào dung d c ị h H2SO4 loãng. g. Cho từ t dung d ừ c ị h HCl đ n d ế và ư o dung d c ị h NaAlO2. h. Cho dung d c ị h HCT đặc vào dung d c ị h KMnO4.
Câu 2. (2,0 điểm) 1. H n ỗ h p ợ X g m
ồ BaCO3, Cu, Fe3O4, Al2O3 có số mol b ng ằ nhau. Nung nóng X (trong điều ki n
ệ không có không khí) cho đ n ế khi ph n ả ng ứ x y ả ra hoàn toàn thu đư c ợ ch t ấ r n ắ B và khí C. Cho B vào nư c ớ d , ư sau ph n ả ng ứ thu đư c ợ dung d c ị h E và ch t ấ r n ắ F. S c ụ khí C vào dung d c
ị h E và hòa tan F vào dung d c ị h HCl d . ư Vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ xảy ra.
2. Có 166,5 gam dung d c ị h MSO o
4 41,561% ở 100°C. Hạ nhi t ệ độ dung d c ị h xu ng ố 20 C thì có m1 gam MSO4.5H2O k t ế tinh và còn l i ạ m2 gam dung d c ị h X. Bi t
ế m1 – m2 = 6,5 và độ tan c a
ủ MSO4 ở 20°C là 20,92 gam trong 100 gam H2O. Xác đ nh ị công th c ứ mu i ố MSO4.
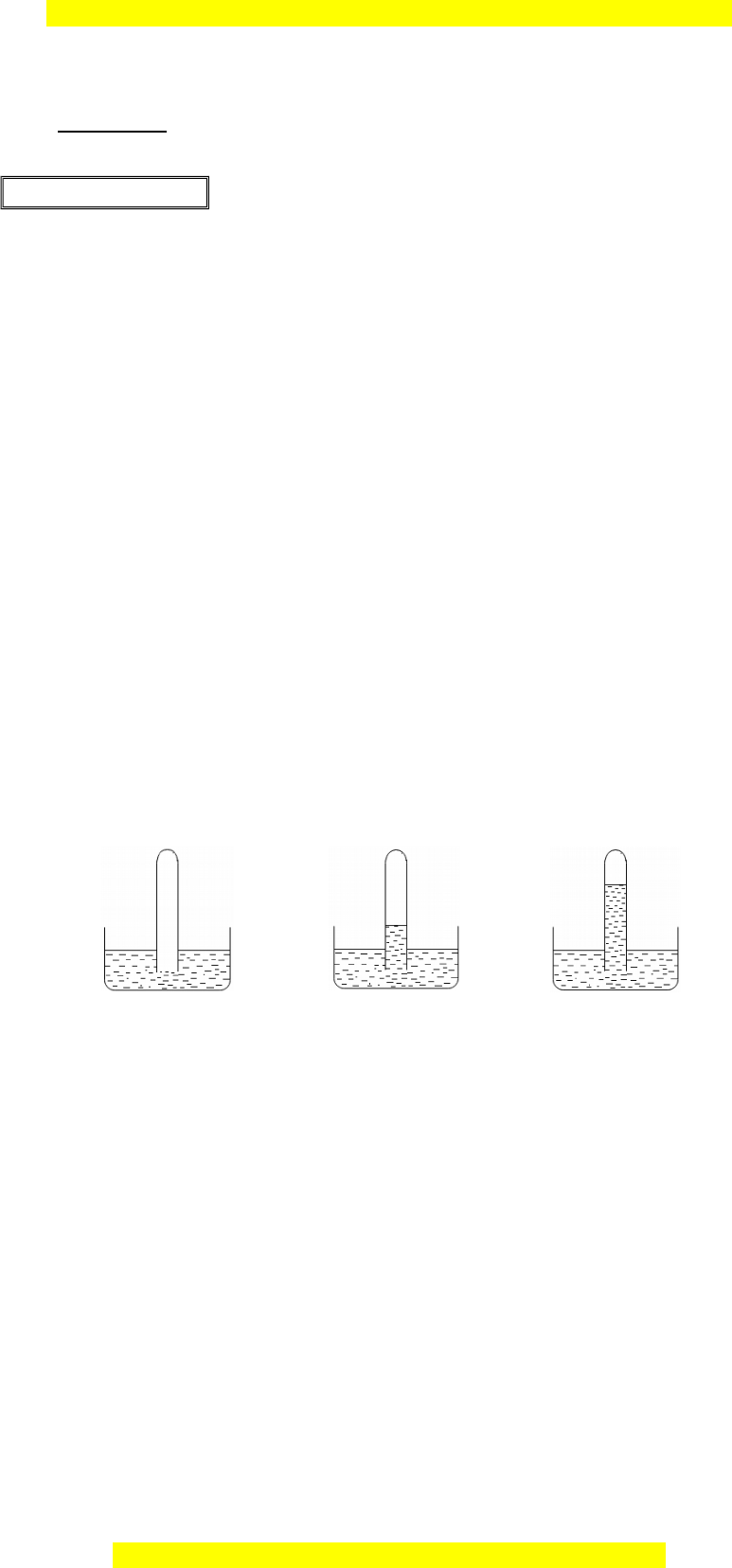
Câu 3. (2,0 điểm) 1. Có 3 ng ố nghi m ệ A, B, C, m i ỗ ng ố đ ng ự m t ộ trong các ch t ấ khí HCl, SO2, N2. Các ng ố nghi m ệ đư c ợ úp vào các chậu nư c ớ và có hi n t ệ ư ng ợ đư c ợ mô t nh ả hì ư nh v s ẽ au: A B C a. Xác đ nh c ị hất khí trong t ng ừ ng ố nghi m ệ , gi i ả thích. b. M c ự chất l ng ỏ trong ng ố nghi m ệ B thay đ i ổ như thế nào (so v i ớ m c ự nư c ớ ban đ u) ầ khi thay nư c ớ trong ch u ậ có ng ố nghi m ệ B b ng ằ nư c
ớ brôm có thể tích tư ng ơ đư ng? ơ Gi i ả thích? 2. Trình bày phư ng ơ pháp hóa h c ọ và vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra (nếu có) để tinh ch c
ế ác chất trong các trư ng ờ h p s ợ au: a. Tinh ch khí ế Cl2 có lẫn khí HCl b. Tinh ch khí ế CO2 có lần khí CO. c. Tinh ch N ế aCl có lẫn Na2SO4. 3. Từ mu i ố ăn nguyên ch t ấ và nư c ớ c t
ấ , hãy tính toán và nêu cách pha chế 0,5 lít nư c ớ mu i ố sinh lí. Bi t ế nư c ớ mu i ố sinh lí là dung d c ị h NaCl 0,9% (kh i ố lư ng ợ riêng là 1,009 g/cm3).
Câu 4. (2,0 điểm) 1. Cho 7,65 gam h n ỗ h p ợ X g m
ồ Al và Mg tan hoàn toàn trong 500 ml dung d c ị h H2SO4 0,8M, thu đư c ợ dung d c
ị h Y và 8,4 lít khí H2 (đktc). Cho 850 ml dung d c ị h NaOH 1M vào dung d c
ị h Y, sau khi các phản ng
ứ xảy ra hoàn toàn thu đư c ợ m gam k t ế t a ủ . Tính giá tr c ị a ủ m. 2. H n ỗ h p ợ X g m
ồ MgCl2, NaF, NaBr. Hoà tan hoàn toàn 33,35 gam X vào nư c ớ đư c ợ dung d c ị h Y. Cho dung d c ị h Y ph n ả ng ứ v i ớ 500 ml dung d c ị h AgNO3 n ng ồ độ 1,0M th y ấ t o ạ thành 56,9 gam k t ế t a ủ . L c ọ bỏ k t ế t a ủ thu đư c ợ dung d c ị h, cho ti p ế vào dung d c ị h đó m t ộ lư ng ợ magie kim loại d , khu ư ấy kĩ, sau phản ng t ứ hấy kh i ố lư ng ki ợ m lo i ạ tăng 14,4 gam. a. Vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ra ả . M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) b. Tính phần trăm v kh ề i ố lư ng ợ các mu i ố trong h n h ỗ p X ợ .
Câu 5. (2,0 điểm) 1. H n ỗ h p ợ A g m
ồ Na, Al, Fe. Hoà tan 2,16 gam A vào nư c ớ d , ư thu đư c ợ 0,448 lít khí ở đktc và còn l i ạ ch t ấ r n ắ B. Cho B ph n ả ng ứ h t ế v i ớ 60 ml dung d c ị h CuSO4 1M thu đư c ợ 3,2 gam Cu và dung d c ị h C. Cho C ph n ả ng ứ v i ớ dung d c ị h NaOH thu đư c ợ k t ế t a ủ l n ớ nh t ấ . Nung kết t a ủ trong không khí đ n ế kh i ố lư ng ợ không đ i ổ thu đư c ợ m gam ch t ấ r n ắ E. Tính ph n ầ trăm về kh i ố lư ng
ợ các chất trong A và giá trị m. 2. Chia 15,0 gam m t ộ mu i ố sunfua c a ủ kim lo i
ạ R (có hóa trị không đ i ổ ) làm hai ph n. ầ Phần 1 tác d ng ụ v i ớ dung d c ị h HCl dư t o ạ ra khí A. Ph n ầ 2 đ t ố cháy h t ế trong oxi v a ừ đ ủ thu đư c ợ khí B. Tr n ộ hai khí A và B v i ớ nhau thì thu đư c ợ 5,76 gam ch t ấ r n ắ và m t ộ khí d ư thoát ra. Dùng m t ộ lư ng ợ NaOH (trong dung d c ị h) t i ố thi u ể đ ể h p ấ th ụ v a ừ h t ế lư ng ợ khí d ư này thì thu đư c ợ 6,72 gam mu i ố . Hãy xác đ nh ị tên kim lo i ạ R. Bi t ế các ph n ả ng đ ứ u x ề y ra ả hoàn toàn. Cho nguyên t k ử h i
ố : H = 1; C = 12; N = 14; O = 16; F = 19; Na = 23; Mg = 24; Al = 27;
Si = 28; S = 32; Cl = 35,5; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137.
-------------------- H t
ế -------------------- HƯ N Ớ G D N Ẫ GI I Ả :
Câu 1. (2,0 điểm) Nêu hi n ệ tư ng ợ và vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra trong các thí nghi m ệ sau: a. Cho Na vào dung d c ị h CuSO4. b. Cho dung d c ị h có ch a ứ a mol KOH vào dung d c ị h có ch a ứ a mol Ba(HSO3)2. c. S c ụ khi H2S vào dung d c ị h Pb(NO3)2. d. Cho dung d c ị h KMnO4 vào dung d c ị h ch a ứ FeSO4 và H2SO4 loãng e. Dẫn khi H2S vào dung d c ị h FeCl3. f. Cho FeO vào dung d c ị h H2SO4 loãng. g. Cho từ t dung d ừ c ị h HCl đ n d ế và ư o dung d c ị h NaAlO2. h. Cho dung d c ị h HCT đặc vào dung d c ị h KMnO4. HƯ N Ớ G D N Ẫ a. Cho Na vào dung d c ị h CuSO4. 2Na + 2H2O 2NaOH + H2
2NaOH + CuSO4 Cu(OH)2 + Na2SO4 Hi n t ệ ư ng: ợ Viên Na (sodium) tan d n, s ầ i ủ b t ọ khí và k t ế t a ủ xanh lam (xanh l ) ơ b. Cho dung d c ị h có ch a ứ a mol KOH vào dung d c ị h có ch a ứ a mol Ba(HSO3)2.
KOH + Ba(HSO3)2 BaSO3 + KHSO3 + H2O Hi n t ệ ư ng: ợ xuất hi n ệ k t ế t a ủ tr ng ắ c. S c ụ khi H2S vào dung d c ị h Pb(NO3)2. H2S + Pb(NO3)2 PbS + 2HNO3 Hi n t ệ ư ng: ợ xuất hi n ệ k t ế t a ủ đen d. Cho dung d c ị h KMnO4 vào dung d c ị h ch a ứ FeSO4 và H2SO4 loãng
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O Hi n t ệ ư ng: ợ nhạt màu thu c ố tím e. Dẫn khi H2S vào dung d c ị h FeCl3.
H2S + 2FeCl3 S + 2FeCl2 + 2HCl Hi n t ệ ư ng: ợ xuất hi n ệ k t ế t a ủ vàng f. Cho FeO vào dung d c ị h H2SO4 loãng.
FeO + H2SO4 loãng FeSO4 + H2O Hi n t ệ ư ng: ợ FeO tan t o t ạ hành dung d c ị h xanh nh t ạ g. Cho từ t dung d ừ c ị h HCl đ n d ế và ư o dung d c ị h NaAlO2.
HCl + NaAlO2 + H2O NaCl + Al(OH)3
Al(OH)3 + 3HCl AlCl3 + 3H2O Hi n t ệ ư ng: ợ k t ế t a ủ keo tr ng đ ắ n c ế c ự đ i ạ sau đó tan d n t ầ hành dung d c ị h trong su t ố h. Cho dung d c ị h HCl đặc vào dung d c ị h KMnO4.
2KMnO4 + 16HCl đặc 2KCl + 2MnCl2 + 5Cl2 + 8H2O Hi n t ệ ư ng: ợ Khí thoát ra có mùi x c ố . M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả )
Câu 2. (2,0 điểm) 1. H n ỗ h p ợ X g m
ồ BaCO3, Cu, Fe3O4, Al2O3 có số mol b ng ằ nhau. Nung nóng X (trong điều ki n
ệ không có không khí) cho đ n ế khi ph n ả ng ứ x y ả ra hoàn toàn thu đư c ợ ch t ấ r n ắ B và khí C. Cho B vào nư c ớ d , ư sau ph n ả ng ứ thu đư c ợ dung d c ị h E và ch t ấ r n ắ F. S c ụ khí C vào dung d c
ị h E và hòa tan F vào dung d c ị h HCl d . ư Vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ xảy ra.
2. Có 166,5 gam dung d c ị h MSO o
4 41,561% ở 100°C. Hạ nhi t ệ độ dung d c ị h xu ng ố 20 C thì có m1 gam MSO4.5H2O k t ế tinh và còn l i ạ m2 gam dung d c ị h X. Bi t
ế m1 – m2 = 6,5 và độ tan c a
ủ MSO4 ở 20°C là 20,92 gam trong 100 gam H2O. Xác đ nh ị công th c ứ mu i ố MSO4. HƯ N Ớ G D N Ẫ 1. Giả s c ử ác chất trong h n h ỗ p ợ X đ u l ề à 1 mol Nung nóng X trong đi u ki ề n không c ệ ó không khí: BaCO3 o t BaO + CO2 Chất rắn B g m
ồ : BaO (1 mol); Cu (1 mol); Fe3O4 (1 mol); Al2O3 (1 mol) Khí C: CO2 (1 mol) Cho B vào nư c ớ : BaO + H2O Ba(OH)2
Ba(OH)2 + Al2O3 Ba(AlO2)2 + H2O Dung d c ị h E: Ba(AlO2)2 (1 mol)
Rắn F: Cu (1 mol); Fe3O4 (1 mol) S c ụ khí C vào dung d c ị h E:
2CO2 + Ba(AlO2)2 + 4H2O 2Al(OH)3 + Ba(HCO3)2 1 mol 1 mol 1 mol 0,5 mol 1 mol 0,5 mol 0 0,5 mol Dung d c ị h sau phản ng s ứ c
ẽ ó: Ba(AlO2)2 0,5 mol và Ba(HCO3)2 0,5 mol Hòa tan F vào dung d c ị h HCl dư
Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O Cu + 2FeCl3 CuCl2 + 2FeCl2 2. Theo đ t ề a có: m m 1 66,5 m 86 ,5 1 2 1 1 m m2 6 ,5 m2 8 0 41,561 *Ở o 100 C : m 1 66,5 69 , 2 (g) MSO4 100 m 166 ,5 69, 2 97, 3 (g) H2O m *Ở o 20 C : 1 n (mol) MSO4.5H2O M 186 90m1 m (g) H2O tach ra M 186 90m Kh i ố lư ng ợ nư c ớ còn l i ạ trong dung d c ị h ở o 20 C là: 1 97,3 (g) M 186 Cứ 100 gam nư c ớ thì hòa tan đư c ợ 20,92 gam MSO4 90m 90m 20,92 Cứ 1 97,3 (g) H 1 2O thì hòa tan đư c ợ 97,3 (g) MSO4 M 186 M 186 100 m (M 96) 90m 20,92 Bảo toàn kh i ố lư ng ợ MSO 69, 2 97,3 4 ta có: 1 1 M 186 M 186 100 86,5(M 96) 90 86 , 5 20,92 69, 2 97, 3 M 186 M 186 100 M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) M 6 4 (g / mol) Kim loại M là Cu Vậy công th c ứ mu i ố là CuSO4.
Câu 3. (2,0 điểm) 1. Có 3 ng ố nghi m ệ A, B, C, m i ỗ ng ố đ ng ự m t ộ trong các ch t ấ khí HCl, SO2, N2. Các ng ố nghi m ệ đư c ợ úp vào các chậu nư c ớ và có hi n t ệ ư ng ợ đư c ợ mô t nh ả hì ư nh v s ẽ au: A B C a. Xác đ nh c ị hất khí trong t ng ừ ng ố nghi m ệ , gi i ả thích. b. M c ự chất l ng ỏ trong ng ố nghi m ệ B thay đ i ổ như thế nào (so v i ớ m c ự nư c ớ ban đ u) ầ khi thay nư c ớ trong ch u ậ có ng ố nghi m ệ B b ng ằ nư c
ớ brôm có thể tích tư ng ơ đư ng? ơ Gi i ả thích? 2. Trình bày phư ng ơ pháp hóa h c ọ và vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra (nếu có) để tinh ch c
ế ác chất trong các trư ng ờ h p s ợ au: a. Tinh ch khí ế Cl2 có lẫn khí HCl b. Tinh ch khí ế CO2 có lần khí CO. c. Tinh ch N ế aCl có lẫn Na2SO4. 3. Từ mu i ố ăn nguyên ch t ấ và nư c ớ c t
ấ , hãy tính toán và nêu cách pha chế 0,5 lít nư c ớ mu i ố sinh lí. Bi t ế nư c ớ mu i ố sinh lí là dung d c ị h NaCl 0,9% (kh i ố lư ng ợ riêng là 1,009 g/cm3). HƯ N Ớ G D N Ẫ 1. a. Chất khí trong ng ố nghi m ệ C là HCl, vì HCl tan r t ấ t t ố trong nư c ớ nên áp su t ấ trong ng ố nghi m ệ C s gi ẽ ảm nhanh, do đó lư ng ợ nư c ớ s dâ ẽ ng lên nhi u nh ề t ấ . Chất khí trong ng nghi ố m
ệ B là SO2, do SO2 tan ít trong nư c ớ nên lư ng ợ nư c ớ dâng lên ít h n. ơ Chất khí trong ng nghi ố m
ệ B là N2, do N2 không tan trong nư c ớ . b. Do SO2 phản ng ứ v i ớ dung d c ị h Br2 nên áp su t ấ trong ng ố nghi m ệ C gi m ả , do đó lư ng ợ nư c ớ trong ng nghi ố m ệ B s dâ ẽ ng lên cao.
PTHH: SO2 + Br2 + 2H2O H2SO4 + 2HBr 2.
a. Dẫn khí Cl2 có lẫn HCl vào bình ch a ứ dung d c ị h NaCl bão hòa. b. D n
ẫ khí CO2 có lẫn CO vào lư ng ợ dư dung d c ị h Ca(OH)2. L c ọ l y ấ k t ế t a ủ r i ồ cho k t ế t a ủ tác d ng ụ v i ớ lư ng ợ d dung d ư c ị h HCl, thu đư c ợ khí CO2.
PTHH: CO2 + Ca(OH)2 CaCO3 + H2O
CaCO3 + 2HCl CaCl2 + CO2 + H2O c. Hòa tan NaCl có l n ẫ Na2SO4 vào nư c ớ ta đư c ợ dung d c ị h X. Cho dung d c ị h X thu đư c ợ tác d ng ụ v i ớ lư ng ợ d ư dung d c ị h BaCl2, l c ọ b ỏ k t ế t a ủ ta thu đư c ợ dung d c ị h Y. Cho Y tác d ng ụ v i ớ lư ng ợ dư dung d c ị h Na2CO3, l c ọ bỏ k t ế t a ủ ta thu đư c ợ dung d c ị h Z. Cho lư ng ợ dư dung d c ị h HCl vào dung d c
ị h Z, sau đó cô c n dung d ạ c ị h sau ph n ả ng t ứ a thu đư c ợ NaCl tinh khi t ế .
PTHH: BaCl2 + Na2SO4 BaSO4 + 2NaCl
BaCl2 + Na2CO3 BaCO3 + 2NaCl
BaCO3 + 2HCl BaCl2 + CO2 + H2O 3. m 500 1 , 009 504 ,5 (g) dd NaCl 504,5.0,9 m 4 , 5405 (g) NaCl 100 m 504 ,5 4,5405 499 ,9595 (g) H2O Do kh i ố lư ng ợ riêng c a ủ nư c ớ là 1 g/ml nên V 4 99, 9595 (mL) H2O Cách pha ch :
ế Cân chính xác 4,5405 gam mu i ố NaCl cho vào c c ố th y
ủ tinh 1000 mL, sau đó đong 499,9595 mL nư c ớ cho vào, khuấy đ u. ề M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 9 Sở Quảng Bình năm 2023 có đáp án
3.4 K
1.7 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 9 Sở Quảng Bình năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(3366 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 9
Xem thêmTài liệu bộ mới nhất
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
QU NG BÌNHẢ
KỲ THI CH N H C SINH GI I C P T NHỌ Ọ Ỏ Ấ Ỉ
Năm h c 2022 – 2023ọ
Khoá thi ngày 13 tháng 12 năm 2022
Đ CHÍNH TH CỀ Ứ
(Đ thi g m có 05 câu 02 trang)ề ồ
Môn thi: Hoá h c – THCSọ
Th i gianờ : 150 phút (không k th i gian giao đ )ể ờ ề
Câu 1. (2,0 đi m)ể
Nêu hi n t ng và vi t ph ng trình hóa h c c a các ph n ng x y ra trong các thíệ ượ ế ươ ọ ủ ả ứ ả
nghi m sau:ệ
a. Cho Na vào dung d ch CuSOị
4
.
b. Cho dung d ch có ch a a mol KOH vào dung d ch có ch a a mol Ba(HSOị ứ ị ứ
3
)
2
.
c. S c khi Hụ
2
S vào dung d ch Pb(NOị
3
)
2
.
d. Cho dung d ch KMnOị
4
vào dung d ch ch a FeSOị ứ
4
và H
2
SO
4
loãng
e. D n khi Hẫ
2
S vào dung d ch FeClị
3
.
f. Cho FeO vào dung d ch Hị
2
SO
4
loãng.
g. Cho t t dung d ch HCl đ n d vào dung d ch NaAlOừ ừ ị ế ư ị
2
.
h. Cho dung d ch HCT đ c vào dung d ch KMnOị ặ ị
4
.
Câu 2. (2,0 đi m) ể
1. H n h p X g m BaCOỗ ợ ồ
3
, Cu, Fe
3
O
4
, Al
2
O
3
có s mol b ng nhau. Nung nóng X (trongố ằ
đi u ki n không có không khí) cho đ n khi ph n ng x y ra hoàn toàn thu đ c ch t r n B vàề ệ ế ả ứ ả ượ ấ ắ
khí C. Cho B vào n c d , sau ph n ng thu đ c dung d ch E và ch t r n F. S c khí C vàoướ ư ả ứ ượ ị ấ ắ ụ
dung d ch E và hòa tan F vào dung d ch HCl d . Vi t ph ng trình hóa h c c a các ph n ngị ị ư ế ươ ọ ủ ả ứ
x y ra.ả
2. Có 166,5 gam dung d ch MSOị
4
41,561% 100°C. H nhi t đ dung d ch xu ng 20ở ạ ệ ộ ị ố
o
C
thì có m
1
gam MSO
4
.5H
2
O k t tinh và còn l i mế ạ
2
gam dung d ch X. Bi t mị ế
1
– m
2
= 6,5 và đ tanộ
c a MSOủ
4
20°C là 20,92 gam trong 100 gam Hở
2
O. Xác đ nh công th c mu i MSOị ứ ố
4
.
Câu 3. (2,0 đi m)ể
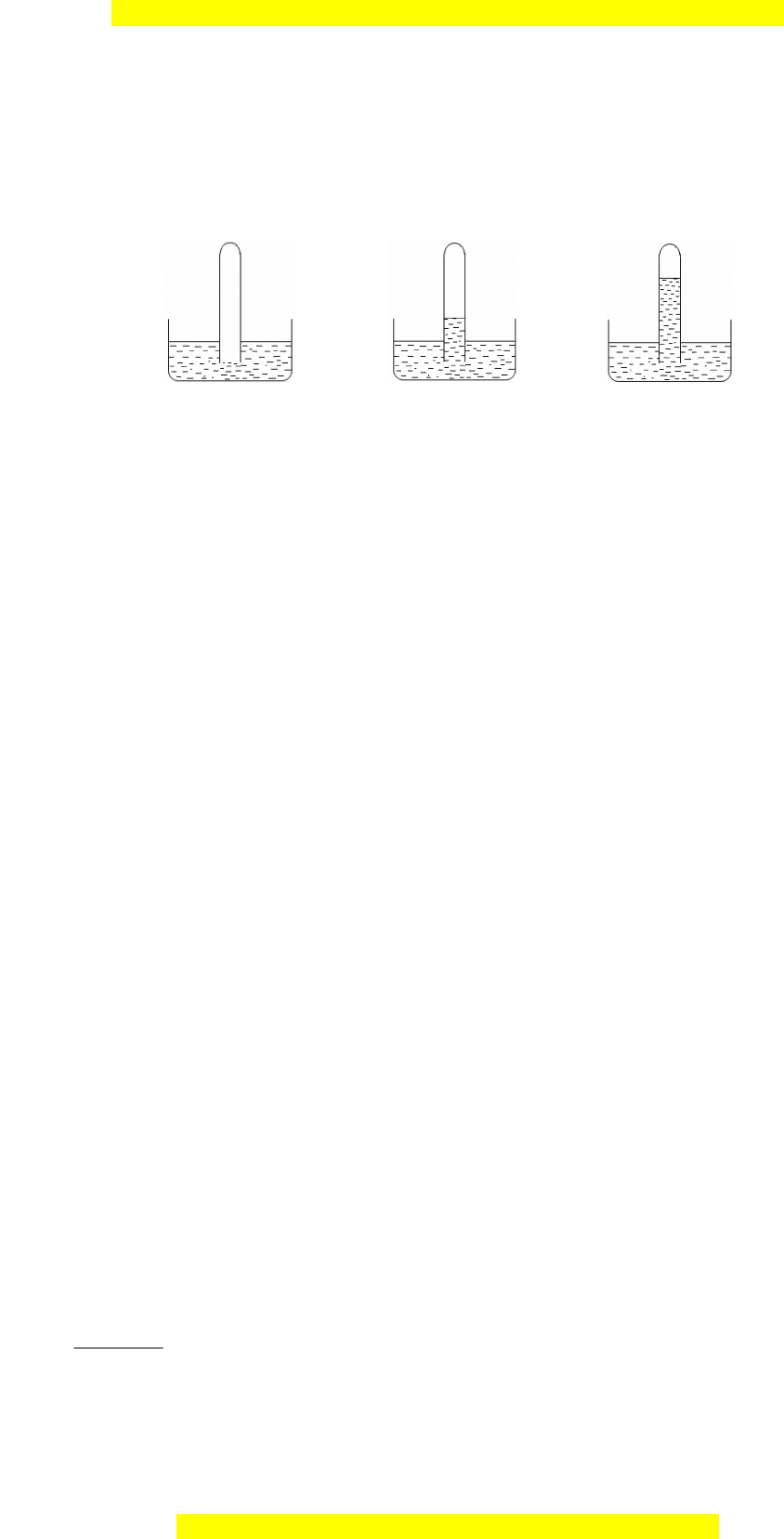
1. Có 3 ng nghi m A, B, C, m i ng đ ng m t trong các ch t khí HCl, SOố ệ ỗ ố ự ộ ấ
2
, N
2
. Các ngố
nghi m đ c úp vào các ch u n c và có hi n t ng đ c mô t nh hình v sauệ ượ ậ ướ ệ ượ ượ ả ư ẽ :
A B C
a. Xác đ nh ch t khí trong t ng ng nghi m, gi i thích.ị ấ ừ ố ệ ả
b. M c ch t l ng trong ng nghi m B thay đ i nh th nào (so v i m c n c ban đ u)ự ấ ỏ ố ệ ổ ư ế ớ ự ướ ầ
khi thay n c trong ch u có ng nghi m B b ng n c brôm có th tích t ng đ ng? Gi iướ ậ ố ệ ằ ướ ể ươ ươ ả
thích?
2. Trình bày ph ng pháp hóa h c và vi t ph ng trình hóa h c c a các ph n ng x y raươ ọ ế ươ ọ ủ ả ứ ả
(n u có) đ tinh ch các ch t trong các tr ng h p sau:ế ể ế ấ ườ ợ
a. Tinh ch khí Clế
2
có l n khí HClẫ
b. Tinh ch khí COế
2
có l n khí CO.ầ
c. Tinh ch NaCl có l n Naế ẫ
2
SO
4
.
3. T mu i ăn nguyên ch t và n c c t, hãy tính toán và nêu cách pha ch 0,5 lít n cừ ố ấ ướ ấ ế ướ
mu i sinh lí. Bi t n c mu i sinh lí là dung d ch NaCl 0,9% (kh i l ng riêng là 1,009 g/cmố ế ướ ố ị ố ượ
3
).
Câu 4. (2,0 đi m)ể
1. Cho 7,65 gam h n h p X g m Al và Mg tan hoàn toàn trong 500 ml dung d ch Hỗ ợ ồ ị
2
SO
4
0,8M, thu đ c dung d ch Y và 8,4 lít khí Hượ ị
2
(đktc). Cho 850 ml dung d ch NaOH 1M vào dungị
d ch Y, sau khi các ph n ng x y ra hoàn toàn thu đ c m gam k t t a. Tính giá tr c a m.ị ả ứ ả ượ ế ủ ị ủ
2. H n h p X g m MgClỗ ợ ồ
2
, NaF, NaBr. Hoà tan hoàn toàn 33,35 gam X vào n c đ cướ ượ
dung d ch Y. Cho dung d ch Y ph n ng v i 500 ml dung d ch AgNOị ị ả ứ ớ ị
3
n ng đ 1,0M th y t oồ ộ ấ ạ
thành 56,9 gam k t t a. L c b k t t a thu đ c dung d ch, cho ti p vào dung d ch đó m tế ủ ọ ỏ ế ủ ượ ị ế ị ộ
l ng magie kim lo i d , khu y kĩ, sau ph n ng th y kh i l ng kim lo i tăng 14,4 gam.ượ ạ ư ấ ả ứ ấ ố ượ ạ
a. Vi t ph ng trình hóa h c c a các ph n ng x y ra.ế ươ ọ ủ ả ứ ả
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
b. Tính ph n trăm v kh i l ng các mu i trong h n h p X.ầ ề ố ượ ố ỗ ợ
Câu 5. (2,0 đi m) ể
1. H n h p A g m Na, Al, Fe. Hoà tan 2,16 gam A vào n c d , thu đ c 0,448 lít khí ỗ ợ ồ ướ ư ượ ở
đktc và còn l i ch t r n B. Cho B ph n ng h t v i 60 ml dung d ch CuSOạ ấ ắ ả ứ ế ớ ị
4
1M thu đ c 3,2ượ
gam Cu và dung d ch C. Cho C ph n ng v i dung d ch NaOH thu đ c k t t a l n nh t. Nungị ả ứ ớ ị ượ ế ủ ớ ấ
k t t a trong không khí đ n kh i l ng không đ i thu đ c m gam ch t r n E. Tính ph n trămế ủ ế ố ượ ổ ượ ấ ắ ầ
v kh i l ng các ch t trong A và giá tr m.ề ố ượ ấ ị
2. Chia 15,0 gam m t mu i sunfua c a kim lo i R (có hóa tr không đ i) làm hai ph n.ộ ố ủ ạ ị ổ ầ
Ph n 1 tác d ng v i dung d ch HCl d t o ra khí A. Ph n 2 đ t cháy h t trong oxi v a đ thuầ ụ ớ ị ư ạ ầ ố ế ừ ủ
đ c khí B. Tr n hai khí A và B v i nhau thì thu đ c 5,76 gam ch t r n và m t khí d thoát ra.ượ ộ ớ ượ ấ ắ ộ ư
Dùng m t l ng NaOH (trong dung d ch) t i thi u đ h p th v a h t l ng khí d này thì thuộ ượ ị ố ể ể ấ ụ ừ ế ượ ư
đ c 6,72 gam mu i. Hãy xác đ nh tên kim lo i R. Bi t các ph n ng đ u x y ra hoàn toàn.ượ ố ị ạ ế ả ứ ề ả
Cho nguyên t kh iử ố : H = 1; C = 12; N = 14; O = 16; F = 19; Na = 23; Mg = 24; Al = 27;
Si = 28; S = 32; Cl = 35,5; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137.
-------------------- H tế --------------------
H NG D N GI I:ƯỚ Ẫ Ả
Câu 1. (2,0 đi m)ể
Nêu hi n t ng và vi t ph ng trình hóa h c c a các ph n ng x y ra trong các thíệ ượ ế ươ ọ ủ ả ứ ả
nghi m sau:ệ
a. Cho Na vào dung d ch CuSOị
4
.
b. Cho dung d ch có ch a a mol KOH vào dung d ch có ch a a mol Ba(HSOị ứ ị ứ
3
)
2
.
c. S c khi Hụ
2
S vào dung d ch Pb(NOị
3
)
2
.
d. Cho dung d ch KMnOị
4
vào dung d ch ch a FeSOị ứ
4
và H
2
SO
4
loãng
e. D n khi Hẫ
2
S vào dung d ch FeClị
3
.
f. Cho FeO vào dung d ch Hị
2
SO
4
loãng.
g. Cho t t dung d ch HCl đ n d vào dung d ch NaAlOừ ừ ị ế ư ị
2
.
h. Cho dung d ch HCT đ c vào dung d ch KMnOị ặ ị
4
.
H NG D NƯỚ Ẫ
a. Cho Na vào dung d ch CuSOị
4
.
2Na + 2H
2
O
2NaOH + H
2
2NaOH + CuSO
4
Cu(OH)
2
+ Na
2
SO
4
Hi n t ng: Viên Na (sodium) tan d n, s i b t khí và k t t a xanh lam (xanh l )ệ ượ ầ ủ ọ ế ủ ơ
b. Cho dung d ch có ch a a mol KOH vào dung d ch có ch a a mol Ba(HSOị ứ ị ứ
3
)
2
.
KOH + Ba(HSO
3
)
2
BaSO
3
+ KHSO
3
+ H
2
O
Hi n t ng: xu t hi n k t t a tr ngệ ượ ấ ệ ế ủ ắ
c. S c khi Hụ
2
S vào dung d ch Pb(NOị
3
)
2
.
H
2
S + Pb(NO
3
)
2
PbS + 2HNO
3
Hi n t ng: xu t hi n k t t a đenệ ượ ấ ệ ế ủ
d. Cho dung d ch KMnOị
4
vào dung d ch ch a FeSOị ứ
4
và H
2
SO
4
loãng
10FeSO
4
+ 2KMnO
4
+ 8H
2
SO
4
5Fe
2
(SO
4
)
3
+ K
2
SO
4
+ 2MnSO
4
+ 8H
2
O
Hi n t ng: nh t màu thu c tímệ ượ ạ ố
e. D n khi Hẫ
2
S vào dung d ch FeClị
3
.
H
2
S + 2FeCl
3
S + 2FeCl
2
+ 2HCl
Hi n t ng: xu t hi n k t t a vàngệ ượ ấ ệ ế ủ
f. Cho FeO vào dung d ch Hị
2
SO
4
loãng.
FeO + H
2
SO
4 loãng
FeSO
4
+ H
2
O
Hi n t ng: FeO tan t o thành dung d ch xanh nh tệ ượ ạ ị ạ
g. Cho t t dung d ch HCl đ n d vào dung d ch NaAlOừ ừ ị ế ư ị
2
.
HCl + NaAlO
2
+ H
2
O
NaCl + Al(OH)
3
Al(OH)
3
+ 3HCl
AlCl
3
+ 3H
2
O
Hi n t ng: k t t a keo tr ng đ n c c đ i sau đó tan d n thành dung d ch trong su tệ ượ ế ủ ắ ế ự ạ ầ ị ố
h. Cho dung d ch HCl đ c vào dung d ch KMnOị ặ ị
4
.
2KMnO
4
+ 16HCl
đ cặ
2KCl + 2MnCl
2
+ 5Cl
2
+ 8H
2
O
Hi n t ng: Khí thoát ra có mùi x c.ệ ượ ố
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Câu 2. (2,0 đi m) ể
1. H n h p X g m BaCOỗ ợ ồ
3
, Cu, Fe
3
O
4
, Al
2
O
3
có s mol b ng nhau. Nung nóng X (trongố ằ
đi u ki n không có không khí) cho đ n khi ph n ng x y ra hoàn toàn thu đ c ch t r n B vàề ệ ế ả ứ ả ượ ấ ắ
khí C. Cho B vào n c d , sau ph n ng thu đ c dung d ch E và ch t r n F. S c khí C vàoướ ư ả ứ ượ ị ấ ắ ụ
dung d ch E và hòa tan F vào dung d ch HCl d . Vi t ph ng trình hóa h c c a các ph n ngị ị ư ế ươ ọ ủ ả ứ
x y ra.ả
2. Có 166,5 gam dung d ch MSOị
4
41,561% 100°C. H nhi t đ dung d ch xu ng 20ở ạ ệ ộ ị ố
o
C
thì có m
1
gam MSO
4
.5H
2
O k t tinh và còn l i mế ạ
2
gam dung d ch X. Bi t mị ế
1
– m
2
= 6,5 và đ tanộ
c a MSOủ
4
20°C là 20,92 gam trong 100 gam Hở
2
O. Xác đ nh công th c mu i MSOị ứ ố
4
.
H NG D NƯỚ Ẫ
1. Gi s các ch t trong h n h p X đ u là 1 molả ử ấ ỗ ợ ề
Nung nóng X trong đi u ki n không có không khí:ề ệ
BaCO
3
o
t
BaO + CO
2
Ch t r n B g m: BaO (1 mol); Cu (1 mol); Feấ ắ ồ
3
O
4
(1 mol); Al
2
O
3
(1 mol)
Khí C: CO
2
(1 mol)
Cho B vào n c:ướ
BaO + H
2
O
Ba(OH)
2
Ba(OH)
2
+ Al
2
O
3
Ba(AlO
2
)
2
+ H
2
O
Dung d ch E: Ba(AlOị
2
)
2
(1 mol)
R n F: Cu (1 mol); Feắ
3
O
4
(1 mol)
S c khí C vào dung d ch E: ụ ị
2CO
2
+ Ba(AlO
2
)
2
+ 4H
2
O
2Al(OH)
3
+ Ba(HCO
3
)
2
1 mol 1 mol
1 mol 0,5 mol 1 mol 0,5 mol
0 0,5 mol
Dung d ch sau ph n ng s có: Ba(AlOị ả ứ ẽ
2
)
2
0,5 mol và Ba(HCO
3
)
2
0,5 mol
Hòa tan F vào dung d ch HCl dị ư
Fe
3
O
4
+ 8HCl
FeCl
2
+ 2FeCl
3
+ 4H
2
O
Cu + 2FeCl
3
CuCl
2
+ 2FeCl
2
2.
Theo đ ta có:ề
1 2
1 2
m m 166,5
m m 6,5
1
2
m 86,5
m 80
* Ở
o
100 C
:
4
MSO
41,561
m 166,5 69, 2 (g)
100
* Ở
o
20 C
:
4 2
1
MSO .5H O
m
n (mol)
M 186
2
1
H O tach ra
90m
m (g)
M 186
Kh i l ng n c còn l i trong dung d ch ố ượ ướ ạ ị ở
o
20 C
là:
1
90m
97,3 (g)
M 186
C 100 gam n c thì hòa tan đ c 20,92 gam MSOứ ướ ượ
4
C ứ
1
90m
97,3 (g)
M 186
H
2
O thì hòa tan đ c ượ
1
90m 20,92
97,3 (g)
M 186 100
MSO
4
B o toàn kh i l ng MSOả ố ượ
4
ta có:
1 1
m (M 96) 90m 20,92
69, 2 97,3
M 186 M 186 100
86,5(M 96) 90 86,5 20,92
69, 2 97,3
M 186 M 186 100
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
2
H O
m 166,5 69,2 97,3 (g)
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
M 64 (g / mol)
Kim lo i M là Cuạ
V y công th c mu i là CuSOậ ứ ố
4
.
Câu 3. (2,0 đi m)ể
1. Có 3 ng nghi m A, B, C, m i ng đ ng m t trong các ch t khí HCl, SOố ệ ỗ ố ự ộ ấ
2
, N
2
. Các ngố
nghi m đ c úp vào các ch u n c và có hi n t ng đ c mô t nh hình v sauệ ượ ậ ướ ệ ượ ượ ả ư ẽ :
A B C
a. Xác đ nh ch t khí trong t ng ng nghi m, gi i thích.ị ấ ừ ố ệ ả
b. M c ch t l ng trong ng nghi m B thay đ i nh th nào (so v i m c n c ban đ u)ự ấ ỏ ố ệ ổ ư ế ớ ự ướ ầ
khi thay n c trong ch u có ng nghi m B b ng n c brôm có th tích t ng đ ng? Gi iướ ậ ố ệ ằ ướ ể ươ ươ ả
thích?
2. Trình bày ph ng pháp hóa h c và vi t ph ng trình hóa h c c a các ph n ng x y raươ ọ ế ươ ọ ủ ả ứ ả
(n u có) đ tinh ch các ch t trong các tr ng h p sau:ế ể ế ấ ườ ợ
a. Tinh ch khí Clế
2
có l n khí HClẫ
b. Tinh ch khí COế
2
có l n khí CO.ầ
c. Tinh ch NaCl có l n Naế ẫ
2
SO
4
.
3. T mu i ăn nguyên ch t và n c c t, hãy tính toán và nêu cách pha ch 0,5 lít n cừ ố ấ ướ ấ ế ướ
mu i sinh lí. Bi t n c mu i sinh lí là dung d ch NaCl 0,9% (kh i l ng riêng là 1,009 g/cmố ế ướ ố ị ố ượ
3
).
H NG D NƯỚ Ẫ
1.
a. Ch t khí trong ng nghi m C là HCl, vì HCl tan r t t t trong n c nên áp su t trong ngấ ố ệ ấ ố ướ ấ ố
nghi m C s gi m nhanh, do đó l ng n c s dâng lên nhi u nh t.ệ ẽ ả ượ ướ ẽ ề ấ
Ch t khí trong ng nghi m B là SOấ ố ệ
2
, do SO
2
tan ít trong n c nên l ng n c dâng lên ít h n.ướ ượ ướ ơ
Ch t khí trong ng nghi m B là Nấ ố ệ
2
, do N
2
không tan trong n c.ướ
b. Do SO
2
ph n ng v i dung d ch Brả ứ ớ ị
2
nên áp su t trong ng nghi m C gi m, do đó l ng n cấ ố ệ ả ượ ướ
trong ng nghi m B s dâng lên cao.ố ệ ẽ
PTHH: SO
2
+ Br
2
+ 2H
2
O
H
2
SO
4
+ 2HBr
2.
a. D n khí Clẫ
2
có l n HCl vào bình ch a dung d ch NaCl bão hòa.ẫ ứ ị
b. D n khí COẫ
2
có l n CO vào l ng d dung d ch Ca(OH)ẫ ượ ư ị
2
. L c l y k t t a r i cho k t t a tácọ ấ ế ủ ồ ế ủ
d ng v i l ng d dung d ch HCl, thu đ c khí COụ ớ ượ ư ị ượ
2
.
PTHH: CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O
CaCO
3
+ 2HCl
CaCl
2
+ CO
2
+ H
2
O
c. Hòa tan NaCl có l n Naẫ
2
SO
4
vào n c ta đ c dung d ch X. Cho dung d ch X thu đ c tácướ ượ ị ị ượ
d ng v i l ng d dung d ch BaClụ ớ ượ ư ị
2
, l c b k t t a ta thu đ c dung d ch Y. Cho Y tác d ng v iọ ỏ ế ủ ượ ị ụ ớ
l ng d dung d ch Naượ ư ị
2
CO
3
, l c b k t t a ta thu đ c dung d ch Z. Cho l ng d dung d chọ ỏ ế ủ ượ ị ượ ư ị
HCl vào dung d ch Z, sau đó cô c n dung d ch sau ph n ng ta thu đ c NaCl tinh khi t.ị ạ ị ả ứ ượ ế
PTHH: BaCl
2
+ Na
2
SO
4
BaSO
4
+ 2NaCl
BaCl
2
+ Na
2
CO
3
BaCO
3
+ 2NaCl
BaCO
3
+ 2HCl
BaCl
2
+ CO
2
+ H
2
O
3.
2
dd NaCl
NaCl
H O
m 500 1, 009 504,5 (g)
504,5.0,9
m 4,5405 (g)
100
m 504,5 4,5405 499,9595 (g)
Do kh i l ng riêng c a n c là 1 g/ml nên ố ượ ủ ướ
2
H O
V 499,9595 (mL)
Cách pha ch : Cân chính xác 4,5405 gam mu i NaCl cho vào c c th y tinh 1000 mL, sau đó đongế ố ố ủ
499,9595 mL n c cho vào, khu y đ u.ướ ấ ề
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Câu 4. (2,0 đi m)ể
1. Cho 7,65 gam h n h p X g m Al và Mg tan hoàn toàn trong 500 ml dung d ch Hỗ ợ ồ ị
2
SO
4
0,8M, thu đ c dung d ch Y và 8,4 lít khí Hượ ị
2
(đktc). Cho 850 ml dung d ch NaOH 1M vào dungị
d ch Y, sau khi các ph n ng x y ra hoàn toàn thu đ c m gam k t t a. Tính giá tr c a m.ị ả ứ ả ượ ế ủ ị ủ
2. H n h p X g m MgClỗ ợ ồ
2
, NaF, NaBr. Hoà tan hoàn toàn 33,35 gam X vào n c đ cướ ượ
dung d ch Y. Cho dung d ch Y ph n ng v i 500 ml dung d ch AgNOị ị ả ứ ớ ị
3
n ng đ 1,0M th y t oồ ộ ấ ạ
thành 56,9 gam k t t a. L c b k t t a thu đ c dung d ch, cho ti p vào dung d ch đó m tế ủ ọ ỏ ế ủ ượ ị ế ị ộ
l ng magie kim lo i d , khu y kĩ, sau ph n ng th y kh i l ng kim lo i tăng 14,4 gam.ượ ạ ư ấ ả ứ ấ ố ượ ạ
a. Vi t ph ng trình hóa h c c a các ph n ng x y ra.ế ươ ọ ủ ả ứ ả
b. Tính ph n trăm v kh i l ng các mu i trong h n h p X.ầ ề ố ượ ố ỗ ợ
H NG D NƯỚ Ẫ
1.
2
2 4
2 2 4
H
H SO
H(H ) H(H SO )
8, 4
n 0,375 (mol)
22,4
n 0,5 0,8 0, 4 (mol)
n 0,75 n 0,8
H
2
SO
4
d , kim lo i ph n ng h t.ư ạ ả ứ ế
G i x, y l n l t là s mol c a Al, Mgọ ầ ượ ố ủ
2Al + 3H
2
SO
4
Al
2
(SO
4
)
3
+ 3H
2
x
3
x
2
1
x
2
3
x
2
(mol)
Mg + H
2
SO
4
MgSO
4
+ H
2
y y y y (mol)
Ta có:
27x 24y 7, 65
x 0,15
3
y 0,15
x y 0,375
2
Dung d ch Y g m ị ồ
2 4 3
4
2 4
Al (SO ) : 0,075 mol
MgSO : 0,15 mol
3
H SO : 0, 4 0,15 0,15 0,025 mol
2
NaOH
n 0,85 (mol)
2NaOH + H
2
SO
4
Na
2
SO
4
+ 2H
2
O
0,05 0,025
2NaOH + MgSO
4
Na
2
SO
4
+ Mg(OH)
2
0,3 0,15 0,15
Al
2
(SO
4
)
3
+ 6NaOH
2Al(OH)
3
+ 3Na
2
SO
4
0,075 0,45 0,15
Al(OH)
3
+ NaOH
NaAlO
2
+ 2H
2
O
0,15 0,05
0,05 0,05
0,1 0
2 3
Mg(OH) Al(OH)
m m m 0,15 58 0,1 78 16,5 (g)
2. G i x, y, z l n l t là s mol c a MgClọ ầ ượ ố ủ
2
; NaBr; NaF trong h n h p Xỗ ợ
3
AgNO
n 0,5 (mol)
MgCl
2
+ 2AgNO
3
Mg(NO
3
)
2
+ 2AgCl
x 2x 2x
NaBr + AgNO
3
NaNO
3
+ AgBr
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ






















