Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) Ngày soạn: Tuần 21, 22 tiết 42, 43
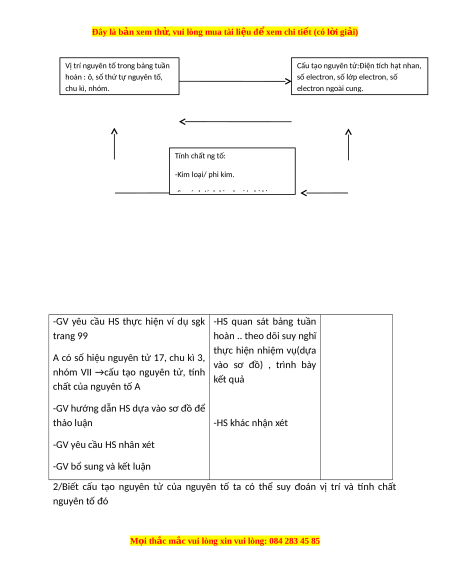
Bài 31: SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC I. M ục tiêu : 1) K iến thức : HS biết
- Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần
của điện tính hạt nhân nguyên tử. Lấy ví dụ minh hoạ.
- Cấu tạo bảng tuần hoàn gồm: Ô nguyên tố, chu kì, nhóm. Lấy ví dụ minh hoạ.
- Quy luật biến đổi tính kim loại, phi kim trong chu kì và nhóm. Lấy ví dụ minh hoạ.
- Ý nghĩa của bảng tuần hoàn: Sơ lược về mối liên hệ giữa cấu tạo nguyên
tử, vị trí nguyên tố trong bảng tuần hoàn và tính chất hóa học cơ bản của nguyên tố đó. 2) K ĩ năng : HS biết
- Quan sát bảng tuần hoàn, ô nguyên tố cụ thể, nhóm I và VII, chu kì 2, 3 và
rút ra nhận xét về ô nguyên tố, về chu kỳ và nhóm.
- Từ cấu tạo nguyên tử của một số nguyên tố điển hình (thuộc 20 nguyên tố
đầu tiên) suy ra vị trí và tính chất hoá học cơ bản của chúng và ngược lại.
- So sánh tính kim loại hoặc tính phi kim của một nguyên tố cụ thể với các
nguyên tố lân cận (trong số 20 nguyên tố đầu tiên). 3)Thái độ:
- Ham mê hóa học và khoa học, tích cực học tập và giải quyết vấn đề 4) Phát triển năng lực
- Năng lực tự học và giải quyết vấn đề M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
- Năng lực sử dụng ngôn ngữ hóa học
- Năng lực giao tiếp và làm việc cá nhân, làm việc nhóm II. Chuẩn bị:
-Bảng tuần hoàn , ô nguyên tố phóng to, chu kì 2,3 phóng to, nhóm I, VII phóng to
-Sơ đồ cấu tạo nguyên tử của một số nguyên tố(yêu cầu HS ôn lại kiến thức về
cấu tạo nguyên tử ở lớp 8) III. T
iến trình lên lớp : 1) ổ n định tổ chức : 2) K iểm tra bài cũ:
a.Hãy nêu một số đặc điểm của nguyên tố silíc về trạng thái thiên nhiên, tính chất,và ứng dụng.
b.Hãy mô tả sơ lược các công đoạn chính để sản xuất đồ gốm. 3) Bài mới:
*Giới thiệu bài:Ngày nay người ta đã phát hiện khoảng 110 nguyên tố hoá học.
Chúng được sắp xếp trong bảng tuần hoàn theo nguyên tắc nào? …
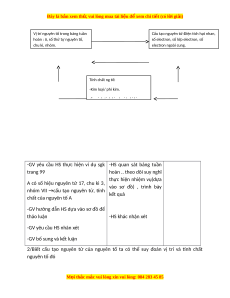
Hoạt động 1: I/ Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) Giáo viên Học sinh Nội dung
GV giới thiệu khái quát bảng tuần hoàn các
-HS chú ý lắng nghe , quan -Sắp xếp theo
nguyên tố, từng ô nguyên tố, hàng, cột, màu
sát bảng TH.. và trả lời câu chiều tăng sắc trong bảng
hỏi (kim loại là màu xanh, dần của điện
phi kim là hồng, khí hiếm là tích hạt nhân
-Năm 1869 (Menđêléep)sắp xếp 60 nguyên tố cam nguyên tử
lấy cơ sở là nguyên tử khối
-HS trả lời( theo chiều tăng
-Ngày nay đã có 110 nguyêntố nguyên tắc sắp
dần điện tích hạt nhân) xếp như thế nào? -GV bổ sung và kết luận
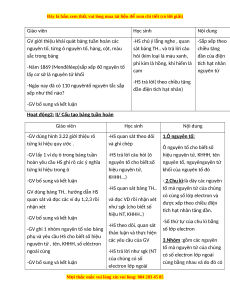
Hoạt động2: II/ Cấu tạo bảng tuần hoàn Giáo viên Học sinh Nội dung
-GV dùng hình 3.22 giới thiệu rõ -HS quan sát theo dõi 1.Ô nguyên tố: từng kí hiệu quy ước . và ghi chép
Ô nguyên tố cho biết:số
-GV lấy 1 ví dụ ô trong bảng tuần
-HS trả lời câu hỏi (ô
hiệu nguyên tử, KHHH, tên
hoàn yêu cầu HS ghi rõ các ý nghĩa nguyên tố cho biết:số
nguyên tố, nguyênguyên tử từng kí hiệu trong ô hiệu nguyên tử, khối của nguyên tố đó KHHH...) -GV bổ sung và kết luận
- 2.Chu kì:là dãy các nguyên
-HS quan sát bảng TH.. tố mà nguyên tử của chúng
GV dùng bảng TH.. hướng dẫn HS
có cùng số lớp electron và
quan sát và đọc các ví dụ 1,2,3 rồi
và đọc VD rồi nhận xét được xếp theo chiều điện nhận xét như sgk (cho biết số tích hạt nhân tăng dần. hiệu NT, KHHH..)
-GV bổ sung và kết luận
-Số thứ tự của chu kì bằng -HS theo dõi, quan sát
-GV ghi 1 nhóm nguyên tố vào bảng số lớp electron
thảo luận và thực hiện
phụ và yêu cầu HS cho biết số hiệu các yêu cầu của GV
3.Nhóm :gồm các nguyên
nguyên tử , tên, KHHH, số elêctron
tố mà nguyên tử của chúng ngoài cùng
-HS trả lời như sgk (NT có số electron lớp ngoài của chúng có số
-GV bổ sung và kết luận
cùng bằng nhau và do đó có electron lớp ngoài M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
-GV hỏi nhóm gồm những nguyên cùng bằng nhau ..)
tính chất tương tự nhau tố như thế nào ?
được xếp thành cột theo
chiều tăng của điện tích hạt -GV bổ sung và kết luận nhân nguyênguyên tử
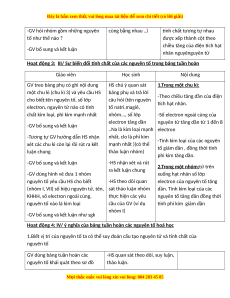
Hoạt động 3: III/ Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn Giáo viên Học sinh Nội dung
GV treo bảng phụ có ghi nội dung HS chú ý quan sát 1.Trong một chu kì:
một chu kì (chu kì 3) và yêu cầu HS bảng phụ và trả lời
-Theo chiều tăng dần của điện
cho biết:tên nguyên tố, số lớp câu hỏi (tên nguyên tích hạt nhân.
electron, nguyên tử nào có tính tố natri,magiê,
chất kim loại, phi kim mạnh nhất nhôm..., số lớp
-Số electron ngoài cùng của electron tăng dần
nguyên tử tăng dần từ 1 đến 8
-GV bổ sung và kết luận
..Na là kim loại mạnh electron
-Tương tự GV hướng dẫn HS nhận nhất, clo là phi kim
-Tính kim loại của các nguyên
xét các chu kì còn lại rồi rút ra kết mạnh nhất )(có thể
tố giảm dần , đồng thời tính luận chung thảo luận nhóm) phi kim tăng dần.
-GV bổ sung và kết luận -HS nhận xét và rút
2.Trong một nhóm:từ trên ra kết luận chung
-GV dùng hình vẽ đưa 1 nhóm
xuống hạt nhân số lớp
nguyên tố yêu cầu HS cho biết -HS theo dõi quan
electron của nguyên tố tăng
(nhóm I, VII) số hiệu nguyên tử, tên, sát thảo luận nhóm
dần. Tính kim loại của các
KHHH, số electron ngoài cùng, thực hiện các yêu
nguyên tố tăng dần đồng thời
nguyên tố nào là kim loại cầu của GV (ví dụ tính phi kim giảm dần nhóm I)
-GV bổ sung và kết luận như sgk
Hoạt động 4: IV/ ý nghĩa của bảng tuần hoàn các nguyên tố hoá học
1.Biết vị trí của nguyên tố ta có thể suy đoán cấu tạo nguyên tử và tính chất của nguyên tố
GV dùng bảng tuần hoàn các
-HS quan sát theo dõi, suy luận,
nguyên tố khái quát theo sơ đồ thảo luận. M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Giáo án Sơ lược về bảng tuần hoàn các nguyên tố hóa học Hóa học 9
791
396 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa 9 được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa học 9 năm 2023 mới, chuẩn nhất (tặng kèm đề kiểm tra 1 tiết, đề thi học kì) được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa 9.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(791 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 9
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
!"#$%
&
!"#$%&'()*)+,-.
/0%123!456789.:;5
7$<;=!">?@;56789.:;
5
ABC%D2>;B)>;#>?8@;56789.:
;5
EF0/0$GB&'8,;"B!1H07!
48I#9!"#$827@0JG$/0
!"%@5
'& F-
A0 $K!":L@;M8NMM>?8
#O#0C*P8,K!"8,>Q8@;5
R7!4/0;S"!"%L?TSU!"
%!V#08I#9827 JG$/0O8&'B5
2>;BW2)>;/0;S!":L8X
!"B3CT#"U!"%!V5
V %S
0;;!@0J8>0J2YJC)8$Z87%,
V[ #L-BY
-BYYJ8$Z87%,
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
-BY4.:KH@0J
-BY0)8B;81 3B;81@;
(%)*+,
\$K!")@>?)@@;MNMM
)@
G%<7!4/0;S"!"T!KB>8,
7!4]BX)^V
-*./0*(1$*123
& D%ID
'& L;#0_
05`!;S"%W%L;/0!"B98,# !!2
78.:5
5`;K$GB&' K%9%L$*7%<";5
& \;X
abX10&c0%`) 1>$U!" J5
O%&'()*)#$+!(de
45.67*898%:$*.;"<;3=-3">"*8%:$*.?./4*8+@*8.%A*(4*
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
b 8! J S.
bNX1> Z $
!"RK!"S;
(#$
-;^fgTh+%!BP+)V()*)fU!"
B7G]B!4>"
0%`@U!"!(()
*)&d
bND8>BC
OiB(+Z0
$558#$Bc3
jT>;BB;*0
)>;B<>9;B
0;
#$BcT+,-
.%123V
()*)+
,-
./0%1
23
!4
45.67*8'9B%.54+@*8.%A*(4*
b 8! J S.
bN.k?5X1#l
R>91Z&X5
bNB789.:K#$
!#l iF0
R>91#K
bND8>BC
bN.k$55&X.m
Z0 8%J 89.:#<
C*P
bND8>BC
bN@;!"8$
):8!"1
!4!"+B!#
k
bND8>BC
Z0 +.l
8P)
#$Bc3jTK
!""
1!4
555V
Z0 $55
8%JNn#<C*P
&>T"
155V
+.lZ0
$BC8Y1
!/0bN
#$Bc&>T
/0O@"
+B+#BX)
C*8%:$*.?
=!""
1!4!
!"!!4
>"/0!"%@
'(%D0B.` !
";!4/0O
@k"BX)+B+#8
%&'*)+,%1
23-.5
"Y/0>?o
"BX)+B+#
(EF<; !
";!4/0O
@"+B+#BX)
ko08.%@@
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
bNj@;<;H!
"&d
bND8>BC
ko055V 27&GY0
%&'*)S+
,-/0%12
3!!4
45.67*89G+-*6HI*("(B."JK">"*8%:$*.?./4*8+@*8.%A*(4*
b 8! J S.
bN#+$):@S.
;S>?T>?V8!
!!""BX)
+B+#!4@2
7>;B)>;;7
bND8>BC
&GYbN&X.mC
*P >?pB#<#O#0>
BC
bND8>BC
bN.k?8q%&0@;
!"!
T@;MNMMV"1!4!
"+B+#k
!"B>;B
bND8>BC&>
OiZ0
$):8#$Bc
3jT!!
"0#;0!
K;555"BX)
+B+#-.
550B>;B;
7BB)>;
;7VT@L
$BC@;V
C*P8#O
#0>BC
+.lZ0
$BC@;
Y1 !
/0bNT89.:
@;MV
/4*8F7."(%D0
+,-./0%1
235
"+B+#k/0
!4-.R%^
+B+#
9>;B/0 !
"$;.%<c2
)>;-.5
'/4*8F7.*(EFR#!
*"3"BX)
+B+#/0!"-
.59>;B/0
!"-.%<c
2)>;$;.
45.67*8L9M*8(NK"JK+@*8.%A*(4*">"*8%:$*.?(4>(O"
5\8I#9/0!"0@L% 7!4827/0
!"
bN.k$
!"> Z +G%<
Z0 +.lBC
$BC5
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
bN!Y189.:>
#0gg
r@"1!4s>?
@;NMMt7!42
7/0!"r
bN&X.m.Y08G%<%L
$BC
bN!3*P
bND8>BC
Z0 $
55+.lF
Y11;8:T.Y0
8 G %<V #?
>Z$
> C*P
u\7!4/0!"0@L% 8I#9827
!"%@
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ
7!4v120
"+B+#"BX)+B+#"
+B+#5
NI#9!"#$
K"Y!"
>?@;5
97"
;Bu)>;5
2>;Bu)>;