Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) Ngày soạn: Tuần 11
tiết 23. Bài 16: TÍNH CHẤT HOÁ HỌC CỦA KIM LOẠI I. M ục tiêu : 1) K iến thức :
-HS biết được tính chất hoá học của kim loại nói chung. Tác dụng của kim loại
với phi kim, với dd axit, với dd muối 2) K ĩ năng :
-Biết rút ra tính chất hoá học của kim loại bằng cách: Quan sát hiện tượng thí
nghiệm cụ thể rút ra được tính chất hoá học của kim loại
-Viết các PTHH biểu diễn tính chất hoá học của kim loại
-Tính khối lượng của kim loại trong phản ứng, tính thành phần phần trăm về
khối lượng của hỗn hợp hai kim loại. 3) Thái độ:
- Ham mê hóa học và khoa học, tích cực học tập và giải quyết vấn đề 4) Phát triển năng lực
- Năng lực tự học và giải quyết vấn đề
- Năng lực sử dụng ngôn ngữ hóa học
- Năng lực quan sát và giải thích thí nghiệm
- Năng lực giao tiếp và làm việc cá nhân, làm việc nhóm II. Chuẩn bị :
1) Dụng cụ:Khay, chỗi ,ống nghiệm,đèn cồn, diêm..
2) Hoá chất: DD CuSO4, đinh sắt mới, kim loại Na, dd HCl đặc, MnO2 rắn , dây Cu(hoặc Cu mảnh)
3) Thiết bị:Phiếu giao việc cho nhóm học sinh thực hiện
Nội dung các phiếu học tập:
Phiếu học tập số 1 M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
Hãy nêu 2 ví dụ về phản ứng của kim loại tác dụng với dung dịch muối mà các em
đã biết ở chương I, nêu hiện tượng,viết PTHH và rút ra nhận xét về khả năng hoạt
động hoá học của kim loại theo mẫu sau: Tên thí nghiệm Hiện tượng PTHH - Nhận xét
Phiếu học tập số 2:Thực hiện THÍ NGHIỆM tác dụng của Zn với dd CuSO4 Cách làm Hiện tượng Viết PTHH và nhận xét -Cho 1 dây kẽm vào ống nghiệm đựng dd CuSO4 III. T
iến trình bài giảng : 1) ổ n định : 2) Bài
cũ : (GV có thể kiểm tra việc làm bài tập ở nhà của HS) 3) Bài mới :
Giới thiệu bài:GV nêu mục tiêu của bài học hoặc GV nêu :Chúng ta đã biết kim loại
chiếm tới 80% trong tổng số các nguyên tố hoá học và có nhiều ứng dụng trong
đời sống sản xuất. Để sử dụng kim loại có hiệu quả cần phải hiểu tính chất hoá
học của nó. Vậy kim loại có những tính chất hoá học chung nào. Chúng ta nghiên
cứu bài ‘Tính chất hoá học của kim loại’ 4) C
ác hoạt động dạy và học :
GV yêu cầu HS nhắc lại một số tính chất hoá học chung của kim loại. HS dựa vào
kiến thức đã học ở chương I để trả lời câu hỏi. GV bổ sung,kết luận và đi vào từng hoạt động
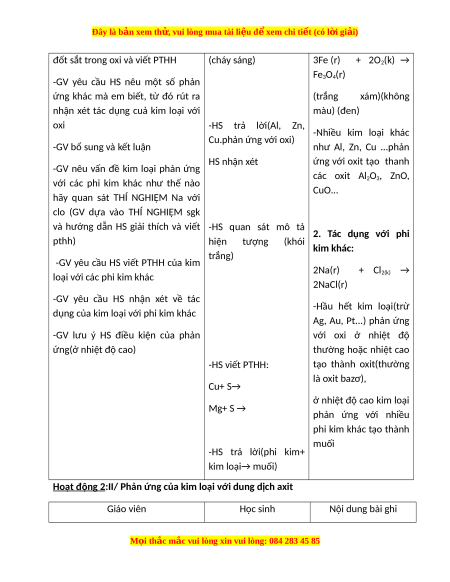
Hoạt động 1:I/Phản ứng của kim loại với phi kim Giáo viên Học sinh Nội dung bài ghi
-GV yêu cầu HS quan sát hình 2.3 -HS quan sát hình 2.3 1.Tác dụng với oxi:
mô tả hiện tượng thí nghiệm khi và mô tả hiện tượng M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
đốt sắt trong oxi và viết PTHH (cháy sáng) 3Fe (r) + 2O2(k) → Fe3O4(r)
-GV yêu cầu HS nêu một số phản
ứng khác mà em biết, từ đó rút ra (trắng xám)(không
nhận xét tác dụng cuả kim loại với màu) (đen) oxi
-HS trả lời(Al, Zn, -Nhiều kim loại khác Cu.phản ứng với oxi)
-GV bổ sung và kết luận như Al, Zn, Cu ...phản HS nhận xét ứng với oxit tạo thanh
-GV nêu vấn đề kim loại phản ứng các oxit Al2O3, ZnO,
với các phi kim khác như thế nào CuO...
hãy quan sát THÍ NGHIỆM Na với
clo (GV dựa vào THÍ NGHIỆM sgk
và hướng dẫn HS giải thích và viết -HS quan sát mô tả 2. Tác dụng với phi pthh)
hiện tượng (khói kim khác: trắng)
-GV yêu cầu HS viết PTHH của kim 2Na(r) + Cl
loại với các phi kim khác 2(k) → 2NaCl(r)
-GV yêu cầu HS nhận xét về tác -Hầu hết kim loại(trừ
dụng của kim loại với phi kim khác Ag, Au, Pt...) phản ứng
-GV lưu ý HS điều kiện của phản với oxi ở nhiệt độ ứng(ở nhiệt độ cao) thường hoặc nhiệt cao -HS viết PTHH: tạo thành oxit(thường là oxit bazơ), Cu+ S→
ở nhiệt độ cao kim loại Mg+ S → phản ứng với nhiều phi kim khác tạo thành muối -HS trả lời(phi kim+ kim loại→ muối)
Hoạt động 2:II/ Phản ứng của kim loại với dung dịch axit Giáo viên Học sinh Nội dung bài ghi M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
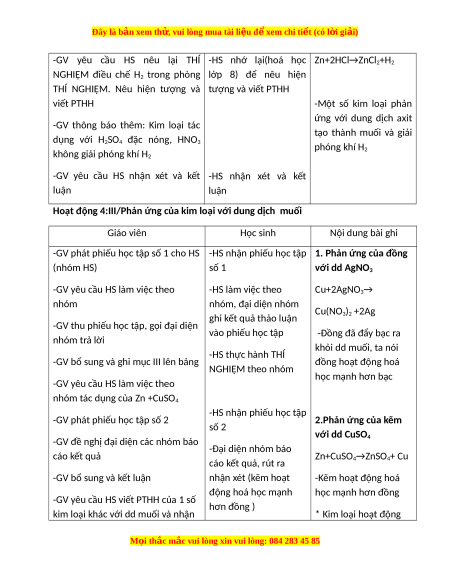
-GV yêu cầu HS nêu lại THÍ -HS nhớ lại(hoá học Zn+2HCl→ZnCl2+H2
NGHIỆM điều chế H2 trong phòng lớp 8) để nêu hiện
THÍ NGHIỆM. Nêu hiện tượng và tượng và viết PTHH viết PTHH -Một số kim loại phản ứng với dung dịch axit
-GV thông báo thêm: Kim loại tác tạo thành muối và giải
dụng với H2SO4 đặc nóng, HNO3 phóng khí H không giải phóng khí H 2 2
-GV yêu cầu HS nhận xét và kết -HS nhận xét và kết luận luận
Hoạt động 4:III/Phản ứng của kim loại với dung dịch muối Giáo viên Học sinh Nội dung bài ghi
-GV phát phiếu học tập số 1 cho HS -HS nhận phiếu học tập 1. Phản ứng của đồng (nhóm HS) số 1 với dd AgNO3
-GV yêu cầu HS làm việc theo -HS làm việc theo Cu+2AgNO3→ nhóm nhóm, đại diện nhóm Cu(NO ghi kết quả thảo luận 3)2 +2Ag
-GV thu phiếu học tập, gọi đại diện vào phiếu học tập
-Đồng đã đẩy bạc ra nhóm trả lời khỏi dd muối, ta nói -HS thực hành THÍ
-GV bổ sung và ghi mục III lên bảng đồng hoạt động hoá NGHIỆM theo nhóm học mạnh hơn bạc
-GV yêu cầu HS làm việc theo
nhóm tác dụng của Zn +CuSO4 -HS nhận phiếu học tập
-GV phát phiếu học tập số 2
2.Phản ứng của kẽm số 2 với dd CuSO4
-GV đề nghị đại diện các nhóm báo -Đại diện nhóm báo cáo kết quả Zn+CuSO cáo kết quả, rút ra 4→ZnSO4+ Cu
-GV bổ sung và kết luận nhận xét (kẽm hoạt -Kẽm hoạt động hoá động hoá học mạnh học mạnh hơn đồng
-GV yêu cầu HS viết PTHH của 1 số hơn đồng )
kim loại khác với dd muối và nhận * Kim loại hoạt động M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Giáo án Tính chất hóa học của kim loại Hóa học 9
663
332 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa 9 được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa học 9 năm 2023 mới, chuẩn nhất (tặng kèm đề kiểm tra 1 tiết, đề thi học kì) được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa 9.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(663 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 9
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Ngày soạn:
Tuần 11
ết 23. Bài 16: TÍNH CHẤT HOÁ HỌC CỦA KIM LOẠI
I. Mục êu :
1) Kiến thức :
-HS biết được !nh chất hoá học của kim loại nói chung. Tác dụng của kim loại
với phi kim, với dd axit, với dd muối
2) Kĩ năng :
-Biết rút ra !nh chất hoá học của kim loại bằng cách: Quan sát hiện tượng thí
nghiệm cụ thể rút ra được !nh chất hoá học của kim loại
-Viết các PTHH biểu diễn !nh chất hoá học của kim loại
-Tính khối lượng của kim loại trong phản ứng, !nh thành phần phần trăm về
khối lượng của hỗn hợp hai kim loại.
3) Thái độ:
- Ham mê hóa học và khoa học, !ch cực học tập và giải quyết vấn đề
4) Phát triển năng lực
- Năng lực tự học và giải quyết vấn đề
- Năng lực sử dụng ngôn ngữ hóa học
- Năng lực quan sát và giải thích thí nghiệm
- Năng lực giao ếp và làm việc cá nhân, làm việc nhóm
II. Chuẩn bị :
1) Dụng cụ:Khay, chỗi ,ống nghiệm,đèn cồn, diêm..
2) Hoá chất: DD CuSO
4
, đinh sắt mới, kim loại Na, dd HCl đặc, MnO
2
rắn , dây
Cu(hoặc Cu mảnh)
3) Thiết bị:Phiếu giao việc cho nhóm học sinh thực hiện
Nội dung các phiếu học tập:
Phiếu học tập số 1
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Hãy nêu 2 ví dụ về phản ứng của kim loại tác dụng với dung dịch muối mà các em
đã biết ở chương I, nêu hiện tượng,viết PTHH và rút ra nhận xét về khả năng hoạt
động hoá học của kim loại theo mẫu sau:
Tên thí nghiệm Hiện tượng PTHH - Nhận xét
Phiếu học tập số 2:Thực hiện THÍ NGHIỆM tác dụng của Zn với dd CuSO
4
Cách làm Hiện tượng Viết PTHH và nhận xét
-Cho 1 dây kẽm vào ống
nghiệm đựng dd CuSO
4
III. Tiến trình bài giảng :
1) ổn định :
2) Bài cũ : (GV có thể kiểm tra việc làm bài tập ở nhà của HS)
3) Bài mới :
Giới thiệu bài:GV nêu mục êu của bài học hoặc GV nêu :Chúng ta đã biết kim loại
chiếm tới 80% trong tổng số các nguyên tố hoá học và có nhiều ứng dụng trong
đời sống sản xuất. Để sử dụng kim loại có hiệu quả cần phải hiểu !nh chất hoá
học của nó. Vậy kim loại có những !nh chất hoá học chung nào. Chúng ta nghiên
cứu bài ‘Tính chất hoá học của kim loại’
4) Các hoạt động dạy và học :
GV yêu cầu HS nhắc lại một số !nh chất hoá học chung của kim loại. HS dựa vào
kiến thức đã học ở chương I để trả lời câu hỏi. GV bổ sung,kết luận và đi vào từng
hoạt động
Hoạt động 1:I/Phản ứng của kim loại với phi kim
Giáo viên Học sinh Nội dung bài ghi
-GV yêu cầu HS quan sát hình 2.3
mô tả hiện tượng thí nghiệm khi
-HS quan sát hình 2.3
và mô tả hiện tượng
1.Tác dụng với oxi:
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
đốt sắt trong oxi và viết PTHH
-GV yêu cầu HS nêu một số phản
ứng khác mà em biết, từ đó rút ra
nhận xét tác dụng cuả kim loại với
oxi
-GV bổ sung và kết luận
-GV nêu vấn đề kim loại phản ứng
với các phi kim khác như thế nào
hãy quan sát THÍ NGHIỆM Na với
clo (GV dựa vào THÍ NGHIỆM sgk
và hướng dẫn HS giải thích và viết
pthh)
-GV yêu cầu HS viết PTHH của kim
loại với các phi kim khác
-GV yêu cầu HS nhận xét về tác
dụng của kim loại với phi kim khác
-GV lưu ý HS điều kiện của phản
ứng(ở nhiệt độ cao)
(cháy sáng)
-HS trả lời(Al, Zn,
Cu.phản ứng với oxi)
HS nhận xét
-HS quan sát mô tả
hiện tượng (khói
trắng)
-HS viết PTHH:
Cu+ S→
Mg+ S →
-HS trả lời(phi kim+
kim loại→ muối)
3Fe (r) + 2O
2
(k) →
Fe
3
O
4
(r)
(trắng xám)(không
màu) (đen)
-Nhiều kim loại khác
như Al, Zn, Cu ...phản
ứng với oxit tạo thanh
các oxit Al
2
O
3
, ZnO,
CuO...
2. Tác dụng với phi
kim khác:
2Na(r) + Cl
2(k)
→
2NaCl(r)
-Hầu hết kim loại(trừ
Ag, Au, Pt...) phản ứng
với oxi ở nhiệt độ
thường hoặc nhiệt cao
tạo thành oxit(thường
là oxit bazơ),
ở nhiệt độ cao kim loại
phản ứng với nhiều
phi kim khác tạo thành
muối
Hoạt động 2:II/ Phản ứng của kim loại với dung dịch axit
Giáo viên Học sinh Nội dung bài ghi
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
-GV yêu cầu HS nêu lại THÍ
NGHIỆM điều chế H
2
trong phòng
THÍ NGHIỆM. Nêu hiện tượng và
viết PTHH
-GV thông báo thêm: Kim loại tác
dụng với H
2
SO
4
đặc nóng, HNO
3
không giải phóng khí H
2
-GV yêu cầu HS nhận xét và kết
luận
-HS nhớ lại(hoá học
lớp 8) để nêu hiện
tượng và viết PTHH
-HS nhận xét và kết
luận
Zn+2HCl→ZnCl
2
+H
2
-Một số kim loại phản
ứng với dung dịch axit
tạo thành muối và giải
phóng khí H
2
Hoạt động 4:III/Phản ứng của kim loại với dung dịch muối
Giáo viên Học sinh Nội dung bài ghi
-GV phát phiếu học tập số 1 cho HS
(nhóm HS)
-GV yêu cầu HS làm việc theo
nhóm
-GV thu phiếu học tập, gọi đại diện
nhóm trả lời
-GV bổ sung và ghi mục III lên bảng
-GV yêu cầu HS làm việc theo
nhóm tác dụng của Zn +CuSO
4
-GV phát phiếu học tập số 2
-GV đề nghị đại diện các nhóm báo
cáo kết quả
-GV bổ sung và kết luận
-GV yêu cầu HS viết PTHH của 1 số
kim loại khác với dd muối và nhận
-HS nhận phiếu học tập
số 1
-HS làm việc theo
nhóm, đại diện nhóm
ghi kết quả thảo luận
vào phiếu học tập
-HS thực hành THÍ
NGHIỆM theo nhóm
-HS nhận phiếu học tập
số 2
-Đại diện nhóm báo
cáo kết quả, rút ra
nhận xét (kẽm hoạt
động hoá học mạnh
hơn đồng )
1. Phản ứng của đồng
với dd AgNO
3
Cu+2AgNO
3
→
Cu(NO
3
)
2
+2Ag
-Đồng đã đẩy bạc ra
khỏi dd muối, ta nói
đồng hoạt động hoá
học mạnh hơn bạc
2.Phản ứng của kẽm
với dd CuSO
4
Zn+CuSO
4
→ZnSO
4
+ Cu
-Kẽm hoạt động hoá
học mạnh hơn đồng
* Kim loại hoạt động
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
xét về khả năng hoạt động hoá học
của các kim loại này(Mg, Al, Zn.)
-Từ các ví dụ và THÍ NGHIỆM ở trên
GV yêu cầu HS rút ra kết luận gì về
!nh chất của kim loại với dd muối
-GV bổ sung và kết luận
Chú ý:Trừ Na, K, Ca...Vì phản ứng
với nước → bazơ tan→phản ứng
với muối→...
-HS viết PTHH
Mg + CuSO
4
→
Al + Cu(NO)
3
→
Zn + AgNO
3
→
-HS trả lời (về độ hoạt
động của các kim loại)
hoá học mạnh hơn(trừ
Na, K, Ca..) có thể đẩy
kim loại hoạt động hoá
học yếu hơn ra khỏi dd
muối, tạo thành kim
loại mới và muối mới
5) Tổng kết bài học vàbài tập vận dụng :
-GV yêu cầu HS nắm vững các kiến thức cơ bản về !nh chất hoá học của kim
loại(gồm 3 !nh chất)
-GV treo bảng phụ có ghi nội dung bài tập
Hoàn thành các PTHH
Na + O
2
→ ; Fe + S → ; Fe + H
2
SO
4
→
Mg + HCl→ ;Al + CuSO
4
→ ; Fe +CuSO
4
→
6) Dặn dò :
Học bài cũ và làm bài tập sgk
-GV hướng dẫn HS làm bài tập số 2
Ví dụ: ? + HCl → MgCl
2
+H
2
GV yêu cầu HS chú ý sản phẩm tạo thành để điền nguyên tố còn lại
-Nghiên cứu bài mới: Tìm hiểu dãy hoạt động hoá học của kim loại và ý nghĩa của
dãy hoạt động hoá học của kim loại
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ