S G Ở IÁO D C Ụ VÀ ĐÀO KỲ THI CH N Ọ H C
Ọ SINH GIỎI CẤP T N Ỉ H TẠO NĂM H C Ọ 2022 - 2023 NINH THUẬN
KHÓA NGÀY 11 - 3 - 2023 Môn thi: HÓA H C Ọ cấp: THCS Đề chính th c ứ Th i
ờ gian: 150 phút (không kể th i ờ gian phát đ ) ề
Câu 1 (2,0 đi m ể ).
1. Nguyên tố A có t ng ổ số h t
ạ là 93. Trong đó số h t ạ mang đi n ệ nhi u ề h n ơ số h t ạ không mang ddienj là 23 h t ạ . xác đ nh ị A và hoàn thành sơ đ s ồ au: 0 A + X t B + C + H2O
B + Ba(OH)2 D +BaSO4 0 D t E + H2O 0 E + H t 2 A + H2O C + NaOH L + H2O 0 C+ O xt,t 2 M M + H2O X 2. Có 5 lọ hóa ch t ấ bị m t ấ nhãn ch a ứ các ch t
ấ sau: BaCl2 , Na2CO3, H2SO4, NaOH,
(NH4)2SO4. Không dùng thêm thu c t ố h hãy nh ử n ậ bi t ế các ch t ấ trên.
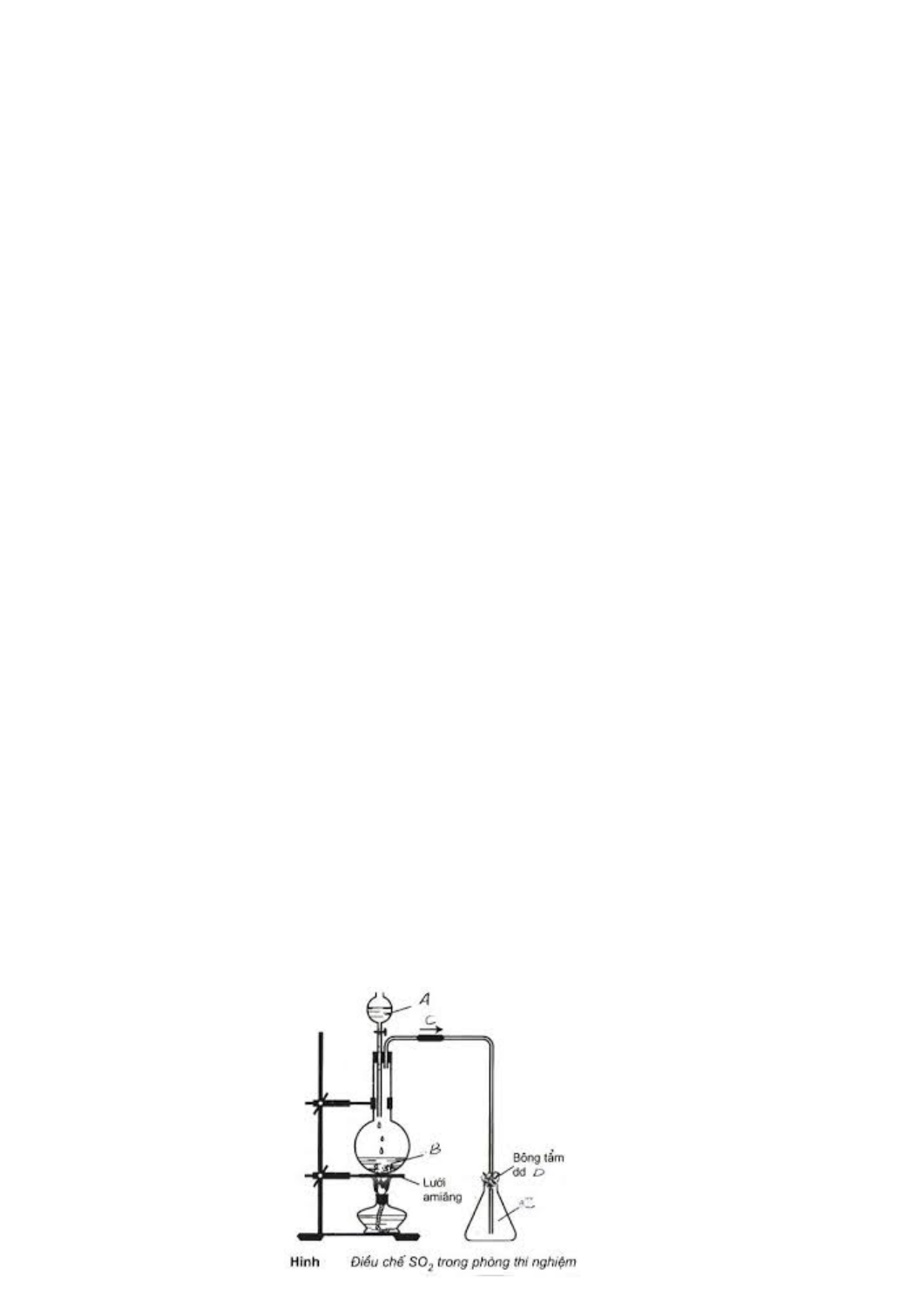
Câu 2 (2,0 đi m ể ). 1. Hình vẽ minh h a
ọ sau đây dùng để đi u
ề chế và thu khí SO2 trong phòng thí nghiệm: a. Nêu tên các d ng c ụ t ụ hí nghi m ệ trong hình v . ẽ b. Vi t ế 2 phư ng t ơ rình ph n ả ng m ứ inh h a ọ tư ng ơ ng v ứ i ớ các hóa ch t ấ A, B. c. Nêu vai trò c a bông t ủ ẩm dung d ch D ị , vi t ế phư ng t ơ rình minh h a. ọ d. Cho 2 hóa ch t ấ là H2SO4 đ c ặ và CaO r n. ắ hóa ch t ấ nào đư c ợ dùng và không đư c ợ dùng đ l ể àm khô SO2. Gi i ả thích?
2. Khi nung hoàn toàn ch t ấ A thu đư c ợ ch t ấ r n ắ B màu tr ng ắ và khí C không màu. Chất B ph n ả ng ứ mãnh li t ệ v i ớ nư c ớ t o ạ thành dung d ch ị D. khi cho B tác d ng ụ v i ớ Cacbon ở nhi t ệ độ cao thu đư c ợ ch t ấ E và gi i
ả phóng khí F. cho E tác d ng ụ v i ớ nư c ớ thu đư c
ợ khí không màu G. khí G cháy cho nư c ớ và khí C. Xác đ nh các ị ch t
ấ A, B, C, D, E, F, G và vi t ế PTHH x y r ả a.
Câu 3 (2,0 đi m ể ). Cho m gam h n ỗ h p ợ X g m
ồ Al, MgO, MgSO4 tan hoàn toàn trong 163,68 gam dung d ch ị H2SO4 28,74%; sau ph n ả ng ứ thu đư c ợ dung d ch ị Y có ch a ứ H2SO4 4,9% và 6,048 lít H2 (đktc). L y ấ 120 gam dung d ch ị Y cho tác d ng ụ v i ớ dung d ch ị NaOH dư thu đư c ợ k t ế t a ủ Z và dung d ch ị T. l c ọ k t ế t a ủ Z và nung đ n ế kh i ố lư ng ợ không đ i ổ thu đư c ợ a gam ch t ấ r n. ắ s c ụ khí CO2 đ n ế dư vào dung d ch ị T thu đư c ợ 9,36 gam k t ế t a. ủ Xác đ nh gi ị á tr c ị a m ủ , a và ph n t ầ răm kh i ố lư ng ợ các ch t ấ trong h n h ỗ p ợ X.
Câu 4 (2,0 đi m ể ).
1. Hoàn thành các phư ng ơ trình ph n ả ng ứ c a s ủ đ ơ s ồ au, ghi rõ đi u ki ề n n ệ u có: ế
2. Hòa tan 1,6 gam oxit c a ủ m t ộ kim lo i ạ (hóa trị II) b ng ằ 200 gam dung d ch ị H2SO4 loãng. Khi thêm vào h n ỗ h p ợ sau ph n ả ng ứ m t ộ lư ng ợ CaCO3 v a ừ đủ th y ấ thoát ra
0,224 lít CO2 (đktc), sau đó cô c n ạ dung d ch ị thu đư c ợ 4,56 gam mu i ố khan. Xác đ nh ị oxit kim lo i ạ trên và n ng đ ồ ph ộ n t ầ răm H2SO4 đã dùng.
Câu 5 (2,0 đi m ể ). Chất h u ữ cơ X đư c ợ t o ạ b i
ở 3 nguyên tố và chỉ ch a ứ 1 lo i ạ nhóm ch c, ứ trong đó H chi m ế 11,11% và O chi m ế 35,56% v ề kh i ố lư ng. ợ kh i ố lư ng ợ mol phân t ử c a ủ X < 150 g/mol. a. Xác đ nh công ị th c phân t ứ c ử a ủ X. b. Bi t ế X có khả năng ph n ả ng ứ v i ớ kim lo i ạ Na gi i ả phóng khí Hiđro. Vi t ế công th c ứ c u t ấ o có t ạ h có c ể a ủ X. ………. H t ế ………. HƯ N Ớ G DẪN GIẢI
Câu 1 (2,0 đi m ể ).
1. Nguyên tố A có t ng ổ số h t
ạ là 93. Trong đó số h t ạ mang đi n ệ nhi u ề h n ơ số h t ạ không mang đi n l ệ à 23 h t ạ . xác đ nh ị A và hoàn thành s đ ơ s ồ au: 0 A + X t B + C + H2O
B + Ba(OH)2 D +BaSO4 0 D t E + H2O 0 E + H t 2 A + H2O C + NaOH L + H2O 0 C+ O xt,t 2 M M + H2O X 2. Có 5 lọ hóa ch t ấ bị m t ấ nhãn ch a ứ các ch t
ấ sau: BaCl2 , Na2CO3, H2SO4, NaOH,
(NH4)2SO4. Không dùng thêm thu c t ố h hãy nh ử n ậ bi t ế các ch t ấ trên. Hư ng ớ d n gi ẫ i ả : 1. Theo đ bài ề ta có: E P N 93 P 29 E P N 23 E 29 A :Cu P E N 35 X: H2SO4 , B: CuSO4, C: SO2, D: Cu(OH)2, E: CuO, L: Na2SO3, M:SO3. 0 t
PTHH: Cu + 2H2SO4 CuSO4 + SO2 + 2H2O
CuSO4 + Ba(OH)2 Cu(OH)2 + BaSO4 0 t Cu(OH) 2 CuO + H2O CuO + H2 t Cu + H2O
SO2 + 2NaOH Na2SO3 + H2O 0 xt,t SO2 + O2 SO3 SO3 + H2O H2SO4 2. – Đánh số th t ứ và t ự rích m u t ẫ h t ử rên các l m ọ t ấ nhãn. - Lần lư t ợ tr n các ộ m u t ẫ h v ử i ớ nhau t ng đôi ừ m t ộ . k t ế qu : ả BaCl2 Na2CO3 H2SO4 NaOH (NH4)2SO4 BaCl2 - - Na2CO3 - - - H2SO4 - - - NaOH - - - (NH4)2SO4 - - - - T o r ạ a 3 k t ế t a v ủ i ớ các m u t ẫ h khác l ử à BaCl2.
BaCl2 + Na2CO3 BaCO3 + 2NaCl
BaCl2 + H2SO4 BaSO4 + 2HCl
BaCl2 + (NH4)2SO4 BaSO4 + 2NH4Cl - Không t o k ạ t ế t a ủ v i ớ BaCl2 là NaOH - Khí sinh ra v i ớ NaOH là (NH4)2SO4.
(NH4)2SO4 + 2NaOH Na2SO4 + 2H2O + 2NH3 - Ph n ả ng t ứ a ỏ nhi t ệ v i ớ NaOH là H2SO4
H2SO4 + 2NaOH Na2SO4 + 2H2O - Còn l i ạ là Na2CO3.
Câu 2 (2,0 đi m ể ).
Đề HSG Hóa 9 Sở Ninh Thuận năm 2023 có đáp án
2.7 K
1.3 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 9 Sở Ninh Thuận năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(2680 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 9
Xem thêmTài liệu bộ mới nhất
S GIÁO D C VÀ ĐÀOỞ Ụ
T OẠ
NINH THU NẬ
Đề chính th cứ
KỲ THI CH N H C SINH GI I CỌ Ọ Ỏ ẤP T NHỈ
NĂM H C 2022 - 2023Ọ
KHÓA NGÀY 11 - 3 - 2023
Môn thi: HÓA H CỌ c p:ấ THCS
Th i gian: ờ 150 phút (không k th i gian phát đ )ể ờ ề
Câu 1 (2,0 đi m).ể
1. Nguyên t A có t ng s h t là 93. Trong đó s h t mang đi n nhi u h n s h tố ổ ố ạ ố ạ ệ ề ơ ố ạ
không mang ddienj là 23 h t. xác đ nh A và hoàn thành s đ sau:ạ ị ơ ồ
A + X
0
t
B + C
+ H
2
O
B + Ba(OH)
2
D
+BaSO
4
D
0
t
E + H
2
O
E + H
2
0
t
A + H
2
O
C + NaOH
L + H
2
O
C+ O
2
0
xt,t
M
M + H
2
O
X
2. Có 5 l hóa ch t b m t nhãn ch a các ch t sau: BaClọ ấ ị ấ ứ ấ
2
, Na
2
CO
3
, H
2
SO
4
, NaOH,
(NH
4
)
2
SO
4
. Không dùng thêm thu c th hãy nh n bi t các ch t trên.ố ử ậ ế ấ
Câu 2 (2,0 đi m).ể
1. Hình v minh h a sau đây dùng đ đi u ch và thu khí SOẽ ọ ể ề ế
2
trong phòng thí
nghi m:ệ
a. Nêu tên các d ng c thí nghi m trong hình v .ụ ụ ệ ẽ

b. Vi t 2 ph ng trình ph n ng minh h a t ng ng v i các hóa ch t A, B.ế ươ ả ứ ọ ươ ứ ớ ấ
c. Nêu vai trò c a bông t m dung d ch D, vi t ph ng trình minh h a.ủ ẩ ị ế ươ ọ
d. Cho 2 hóa ch t là Hấ
2
SO
4
đ c và CaO r n. hóa ch t nào đ c dùng và khôngặ ắ ấ ượ
đ c dùng đ làm khô SOượ ể
2
. Gi i thích?ả
2. Khi nung hoàn toàn ch t A thu đ c ch t r n B màu tr ng và khí C không màu.ấ ượ ấ ắ ắ
Ch t B ph n ng mãnh li t v i n c t o thành dung d ch D. khi cho B tác d ng v iấ ả ứ ệ ớ ướ ạ ị ụ ớ
Cacbon nhi t đ cao thu đ c ch t E và gi i phóng khí F. cho E tác d ng v i n cở ệ ộ ượ ấ ả ụ ớ ướ
thu đ c khí không màu G. khí G cháy cho n c và khí C.ượ ướ
Xác đ nh các ch t A, B, C, D, E, F, G và vi t PTHH x y ra.ị ấ ế ả
Câu 3 (2,0 đi m).ể
Cho m gam h n h p X g m Al, MgO, MgSOỗ ợ ồ
4
tan hoàn toàn trong 163,68 gam
dung d ch Hị
2
SO
4
28,74%; sau ph n ng thu đ c dung d ch Y có ch a Hả ứ ượ ị ứ
2
SO
4
4,9% và
6,048 lít H
2
(đktc). L y 120 gam dung d ch Y cho tác d ng v i dung d ch NaOH dấ ị ụ ớ ị ư
thu đ c k t t a Z và dung d ch T. l c k t t a Z và nung đ n kh i l ng không đ iượ ế ủ ị ọ ế ủ ế ố ượ ổ
thu đ c a gam ch t r n. s c khí COượ ấ ắ ụ
2
đ n d vào dung d ch T thu đ c 9,36 gam k tế ư ị ượ ế
t a.ủ
Xác đ nh giá tr c a m, a và ph n trăm kh i l ng các ch t trong h n h p X.ị ị ủ ầ ố ượ ấ ỗ ợ
Câu 4 (2,0 đi m).ể
1. Hoàn thành các ph ng trình ph n ng c a s đ sau, ghi rõ đi u ki n n u có:ươ ả ứ ủ ơ ồ ề ệ ế
2. Hòa tan 1,6 gam oxit c a m t kim lo i (hóa tr II) b ng 200 gam dung d ch Hủ ộ ạ ị ằ ị
2
SO
4
loãng. Khi thêm vào h n h p sau ph n ng m t l ng CaCOỗ ợ ả ứ ộ ượ
3
v a đ th y thoát raừ ủ ấ
0,224 lít CO
2
(đktc), sau đó cô c n dung d ch thu đ c 4,56 gam mu i khan. Xác đ nhạ ị ượ ố ị
oxit kim lo i trên và n ng đ ph n trăm Hạ ồ ộ ầ
2
SO
4
đã dùng.
Câu 5 (2,0 đi m).ể

Ch t h u c X đ c t o b i 3 nguyên t và ch ch a 1 lo i nhóm ch c, trongấ ữ ơ ượ ạ ở ố ỉ ứ ạ ứ
đó H chi m 11,11% và O chi m 35,56% v kh i l ng. kh i l ng mol phân t c aế ế ề ố ượ ố ượ ử ủ
X < 150 g/mol.
a. Xác đ nh công th c phân t c a X.ị ứ ử ủ
b. Bi t X có kh năng ph n ng v i kim lo i Na gi i phóng khí Hiđro. Vi tế ả ả ứ ớ ạ ả ế
công th c c u t o có th có c a X.ứ ấ ạ ể ủ
………. H t ……….ế
H NG D N GI IƯỚ Ẫ Ả
Câu 1 (2,0 đi m).ể
1. Nguyên t A có t ng s h t là 93. Trong đó s h t mang đi n nhi u h n s h tố ổ ố ạ ố ạ ệ ề ơ ố ạ
không mang đi n là 23 h t. xác đ nh A và hoàn thành s đ sau:ệ ạ ị ơ ồ
A + X
0
t
B + C
+ H
2
O
B + Ba(OH)
2
D
+BaSO
4
D
0
t
E + H
2
O
E + H
2
0
t
A + H
2
O
C + NaOH
L + H
2
O
C+ O
2
0
xt,t
M
M + H
2
O
X
2. Có 5 l hóa ch t b m t nhãn ch a các ch t sau: BaClọ ấ ị ấ ứ ấ
2
, Na
2
CO
3
, H
2
SO
4
, NaOH,
(NH
4
)
2
SO
4
. Không dùng thêm thu c th hãy nh n bi t các ch t trên.ố ử ậ ế ấ
H ng d n gi i:ướ ẫ ả
1. Theo đ bài ta có:ề
E P N 93 P 29
E P N 23 E 29 A :Cu
P E N 35
X: H2SO4 , B: CuSO4, C: SO2, D: Cu(OH)2, E: CuO, L: Na2SO3,
M:SO3.

PTHH: Cu + 2H2SO4
0
t
CuSO4 + SO2 + 2H2O
CuSO
4
+ Ba(OH)
2
Cu(OH)2 + BaSO4
Cu(OH)
2
0
t
CuO + H2O
CuO + H
2
t
Cu + H2O
SO2 + 2NaOH
Na2SO3 + H2O
SO2 + O2
0
xt,t
SO3
SO3 + H2O
H2SO4
2. – Đánh s th t và trích m u th trên các l m t nhãn.ố ứ ự ẫ ử ọ ấ
- L n l t tr n các m u th v i nhau t ng đôi m t. k t qu :ầ ượ ộ ẫ ử ớ ừ ộ ế ả
BaCl
2
Na
2
CO
3
H
2
SO
4
NaOH (NH
4
)
2
SO
4
BaCl
2
-
-
Na
2
CO
3
-
-
-
H
2
SO
4
- - -
NaOH - - -
(NH
4
)
2
SO
4
- -
-
- T o ra 3 k t t a v i các m u th khác là BaClạ ế ủ ớ ẫ ử
2
.
BaCl
2
+ Na
2
CO
3
BaCO3 + 2NaCl
BaCl2 + H2SO4
BaSO4 + 2HCl
BaCl2 + (NH4)2SO4
BaSO4 + 2NH4Cl
- Không t o k t t a v i BaCl2 là NaOHạ ế ủ ớ
- Khí sinh ra v i NaOH là (NH4)2SO4.ớ
(NH4)2SO4 + 2NaOH
Na2SO4 + 2H2O + 2NH3
- Ph n ng t a nhi t v i NaOH là Hả ứ ỏ ệ ớ
2
SO
4
H
2
SO
4
+ 2NaOH
Na2SO4 + 2H2O
- Còn l i là Na2CO3.ạ
Câu 2 (2,0 đi m).ể

1. Hình v minh h a sau đây dùng đ đi u ch và thu khí SOẽ ọ ể ề ế
2
trong phòng thí
nghi m:ệ
a. Nêu tên các d ng c thí nghi m trong hình v .ụ ụ ệ ẽ
b. Vi t 2 ph ng trình ph n ng minh h a t ng ng v i các hóa ch t A, B.ế ươ ả ứ ọ ươ ứ ớ ấ
c. Nêu vai trò c a bông t m dung d ch D, vi t ph ng trình minh h a.ủ ẩ ị ế ươ ọ
d. Cho 2 hóa ch t là Hấ
2
SO
4
đ c và CaO r n. Hóa ch t nào đ c dùng và khôngặ ắ ấ ượ
đ c dùng đ làm khô SOượ ể
2
. Gi i thích?ả
2. Khi nung hoàn toàn ch t A thu đ c ch t r n B màu tr ng và khí C không màu.ấ ượ ấ ắ ắ
Ch t B ph n ng mãnh li t v i n c t o thành dung d ch D. khi cho B tác d ng v iấ ả ứ ệ ớ ướ ạ ị ụ ớ
Cacbon nhi t đ cao thu đ c ch t E và gi i phóng khí F. cho E tác d ng v i n cở ệ ộ ượ ấ ả ụ ớ ướ
thu đ c khí không màu G. khí G cháy cho n c và khí C.ượ ướ
Xác đ nh các ch t A, B, C, D, E, F, G và vi t PTHH x y ra.ị ấ ế ả
H ng d n gi i:ướ ẫ ả
1.
a. Các d ng c trong hình v : Giá đ , đèn c n, l i amiăng, bình c u, ph u qu lê,ụ ụ ẽ ỡ ồ ướ ầ ể ả
ng d n khí, bình tam giác.ố ẫ
b. PTHH: Na
2
SO
3
+ H
2
SO
4
Na2SO4 + H2O + SO2
CaSO3 + 2HCl
CaCl2 + H2O + SO2
c. Khí SO2 có tính đ c, bông t m dung d ch D là NaOH nút trên mi ng bình thu khíộ ẩ ị ệ
đ tránh cho khí SO2 thoát ra bên ngoài.ể
NaOH + SO2
Na2SO3 + H2O
d. đ làm khô SO2 ph i dùng H2SO4 mà không dùng CaO vì CaO ph n ng v i SO2:ể ả ả ứ ớ
CaO + SO2
CaSO3






















